Alceno

A característica química dosAlcenos,também conhecidos comoalquenosouolefinas,é a presença da ligação dupla C=C.São classificados comohidrocarbonetosalifáticosinsaturados. Os alcenos mais simples, que apresentam apenas uma ligação dupla, formam umasérie homóloga,com fórmula geralCnH2n.[1]Os alcenos são a matéria-prima para vários produtos utilizados em nosso cotidiano: sacos de polietileno, vasilhames de polipropileno, canos de policloreto de vinila (PVC-polivinylchloride). Os alcenos são produzidos em quantidades de megatoneladas a partir do craqueamento do petróleo[carece de fontes]para a obtenção de polímeros.
Estrutura
[editar|editar código-fonte]Forma
[editar|editar código-fonte]
O modeloVSEPRde repulsão de pares de elétrons (verligação covalente), prevê que os ângulos das ligações em cada carbono da ligação dupla com uma ligação dupla sejam próximos a 120°. Pequenas variações ocorrem pelo maior requerimento angular devido ao tamanho do grupo ligado à dupla C=C. Por exemplo o ângulo de ligação no C-C-C nopropeno(propileno) é 123,9°. Os átomos ligados aos carbonos da dupla ligação estão em um mesmo plano, assim a ligação dupla C=C define uma região planar na molécula.
A ligação dupla não apresenta a possibilidade de rotação em torno da ligação C=C, e por isso os dois lados da ligação dupla podem ser diferentes, como o 2-buteno, que apresenta dois isômeros geométricos, chamados decis/transou E/Z.
Ligação química em alcenos
[editar|editar código-fonte]O modelo dateoria de ligação de valência(TLV) para os alcenos propõe que as ligações duplas sejam descritas através da sobreposição de orbitais atômicos dos átomos, utilizando o conceito dehibridizaçãode ligações químicas.
A ligação dupla de carbono-carbono consiste em uma ligação sigma e uma ligação pi e os carbonos da dupla ligação usam trêsorbitais híbridossp²para formar as ligações sigmas e os orbitais não hibridizados2pde ambos os carbonos, combinam-se para formar a ligação pi. A segunda ligação ocorre simultaneamente acima e abaixo do plano das ligações sigma e é mais fraca do que a primeira ligação. Enquanto uma ligação C-C simples tem entalpia de dissociação de 82 kcal/mol, a ligação dupla tem 62 kcal/mol.
A estabilidade relativa de alcenos depende da substituição da ligação dupla. A energia liberada em reações de hidrogenação que resultam em um mesmo produto é menor em alcenos com mais substituintes na ligação dupla do que em alcenos menos substituídos, o que é um evidência da menor energia relativa destes compostos. Alcenostranssão mais estáveis do que alcenoscis,pela repulsão entre os grupos no espaço.

Propriedades Físicas
[editar|editar código-fonte]A maior parte das propriedades físicas de alcenos e alcanos são semelhantes: baixo ponto de fusão e ebulição, insolúveis em água, baixa densidade e viscosidade. O estado físico depende da massa molecular: como os hidrocarbonetos saturados correspondentes: os alcenos mais simples, eteno, propeno e buteno são gases à temperatura ambiente. Alcenos lineares com aproximadamente cinco a dezesseis carbonos são líquidos e alcenos superiores são sólidos cerosos.
| Nome do alceno | Fórmula do Alceno | Formula Estrutural Simples | P.F. (ºC) | P.E. (ºC) | Grupo substituinte |
| eteno | C2H4 | H2C=CH2 | -169 | -103,7 | etil(a) |
| propeno | C3H6 | H2C=CH-CH3 | -185 | -47,7 | propil(a) |
| but-1-eno | C4H8 | H2C=CH-CH2-CH3 | -130 | -6,3 | butil(a) |
Alcenos geralmente têm cheiros mais fortes que o alcano correspondente. É descrito que o etileno tem um odor "doce", enquanto o etano é inodoro, por exemplo.
Nomenclatura
[editar|editar código-fonte]O nome conforme as regras da IUPAC para os alcenos é gerado pelo uso do prefixo indicando o número de carbonos da cadeia principal, seguido pelo sufixo en + o (indica que é um hidrocarboneto). O nome de CH2= CH2é eteno.
Em alcenos em que existe a possibilidade de isômeros que difiram pela localização da ligação dupla, é necessário indicar a posição da ligação dupla da seguinte forma:
- Numere a cadeia de carbono mais longa que contém a ligação dupla na direção que dá aos átomos de carbono da ligação dupla os números mais baixos possíveis.
- Indique a localização da ligação dupla pela localização do seu primeiro carbono.
- Nomeie alcenos ramificados ou substituídos de maneira semelhante aos alcanos.
- Numere os átomos de carbono, localize e nomeie grupos substituintes, localize a ligação dupla e nomeie a cadeia principal. Para formar a raiz dos nomes IUPAC para alcenos, basta alterar o -infixo do pai para -en-. As olefinas compreendem um amplo conjunto de alquenos cíclicos e acíclicos e também dienos e polienos.[2]
O nome de todos os alcenos começa com o prefixo (indicativo do número de carbonos) e termina com o sufixo -eno.

Notaçãocis-trans
[editar|editar código-fonte]No caso específico de alcenos dissubstituídos, em que os dois carbonos têm um substituinte cada, a notaçãocis-transpode ser usada. Se ambos os substituintes estão no mesmo lado da ligação, é definido comocis-.Se os substituintes estiverem em ambos os lados da ligação, é definido comotrans-.
NotaçãoE – Z
[editar|editar código-fonte]Quando um alceno possui mais de um substituinte (especialmente necessário com 3 ou 4 substituintes), a geometria da ligação dupla é descrita usando as letrasEeZ.Esses rótulos são provenientes das palavras alemãs entgegen, que significa "oposto", e zusammen, que significa "juntos". Os alcenos com os grupos de prioridade mais alta (conforme determinado pelas regrasCIP) do mesmo lado da ligação dupla têm esses grupos juntos e são designadosZ.Os alcenos com os grupos de prioridade mais alta nos lados opostos são designadosE.
Reatividade
[editar|editar código-fonte]
Os alcenos são mais reativos que outroshidrocarbonetose a principal reação é a adição de eletrófilos, em que os elétrons da ligação dupla são utilizados para a formação de ligações simples com os outros reagentes.
Hidrogenação
[editar|editar código-fonte]A hidrogenação de alcenos produz os alcanos correspondentes. A reação é realizada sob pressão a uma temperatura de 200°C na presença de um catalisador metálico. Catalisadores industriais comuns são baseados em platina, níquel ou paládio. Para sínteses de laboratório, o níquel Raney (uma liga de níquel e alumínio) é frequentemente empregado. O exemplo mais simples dessa reação é a hidrogenação catalítica do etileno para produzir etano:
CH2= CH2+ H2→ CH3– CH3
Adição Eletrofílica
[editar|editar código-fonte]A adição de HCl resulta na formação dehaloalcanosou haletos de alquila. A adição segue a regra deMarkovinikov,em que o átomo de hidrogênio se dirige ao carbono com mais hidrogênios e o halogênio se dirige ao carbono mais substituído. A adição de Cl ao propeno forma 95 % de2-cloropropanoe 5 % de1-cloropropano.[3]
A adição de água em meio ácido formaálcoois.Uma das maiores fontes deetanolé a hidratação (adição de água) deetileno,.Este processo é usado em países com pequena extensão territorial ou com climas não-propícios à produção decana-de-açúcar.A fermentação da cana forma etanol, que pode ser destilado resultando em bebidas como a cachaça ou combustível, como o álcool. O teor alcoólico máximo do destilado chega a 95 %, porém não passa deste valor pela formação de um azeótropo com a água.

A hidratação de alcenos em meio ácido segue a regra de Markovinikov, porém pode resultar no rearranjo estrutural por migração de hidreto, formando preferencialmente os álcoois terciários. Para evitar o rearranjo, a mercuração-demercuração é utilizada. A obtenção de álcoois primários pode ser realizada pela reação de hidroboração-oxidação.
A halogenação forma os dihaloalcanos vicinais. A adição é trans e resulta em diferentesdiastereoisômerosse a reação ocorre em alcenos cis ou trans.
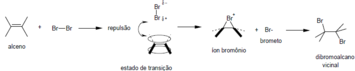
A reação com permanganato que formadióisvicinais cis, a oxidação comperácidos,que formaepóxidose areação de Diels-Aldercom dienos, que forma compostos cíclicos.
A reação de maior importância tecnológica é apolimerização,onde a ligação dupla dá origem a duas ligações com outras moléculas e assim por diante, formando grande parte dosplásticosusados no mundo, como polietileno,ABS (plástico)eborracha sintética.
Síntese e obtenção de alcenos
[editar|editar código-fonte]

Compostos com ligação dupla são relativamente comuns em biomoléculas.[4]Oetenoé um hormônio natural para o amadurecimento de frutas e essa propriedade é usada na indústria de alimentos. Normalmente, as frutas são colhidas ainda verdes, devido a problemas de transporte e armazenamento, e deixadas em grandes armazéns refrigerados. No momento de serem comercializadas, são colocadas em um recinto fechado e tratadas com gás etileno, o que faz com que o amadurecimento ocorra mais rapidamente. Mesmo em nível doméstico, pode-se usar essa propriedade do etileno para o amadurecimento de bananas, embrulhando em papel jornal ou deixando em um recipiente fechado para impedir que o eteno se disperse no ar; o octadeceno está presente no fígado de peixes e o limoneno está presente em cascas de frutas cítricas. Alguns feromônios (ousemioquímicos– moléculas sinalizadoras) são alcenos de cadeia longa, como omuscaluro(cis-9-tricoseno), feromônio de 23 átomos de carbono, produzido pela fêmea damoscadoméstica.
As principais reações de síntese de alcenos em laboratório são a eliminação a partir dehalogenetos de alquila,álcooise outras moléculas com grupos de saída e a reação de Wittig.
Aeliminação βpode ocorrer através do mecanismo E2 ou E1, sendo que o mecanismo E2 requer o uso de bases fortes para a abstração do hidrogênio β ao grupo de saída (um halogênio ou éster de alquilsulfonato). Para produtos não simétricos, os alcenos mais substituídos (aqueles com menos hidrogênios ligados ao C = C) tendem a predominar (consulte aregra de Zaitsev).[5]
A desidratação de álcoois por ácidos fortes, como o ácido sulfúrico, ocorre pelo mecanismo E1. Por exemplo, a desidratação do etanol produz eteno, que tem sido utilizado na produção de "polietileno verde",[carece de fontes]com a ideia de remover dióxido de carbono da atmosfera a partir da fixação por vegetais e o uso da biomassa na produção de plástico.
Areação de Wittigenvolve a reação de um aldeído ou cetona com um fosforano do tipo Ph3P = CHR para produzir um alceno e Ph3P = O. O fosforano é equivalente a um carbânion, preparado a partir de trifenilfosfina e um halogeneto de alquila.

A reação é bastante geral e muitos grupos funcionais são tolerados, mesmoésteres,como neste exemplo[6]:

Referências
- ↑Usberco e Salvador, Química, Volume único, Editora Saraiva, 9 ed,2013.
- ↑«Olefins».IUPAC.Consultado em 25 de novembro de 2017
- ↑Química Orgânica Vol. 1: Volume 1, 2012, Craig B. Fryhle, T. W. Graham Solomons
- ↑Fundamentos de Química Orgânica - Ciências da Vida e Saúde, Márcio Lazzarotto (ebook )
- ↑Cram, Donald J.; Greene, Frederick D.; Depuy, C. H. (fevereiro de 1956).«Studies in Stereochemistry. XXV. Eclipsing Effects in the E 2 Reaction 1».Journal of the American Chemical Society(em inglês).78(4): 790–796.ISSN0002-7863.doi:10.1021/ja01585a024
- ↑Snider, Barry B.; Matsuo, Y; Snider, BB (2006). "Synthesis of ent-Thallusin".Org. Lett.8(10): 2123–6. doi:10.1021/ol0605777. PMC 2518398. PMID 16671797.
- «Alcanos, alcenos e alcinos».www2.ufp.pt.Consultado em 27 de abril de 2012.Arquivado dooriginalem 4 de Maio de 2012
- «Orgânica».www.prof2000.pt.Consultado em 27 de abril de 2012
- Brown, LeMay, Bursten,Química – A Ciência Central,Cap.25 Hidrocarbonetos Insaturados, 9ed, 2005
- Ponto de fusão e ebulição do eteno http://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=ETILENO Consultado em 01 de maio de 2018
- Ponto de fusão e ebulição do propeno http://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=PROPILENO Consultado em 01 de maio de 2018
- Ponto de fusão e ebulição do buteno http://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=BUTILENO Consultado em 01 de maio de 2018
- USBERCO, J.; SALVADOR, E. Química Orgânica 3, Cap. 4 Grupos orgânicos substituintes e radicais, 8 ed, 2006
