Bicarbonato
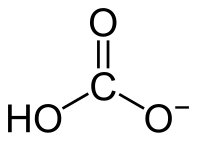
Bicarbonatos(ou hidrogenocarbonatos) sãosaisinorgânicos que contêm oânionHCO3-.Quimicamente, eles são resultantes de uma reação desalificaçãoparcial.[1]O bicarbonato mais conhecido é obicarbonato de sódio.Devido a suasolubilidaderelativamente baixa, ele é um intermediário no processo de obtenção docarbonato de sódio,seguindo o método desenvolvido porErnest Solvay.Em solução, o bicarbonato se encontra em equilíbrio comcarbonato,águaedióxido de carbono.Este equilíbrio é recorrente em processos naturais e artificiais. O fato de que obicarbonato de cálcio(Ca(HCO3)2) é mais solúvel do que ocarbonato de cálcio(CaCO3) é importante emgeoquímica.
Aspectos gerais
[editar|editar código-fonte]O bicarbonato é umíonpoliatômico cuja fórmula química é HCO3-,apresentando massa molar de 61,017 g mol-1.Em sua estrutura, oátomodecarbonoestácovalentementeligado aos três átomos deoxigênioem um arranjo planar trigonal, sendo que um oxigênio também está ligado aohidrogênio.Assim, suas interações atômicas são fortes. O ânion bicarbonato é uma espécie química intermediária naespeciação químicadoácido carbônicoem umasolução,apresentando tanto um caráterácidocomobásico.Ao mesmo tempo, ele é umabase conjugadado ácido carbônico (H2CO3) e umácido conjugadodo íoncarbonato(CO32-).[2]
O bicarbonato é uma importante espécie química dosistema carbonatoemsoluções naturais tamponadas,como osanguehumano e aágua do mar.Assim, o sistema carbonato atua para diminuir as variações depHnessas soluções.
Sais de bicarbonato
[editar|editar código-fonte]- Bicarbonato de sódio:NaHCO3
- Bicarbonato de cálcio:Ca(HCO3)2
- Bicarbonato de potássio:KHCO3
- Bicarbonato de amônia:NH4HCO3
Aplicações
[editar|editar código-fonte]Além do seu importante papel no sistema carbonato, o ânion bicarbonato também é usado em tratamentos medicinais para combater doençasestomacais.Ele é muito utilizado na culinária na forma de bicarbonato de amônia, que é umfermentode alta qualidade para a fabricação de produtos de confeitaria. Sais de bicarbonato ainda são utilizados na limpeza de residências e estão presentes na composição química de alguns extintores de incêndio.
Sistema carbonato
[editar|editar código-fonte]Reações químicas
[editar|editar código-fonte]
Par conjugado bicarbonato-carbonato
[editar|editar código-fonte]Nas condições químicas existentes emsoluções aquosas,há o favorecimento das trocasmolecularesdeprótons,alcançando um equilíbrio de cargas. Segundo ateoria de Brønsted-Lowry,essas interações resultam na troca de íon hidrogênio (H+) entre os pares conjugados.[3]Em soluções naturais como o sangue humano e a água do mar, pode-se observar esse tipo de interação entre pares conjugados do sistema carbonato. Neste caso, os íons bicarbonato (HCO3-) e carbonato (CO32-) interagem a partir da doação de prótons para buscar a estabilidade de suas cargas, diferenciando-se por apenas um átomo de hidrogênio em suas fórmulas químicas.[4]
Sistema carbonato sanguíneo
[editar|editar código-fonte]Nafisiologiado corpo humano,pulmãoerinssão órgãos responsáveis pelo controle do pH sanguíneo, eliminando respectivamente dióxido de carbono (CO2) e bicarbonato (HCO3-). Este último é eliminado naurina.Esse mecanismo de reações químicas do sistema carbonato tampona o pH do sangue em torno de 7,4, apresentando uma faixa saudável de variação entre 7,35 e 7,45. O excesso de ácidos ou bases no sangue gera distúrbios conhecidos comoacidoseealcalose,respectivamente.
Sistema carbonato marinho
[editar|editar código-fonte]O sistema carbonato marinho envolve aatmosfera,a coluna de água dooceanoe osedimento marinho.A interação dos gases presentes na atmosfera com a superfície do oceano permite a transferência de dióxido de carbono (CO2) para a coluna de água marinha, conforme caracterizado na primeira reação do sistema carbonato. O dióxido de carbono dissolvido reage com a molécula de água, para formar ácido carbônico (H2CO3). Como se trata de umácido fraco,ele buscará uma forma mais estável. Sendo assim, a molécula dissocia-se para produzir umcátionhidrogênio (H+) e um ânion bicarbonato (HCO3-). Este pode perder mais um cátion H+para a formar o ânion carbonato (CO32-). Por fim, este pode reagir com íoncálcio(Ca2+) presente na água do mar para a formar carbonato de cálcio (CaCO3).[2]A última reação desse sistema é fundamental para a manutenção de diversos organismos calcificantes presentes no oceano, ou seja, aqueles que secretam estruturas de carbonato de cálcio. Exemplos dessas estruturas no oceano são as conchas dosmoluscose osrecifes de coral.[5]
O sistema carbonato marinho é o mecanismo pelo qual a água do mar estoca carbono inorgânico na forma dissolvida. Ele também é responsável pelo tamponamento do pH da água do mar, que varia em torno de 8,0 ± 0,2. As três espécies químicas de carbono inorgânico dissolvido (CO2,HCO3-e CO32-) podem ser absorvidas pelos organismos marinhos. Em função do pH da água do mar, o bicarbonato é a principal espécie dissolvida no oceano, representando cerca de 80% do carbono inorgânico total. Mais de 30% do dióxido de carbono (CO2) existente na superfície da Terra está armazenado nos oceanos.[6]
Acidificação do oceano
[editar|editar código-fonte]O oceano é um grande reservatório de carbono inorgânico dissolvido, sendo a maior parte armazenada na forma de bicarbonato. No entanto, asemissões antrópicasde dióxido de carbono na atmosfera estão diminuindo as proporções de bicarbonato e carbonato nos oceanos. A principal consequência disso é aacidificação oceânica,com a diminuição do pH da água do mar. Estima-se que o pH na superfície do oceano era 8,2 antes daRevolução Industriale atualmente está em torno de 8,1.[7]Até o final doséculo XXI,o pH da água do mar pode sofrer uma redução de 0,1-0,2 unidades em relação ao pH atual.[carece de fontes]Uma das consequências dessa acidificação é uma redução na profundidade dalisoclina,região da coluna de água na qual o carbonato de cálcio depositado no sedimento marinho passa a se dissolver rapidamente. Isso causará prejuízos aos organismos que precisam secretar estruturas carbonáticas para a manutenção da vida.[8]Os hábitos de vida e osistema metabólicodesses organismos serão afetados. Alterações deverão ser observadas na capacidade adaptativa, capacidade de proteção e nos sentidos (audição,visão,equilíbrio) dessas espécies, podendo resultar em falhas no seu desenvolvimento estrutural, corporal e até na idade dematuração sexual.[7]As espécies biológicas que não se adaptarem à acidificação da água do mar serãoextintas.
Ver também
[editar|editar código-fonte]Referências
- ↑«Bicarbonato».Encyclopædia Britannica Online (em inglês).Consultado em 28 de novembro de 2020
- ↑abMillero, Frank J. (2013).Chemical oceanography4th ed ed. Boca Raton: Taylor & Francis.OCLC958798815
- ↑«Teoria ácido-base de Brønsted-Lowry»
- ↑Atkins, P. W. (2010).Chemical principles: the quest for insight.Loretta Jones 5th ed ed. New York: W.H. Freeman.OCLC501943698
- ↑Fogaça, Jennifer.«Carbonatos».Consultado em 19 de agosto de 2021
- ↑Marine Biogeochemical Cycle2 ed. [S.l.]: Open University. 2005. p. 130
- ↑abSouza, Joice.«Acidificação oceânica».Consultado em 19 de agosto de 2021
- ↑Orr, James C.; Fabry, Victoria J.; Aumont, Olivier; Bopp, Laurent; Doney, Scott C.; Feely, Richard A.; Gnanadesikan, Anand; Gruber, Nicolas; Ishida, Akio (setembro de 2005).«Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms».Nature(em inglês) (7059): 681–686.ISSN1476-4687.doi:10.1038/nature04095.Consultado em 19 de agosto de 2021





