CRISPR

|
Este artigo faz parte de uma série sobreCRISPR |
|---|---|
| |
O sistemaCRISPR(do inglêsClustered Regularly Interspaced Short Palindromic Repeats), ou seja, RepetiçõesPalindrômicasCurtas Agrupadas e Regularmente Interespaçadas, consiste em pequenas porções doDNAbacterianocompostas por repetições denucleotídeos.Cada uma dessas repetições encontra-se adjacente a um “protoespaçador” ( “espaçador de DNA” ), que corresponde a uma região não-codificante inserida no DNA bacteriano após o contato com genomas invasores provenientes debacteriófagosouplasmídeos.AtranscriçãodolocusCRISPR resulta em pequenos fragmentos deRNAcom capacidade de desempenhar o reconhecimento de um DNA exógeno específico e atuar como um guia de modo a orientar anucleaseCas, que irá promover a clivagem e consequente eliminação do DNA invasor caso este entre novamente em contato com a bactéria, atuando como importante mecanismo de defesa contra DNAs invasores[1][2].
O CRISPR é frequentemente usado como um termo geral para se referir àedição genômica,mas é o acoplamento do CRISPR e do sistemaCas9que permite a deleção seletiva do DNA[3].Diversos são os mecanismos pelos quais a molécula deRNAguia pode ser sintetizada, entretanto, o sistema tipo II no qual baseiam-se os sistemas atualmente disponíveis para realização da edição gênica, requer a presença de um RNA transativador (tracRNA), e uma molécula pequena de RNA complementar à sequência repetida capaz de associar-se ao transcrito inicial dolocusCRISPR, denominada CRISPR RNA (crRNA-sequências que consistem em um protoespaçador ligado a uma sequência repetida com estrutura de grampo). Esta associação origina o complexo tracRNA-crRNA, uma molécula de RNA dupla fita que após ser processada pelaRNaseIII é convertida em uma molécula híbrida madura com função importante no que diz respeito à associação e direcionamento de uma nuclease para eliminação do DNA invasor. Nesse sistema especificamente, a nuclease envolvida na clivagem refere-se àProteína Associada a CRISPR 9(Cas9)[1][2].
A alta taxa de insucesso, custo elevado e excesso de tempo necessário para realização das metodologias disponíveis para edição gênica, tais como Recombinação Homóloga (comumente empregada na manipulação genica decélulas-tronco),Nucleases Dedos de Zinco(ZFN, do inglêsZinc Fingers Nucleases) eNucleasesEfetoras semelhantes à Ativadores de Transcrição (TALENs, do inglêsTranscription Activator–like Effector Nucleases), estas duas últimas requerem o reconhecimento em ambas as fitas de DNA para que a clivagem promovida por nucleases sintetizadas especificamente para tais metodologias seja bem sucedida, o que nos permite considerar tais métodos mais trabalhosos quando comparados ao sistema CRISPR[4].
A junção de todos estes fatores fez com que a recente descoberta de umsistema imunebacteriano contrafagose plasmídeos invasores ganhasse destaque no que diz respeito a técnicas de edição gênica e obtenção de organismos geneticamente modificados (OGMs)[2][5][6].
Atualmente encontra-se disponível um gRNA (RNA guia) que consiste na construção de uma molécula de RNA desenvolvida biotecnologicamente, com a capacidade de mimetizar o que ocorre naturalmente em bactérias, e desta forma, promover o direcionamento da nuclease Cas9 para uma sequência alvo específica para que esta promova a clivagem e a sequência de interesse tornando esta disponível para atuação da maquinaria de reparo da célula e assim, promover edição da porção de interesse presente nogenomaalvo. Tais fundamentos nos permitem considerar o sistema CRISPR (CRISPR/Cas) uma técnica rápida, com relativa facilidade de manipulação e baixo custo quando comparada a técnicas anteriores[1][6].No entanto, este sistema não é restrito a bactérias, o gigantescoMimivírus[7]se defende de invasores utilizando um semelhante sistema CRISPR implementado por bactérias e outros microorganismos. O sistema de defesa do Mimivírus pode levar a novasferramentasdeedição de genoma[8].
Histórico
[editar|editar código-fonte]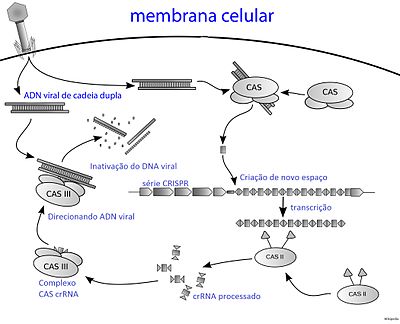
Originalmente encontradas no genoma deEscherichia coliem 1987 e descritas por Yoshizumi Ishino e colaboradores[9],as sequências curtas intercaladas regularmente só começaram realmente a ser investigadas no início dos anos 2000, sendo então encontradas em diversos outros organismosprocarióticos,tanto do domínioBacteria,quantoArchaea[10]e em 2002 a sigla CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) foi criada para denominar tais sequências[11].Francisco Mojica descobriu CRISPR de forma independente em 1993 e em 2003, ele descobriu que o DNA repetitivo nas bactérias geralmente ficava ao lado de pedaços de DNA que combinavam com vírus que atacavam esse tipo de bactéria[12].
Somente em 2005 foram obtidas as informações necessárias para indicar a função destesloci.Foi descrito que as sequências espaçadoras têm origem extracromossômica, sendo derivadas de sequências de plasmídeos ou devírus.Além disso, foi também descrito quevírustornam incapazes de infectararqueiasque possuem sequências espaçadoras correspondentes ao seu genoma, inseridas após uma infecção prévia[13][14][14][15].
No ano seguinte foi postulada a hipótese de que o CRISPR é um sistema de defesa adaptativo debactériasearqueiasque faz uso deRNAantisenso como assinaturas de memória de invasões anteriores[16].Esta proposta recebeu o suporte necessário quando foi evidenciada experimentalmente emStreptococcus thermophilus[6],levando a sua primeira aplicação no campo dabiotecnologia,a fim de imunizar bactérias utilizadas na indústria de laticínios contra infecção porbacteriófagos[17].
Evidências obtidas em seguida mostraram que as sequências espaçadoras de DNA invasor intercaladas com os arranjos de repetições intrínsecas são transcritos em grandes moléculas de RNAs, e estas são cortadas em pedaços menores pela nuclease Cas9 auxiliada pelo tracrRNA, tornando-se crRNAs, que por sua vez formam complexos com asproteínastipo Cas. O complexo age de forma a impedir a proliferação viral em bactérias, devido a capacidade de clivagem do DNA invasor pela Cas9, o complexo tracrRNA-crRNA tem um papel fundamental no direcionamento desta nuclease, tendo o DNA invasor como alvo[18][19][20].Nos últimos anos, estudos mostraram que aparentemente a Cas9 é a principal nuclease envolvida no processo de clivagem de DNA invasor[21][22]dentre os vários tipos de Cas descritos, algumas ainda precisam ter suas funções elucidadas.
Em 2011, foi demonstrado que é possível transferir a memória imune de uma espécie de bactéria para outra, gerando novas possibilidades de aplicações do mecanismo[23],o que levou aos estudos que mostraram que Cas9 purificadas são capazes de clivar DNA alvoin vitroquando guiadas por crRNAs[24][25].O que resultou na utilização do sistema CRISPR como uma ferramenta deengenharia genética,tornando possível editar com sucesso o genoma de células de mamíferos, assim como de inúmeros outros sistemas modelos[2][26][27].
Diversidade do Sistema
[editar|editar código-fonte]OlocusCRISPR é composto por cerca de 20 a 50 pares de base, normalmente dispostos simetricamente, o que favorece a formação de uma estrutura em “grampo” ou “hairpin”.Nestelocussão encontradas repetições separadas por protoespaçadores de tamanho similar, os quais podem ser adicionados rapidamente como parte da resposta imune bacteriana contra infecção ocasionada porfagosalém de variar em tamanho e sequência[1][13].
Têm sido descrito que dentre os 198 genomas completos disponíveis no banco de dadosNCBI,é possível encontrar cerca de 50 genomas onde o gene Cas1 está presente[13].Além disso, sabe-se que a grande maioria dos “protoespaçadores” possui homologia com genes conhecidos, frequentemente provenientes de elementos extra-cromossômicos tais comofagose plasmídeos[13].EmYersinia pestisestas repetições ocorrem preferencialmente pela absorção do DNA de bacteriófagos[1].
O primeiro estudo demonstrando como ocorre o direcionamento do complexo CRISPR/Cas9, de modo a permitir a ligação com a sequência complementar do gene alvo, e eliminação de um agente infeccioso em bactérias ocorreu emStreptococcus thermophilusem 2010[1][21].
Atualmente, sabe-se que este distinto sistema imune pode ser dividido em três tipos principais, baseado na conservação dos genes e organização dosloci(CRISPR Tipo I, Tipo II e Tipo III)[28].
Uma particularidade do sistema CRISPR Tipo I se dá pela presença de ao menos um gene que codifique a nuclease Cas3, a qual participa ativamente na clivagem de uma molécula de DNA invasor[28].
O sistema CRISPR Tipo II é considerado o mais robusto para aquisição de plasmídeos efagos.Nele são encontrados apenas quatro genes, dentre os quais sempre haverá ao menos um gene que codifique a nuclease Cas9, a qual pode participar tanto no processamento de RNA quanto na eliminação do DNA alvo[5][28].
Uma peculiaridade pode ser observada no sistema CRISPR Tipo III, que foi subsequentemente dividido em dois subtipos. Tais sistemas foram denominados como CRISPR TipoIII-A, o qual é capaz de atuar sobre DNA plasmidialin vivo,e CRISPR Tipo III-B responsável pela clivagem apenas de RNA fita simplesin vitro.Estas observações sugerem que seja possível a existência de diferentes mecanismos de atuação envolvendo subtipos distintos de CRISPR[1][28].
Vale ressaltar a possibilidade de encontrar mais de um sistema CRISPR em um mesmoorganismo,o que claramente demonstra a compatibilidade entre estes sistemas, bem como a possibilidade de compartilhamento dos componentes funcionais presentes nos diferentes sistemas[1].
Recentemente, verificou-se a capacidade de fagos em promovermutaçõesem seu genoma de modo a conseguir evadir a resposta imune bacteriana. Esta capacidade tem sido considerada o modelo básico deevoluçãoCRISPR, uma vez que tais mutações impossibilitam a complementaridade do sistema tracRNA/crRNA com o fago e, portanto, impedem a associação com anucleaseCas9 e a subsequenteclivagemdo DNA invasor[18][29].No entanto, os cientistas que disseram que o CRISPR é perigoso não podem sequer replicar seus próprios resultados.[30]
Mecanismo de Atuação da CRISPR
[editar|editar código-fonte]De maneira geral, todos os mecanismos CRISPR expressam as mesmas vias de aquisição, expressão e interferência, conforme descrito a seguir[28]:
a)Aquisição de novos protoespaçadores:Geralmente realizada através do reconhecimento e clivagem deácidos nucleicosexógenos mediados por Cas1 e Cas2 para sua integração aocromossomobacteriano em regiões conhecidas comolocusCRISPR[28].
b)Transcrição completa do locus CRISPR como um pre-crRNA:Processamento e amadurecimento do transcrito em pequenas moléculas de RNA (crRNA) capazes de reconhecer uma única sequencia alvo[28].
c)Associação com proteínas Cas:Formação de complexo ribonuclear capaz de guiarnucleasesde maneira especifica em direção ao DNA alvo presente embacteriófagose plasmídeos[28].
Aquisição de Protoespaçadores
[editar|editar código-fonte]A integração de uma nova informação noslociCRISPR inicia-se pela imunidade bacteriana mediada por esse sistema, onde uma pequena porção do DNA invasor, é integrada aolocusCRISPR dohospedeirocomo um protoespaçador através da atuação denucleasesespecíficas[1].
Devido à alta afinidade encontrada entre a nuclease Cas1 eácidos nucleicos,tem sido sugerido que estaenzimapossua papel significativo no que se refere a integração e aquisição de novos protoespaçadores. Além disso, a ausência de necessidade de uma sequencia especifica de nucleotídeos para o acontecimento deste tipo de ligação com a Cas1 reforça esta ideia, uma vez que esta poderia atuar sobre qualquer seqüência protoespaçadora presente nogenomaviral[1].
Outro ponto importante a ser destacado no que diz respeito a aquisição de novos protoespaçadores é a importância da manutenção da estrutura dolocus.Desta forma, seguida da adição de um novo protoespaçador, uma nova sequencia de repetição CRISPR é sintetizada favorecendo a organização “repeat-spacer-repeat”,essencial para o reconhecimento dolocusCRISPR[1].
A organização dolocusCRISPR tem sido sugerida como ferramenta de grande valia para a distinção entre um DNA invasor e o do genoma hospedeiro pela maquinaria de reparo celular. Além disso, há relatos de que a seqüência líder possua elementos capazes de promover o recrutamento deste mecanismo de reparo celular de modo a favorecer a integração do protoespaçador no DNA bacteriano[1].
Os sinais moleculares envolvidos neste processo de distinção ainda não estão completamente elucidados. Contudo, o mapeamento das sequências espaçadoras presentes nos genomas virais revelam uma seqüência de poucos nucleotídeos de comprimento próxima ao protoespaçador, denominada Motivo Adjacente ao Protoespaçador (Protospacer Adjacent Motif- PAM)[13][31].
Cada domínio PAM pode ter a sequência variável de acordo com o tipo de sistema CRISPR, sugerindo que proteínas Cas presentes nos distintos tipos de CRISPR estejam envolvidas no reconhecimento do domínio PAM[1][5][32].
Transcrição dolocusCRISPR
[editar|editar código-fonte]Tipo I
[editar|editar código-fonte]O sistema CRISPR Tipo I pode ser dividido em 6 subtipos categorizados de A a F. Neste sistema, a transcrição dolocusCRISPR é seguida pela dobragem sobre si mesma das sequências repetidas para formar estruturas em grampo (hairpins) entre os protoespaçadores, seguida da clivagem do transcrito mediada pela nuclease Cas6e/f originando crRNA[33].Um complexo efetor conhecido como Cascade (Complexo associado a CRISPR para defesa antiviral) reúne cinco proteínas Cas[33][34]ligadas ao crRNA. Este complexo é direcionado à sequência apropriada presente no DNA invasor por meio de reconhecimento do domínio PAM na fita complementar do crRNA[35].Uma vez que a identificação da sequência tenha sido estabelecida, uma mudança conformacional em Cascade recruta Cas3, a qual cliva o ácido nucleico invasor de modo sequência-específica[33].
Tipo II
[editar|editar código-fonte]O sistema do tipo II é comumente encontrado emArchaeae pode ser dividido em 3 subtipos distribuídos de A a C[33].
Neste caso, a transcrição dolocusCRISPR é seguida pelo pareamento de bases do tracrRNA à sequência repetida localizada entre os protoespaçadores[33].A clivagem do dsRNA pela RNaseIII em fragmentos de sequências formadas por um único proto-espaçador[22]juntamente com a porção 3’ da sequência repetida é denominado crRNA[32].O tracrRNA se liga à sequência repetida complementar do crRNA e essa molécula híbrida associa-se à nuclease Cas9 para promover o seu direcionamento à sequência apropriada do DNA invasor usando o domínio PAM como guia[32].A proteína Cas 9 é constituída por cerca de 800-1400aminoácidos,com uma estrutura de 2 lóbulos[36]que possui dois sítios com atividadenuclease:O RuvC-like (RNase-H fold) responsável pela clivagem da sequencia não alvo e o domínio HNH (McrA-like) responsável pela clivagem da sequencia alvo[32].Posterior ao reconhecimento, a clivagem do DNA invasor mediada pelo complexo Cas9-crRNA-tracrRNA é realizada importante destacar que ao contrario do sistema Tipo I, o reconhecimento do domínio PAM no sistema Tipo II ocorre na mesma fita do crRNA[37][38].
Tipo III
[editar|editar código-fonte]Sistemas CRISPR CAS Tipo III compreendem dois subtipos, III-A e III-B, ambos possuem o gene CAS 10 específico dos sistemas Tipo III, entretanto podem ser diferenciados pelos genes acessórios: csm no subtipo III-A e cmr no subtipo IIIB[28].Além disso, eles não requerem domínios PAM para o reconhecimento da sequencia alvo por parte do crRNA ou para sua clivagem[33].A transcrição do locus CRISPR é seguida pela ligação do transcrito ao redor de Cas6 e pela clivagem 8 nucleotídeos a montante da junção entre a sequência repetida e o protoespaçador. Isto resulta em uma série de protoespaçadores com sequências repetidas nos dois extremos, 5’ e 3’, similar aso Tipo II[33].Entretanto, enquanto no Tipo II a clivagem é realizada no extremo 5’ deixando a porção 3’ da sequência repetida ligada ao protoespaçador, no Tipo III a clivagem ocorre no extremo 3’ e deixa cada protoespaçador com a porção 5’ da sequência repetida[33].
No Tipo III-A a maturação do crRNA intermediário é essencial para a interferência dirigida. De fato, enquanto os crRNAs intermediários podem ser ligados dentro do complexo proteico csm-Cas10 (conforme mencionado abaixo), o subsequente complexo ribonucleoprotéico é incapaz de degradar o DNA invasor[39].
No Tipo III-B o crRNA é tomado pelo complexo de proteínas conhecido como cmr (módulo Cas RAMP, proteínas misteriosas associadas a repetições)[38].Diferentes proteínas membros dos módulos RAMP podem ser expressas entre diversas espécies. Os complexos cmr usualmente consistem de váriasproteínasCas (tipicamente Cas1-6)[38].De fato, existem diversasfamíliasidentificadas dos complexos cmr que quando complexadas com Cas10 realizam clivagem de RNA através da interação de complementaridade de pares de bases do crRNA com o RNA invasor[37].
Os sistemas do Tipo III-A são geralmente caraterizados pela presença degenescsm (tipicamente csm 2-5 – membros da superfamília RAMP) os quais, da mesma forma que os genes cmr, codificam para proteínas envolvidas na formação do complexo com Cas10 e subsequente degradação do DNA invasor guiado por crRNA, num modo sequência específico[33].
Benefícios do Sistema
[editar|editar código-fonte]Inúmeras são as vantagens obtidas pelo emprego do sistema CRISPR uma vez que trata-se de uma metodologia rápida, fácil com baixo custo e principalmente com alta taxa de sucesso devido a sua alta sensibilidade para o reconhecimento de sequências específicas presentes no DNA alvo de células em cultura ou até mesmo em modelos animais[31].
Com o emprego desta metodologia é possível avançar mais rapidamente no ramo daengenharia genéticae no estudo funcional gênico, o que pode ser justificado pela capacidade desta ferramenta em excluir ou modificar genes específicos para obtenção deorganismos geneticamente modificadospassíveis de serem empregados como modelo de estudo para compreensão de condições fisiopatológicas nas mais diversas espécies[5][40].
Aplicações
[editar|editar código-fonte]Aplicações de CRISPR abrangem quase todos os setores envolvendo sistemas biológicos. Danisco (DuPont) foi um dos pioneiros na utilização comercial da tecnologia CRISPR para aumentar a imunidade viral embactériasutilizadas para a produção deiogurtesequeijos[41].
Aplicações na agricultura têm obstáculos regulatórios mais baixos do que aplicação biomédica e alguns desses mercados preveem o retorno dos investimentos muito rapidamente. Dow AgroSciences desenvolveu propriedade intelectual com Sangamo Biosciences para o desenvolvimento de culturas geneticamente modificadas utilizando Cas9, e Cellectis Ciências Vegetais está levando a tecnologia para as plantações[42].
CRISPR tem o potencial para se tornar uma força importante naecologiae conservação, especialmente quando combinada com outras ferramentas debiologia molecular.Pode, por exemplo, na criação de genes que atrasem disseminação deespécies invasorascomoervas daninhas.Pode vir a ser o próximo grande salto na conservação ou melhoraria domeio ambiente[43].Aplicações baseadas em Cas9 naindústria agrícolae em setores da saúde humana encontram-se em crescimento acelerado. Estes mercados incluem:terapia gênica,terapia celulareimunoterapia,o desenvolvimento rápido e eficiente de pesquisa de animaistransgênicos,descoberta demedicamentos,bem como a validação de alvo e de triagem[44].
Regulação
[editar|editar código-fonte]A modulação da transcrição de diferentes alvos genéticos tem usado cada vez mais atecnologia CRISPR/Cas9em substituição aos modelos atuais, comoRNA interferência,ZFNe TALENs. Estas técnicas apresentaram limitações por serem trabalhosas e demoradas, enquanto que nas primeiras tentativas de inativação de gene alvo com CRISPR/Cas9 foram obtidos bons resultados[45].
Conforme citado anteriormente, o uso em produtoslaticíniosé um dos principais exemplos de aplicação. Tais produtos comumente sofrem infecções porfagoso que prejudica ciclos defermentaçãonormais e diminui a qualidade do produto final. Para contornar esse problema as indústrias criaram cepas de bactérias resistentes a fagos[46].
A técnica se baseia no sistema CRISPR tipo II com uso daS. thermophilus,já envolvida no processo de acidificação do leite. Com a edição do gene alvo e ação dasenzimasCas, há o controle do espaçador e defesa contrafagos.Tal procedimento permite o isolamento de cepas resistentes a váriosbacteriófagos,mas que ainda conservam as mesmas propriedades deculturaoriginal[6][47].
Experimentos de perturbação dos genes para analisar sua função ou esclarecer a causa de variantes genéticos têm sido feitos com facilidade diante da simplicidade da Cas9 em direcionar um RNA guia. Assim, uma variedade de proteínas ou ssRNA podem ser ligados a Cas9 ou sgRNA (single guide RNA) para modificar a transcrição específica de genes, monitorar posição dacromatina,ou até mesmo manipular a organização tridimensional dogenoma[6].
Modelos celulares e animais
[editar|editar código-fonte]A caracterização dosfenótiposda doença é um dos principais objetivos para a geração deanimais geneticamente modificados.Transformações genéticas em animais, simulando asmutaçõesencontradas em humanos, permitem determinar a função de genes, estruturas reguladoras e confirmação de resultados obtidos emcultura de células[45].
A edição genômica mediada por Cas9 permitiu geração acelerada de modelos geneticamente modificados e ampliando as pesquisas biológicas tradicionais de estudo de organismos-modelo, podendo ser aplicada para desenvolver novas modificações gênicas com introdução ou correções de mutações específicasin vivo[2][32].
Como exemplo disso, já foi possível observar modificações de genes alvo de forma eficaz através da micro-injeção em células embrionárias de peixe-zebra, injetandomRNAque codifica uma Cas9 personalizada. Ou ainda a injeção de Cas9/mRNA e sgRNAs com diferentes genes alvos dezigotosde camundongos, levando ao desenvolvimento de mutações em determinadosalelos,reforçando que a utilização de CRISPR/Cas pode ser empregado para a modificação de múltiplos genes ao mesmo tempo[48].
A partir de 1981 foram desenvolvidos os primeiros camundongostransgênicos,e processo precisou ser melhorado até se alcançar uma metodologia mais adaptável e fácil de usar[49].Os métodos tradicionais para criar modelos de animais geneticamente modificados costumavam levar de 8 a 13 meses de trabalho, tornando-se um processo laborioso e custoso, já usando CRISPR /Cas9, para criar animaistransgênicos,foi possível observação defenótipoalbinoapós uma única micro-injeção emembriõesde camundongo da linhagem C57BL/6J, ressaltando que este tipo deroedortem como característica pelagem marrom escuro[49].
Dessa maneira, podemos perceber que CRISPR simplifica o desenvolvimento de animais para estudo em pesquisa que simulem doenças ou exponham as consequências quando umgeneénocauteadoou mutado de maneira especifica[32].
Mapeamento genômico e funcional
[editar|editar código-fonte]A identificação de genes responsáveis por um dadofenótipode interesse é facilitada pelo sistema CRISPR/Cas9, devido a sua habilidade de alterar diferentes alvos, individualmente ou mesmo simultaneamente[48].Estudos realizados com a tecnologia de CRISPR estão confirmando sua capacidade de rastreio genômico através da manipulação dosdomínios catalíticosde Cas, sendo possível a construção de sistemas de repressão (CRISPRi) e ativação (CRISPRa)[48].
A CRISPRi é usada para controle da transcrição com uso de Cas9 (dCas9) com mutações nos domínios catalíticos tornando-a deficiente em atividade nucleolítica ou através de sgRNA sendo utilizado como alvo na região dopromotor,gerando impedimento estérico na associação entre os motivos de DNA e seusfatores de transcrição,levando a contenção do início datranscrição.Sendo assim, CRISPRi é uma forma eficiente de redirecionamento do genoma para a manipulação datranscriçãosem modificar a sequência de alvo de DNA[50].
CRISPRa tem como objetivo aumentar atranscriçãode certo gene com o uso da dCas9, citada anteriormente, fusionado a domínios de ativação da transcrição e esse complexo é direcionados para aregião promotorade genes endógenos, possibilitando a modulação daexpressão do gene[51].
CRISPRi e CRISPRa em estudos de escala genômica vem buscando genes endógenos que atuem como repressores ou ativadores transcricionais relacionados a supressão detumores,regulação de diferenciação e a sensibilidade celular paracóleraou toxina dadifteria,por exemplo, demonstrando suas aplicações como ferramentas fundamentais para complexos de mapeamento[52].
CRISPR no tratamento de doenças infecciosas
[editar|editar código-fonte]Conforme definição o complexo CRISPR/Cas age como um sistema imune adaptativo antiviral em bactérias, dessa forma, pode ser empregado para o tratamento de doenças infecciosas em indivíduos contaminados pela eliminação do genoma doagente infeccioso[48].
O uso desse sistema tem destaque especial na terapia deHIVatravés do bloqueio da proliferação do vírus. Demonstrou-se que perturbação da região LTR (repetições longas terminais) pode ser realizada em vírus HIV-1. O DNA do vírus contém duas regiões LTR e ambas as extremidades podem se integrar ao genoma, o que significa que o sistema CRISPR/Cas9 tem a capacidade de remover a sequência do HIV associado por clivagem em ambas as LTRs, retirando assim a sequência de HIV integrada ao DNA de indivíduos infectados. A técnica ainda se encontra em um estágio inicial, mas se mostra muito promissora na determinação de alvos através de um sistema de entrega segura e eficaz[48][53].
Correções de desordens genéticas
[editar|editar código-fonte]A tecnologia CRISPR-Cas9 também vem sendo amplamente estudada como ferramenta na cura de doenças genéticas. Usando camundongos como modelo, por exemplo, a falha genética causadora da catarata foi corrigida (reparo dofenótipofuncional da doença) pela injeção de CRISPR/Cas9 em zigotos. De acordo com análises desequenciamentode DNA, foram observadas que as modificações necessárias ocorreram somente noalelo mutantedos animais portadores da doença e não afetaram os demais genes, confirmando a especificidade do sgRNA em atingir exclusivamente oalelo mutante[54].
Camundongos já foram usados como modelo na correção do gene mutante dadistrofina,evitando o desenvolvimento dedistrofia musculare também no reparo dolocusdoreceptor transmembranardafibrose císticaporrecombinação homólogadecélulas-troncointestinais cultivadas de pacientes humanos com esta doença, evidenciando a CRISPR como técnica promissora para aterapia genéticaem pacientes humanos[48].Os pesquisadores têm utilizado para tratar uma forma grave de distrofia muscular em camundongos. Eles empregaram CRISPR/Cas para cortar a parte de um gene defeituoso comdistrofia muscular de Duchenne,permitindo que os animais a fazer uma proteína muscular essencial. A abordagem é a primeira vez que CRISPR foi entregue com sucesso por todo o corpo para o tratamento de animais adultos com uma doença genética[55].
Problemas Éticos e Regulatórios e Riscos Biológicos
[editar|editar código-fonte]Como toda aplicação do ramo da Biotecnologia, o uso da nova técnica traz à tona discussões nos campos da ética e da segurança biológica, em grande parte pelo fato de que suas aplicações estão fortemente ligadas a interesses econômicos de diversos grupos e empresas.
Atualmente já se negociam bilhões de dólares e travam-se na justiça disputas acirradas sobre vários aspectos das patentes que podem ser geradas.
Citando o artigo publicado no jornal Zero Hora pela Professora Cristina Bonorino, titular de Imunologia da PUCRS e pesquisadora 1C do CNPq:
"As pesquisadoras que primeiramente desvendaram o mecanismo de funcionamento do sistema CRISPR, duas da Universidade da Califórnia em Berkeley, Jenifer Doudna e Jill Banfield, e a francesa Emmanuelle Charpentier, patentearam o sistema pensando no potencial para testes diagnósticos de vírus. Publicaram seus achados na Science em 2012, e seguiram-se uma enxurrada de premiações, milhões de dólares captados para as empresas de biotecnologia que fundaram e sua inclusão na lista das 100 pessoas mais influentes no mundo pela revista Time. Enquanto isso, a DuPont anuncia que alimentos editados com CRISPR estarão em nossas mesas em menos de cinco anos. Eles também patentearam usos do sistema para modificar sementes e probióticos.
Paralelamente, um pesquisador do Massachussets Institute of Technology (MIT), Feng Zhang, trabalhava em uma versão do CRISPR altamente focada. As pesquisadoras que descobriram o CRISPR descreviam o seu mecanismo de ação. Zhang queria ser o primeiro a usar o sistema para editar genomas humanos. Ele escreveu essa patente, com esse foco, e o MIT depositou-a logo após a de Berkeley. Contudo, o depósito do MIT entrou numa categoria acelerada – para a qual se paga uma taxa a mais no depósito (!) e ele ganhou a prioridade. Isso importa muito no meio da propriedade intelectual, e vale muito, muito dinheiro. Qualquer empresa que quiser trabalhar com algum organismo outro que não bactérias, precisa licenciar a patente de Zhang. Bilhões de dólares estão em jogo, e ambas as instituições entraram com recursos e digladiam-se na justiça pelos direitos. Todos os pesquisadores fundaram startups de biotecnologia que vêm recebendo capital de investidores, como a megafarma Novartis. Mas quem conseguir a patente de editar células humanas vai com certeza ser o centro das atenções. "[56]
Apesar do otimismo despertado pelo desenvolvimento na utilização desta nova ferramenta da biotecnologia, os riscos envolvidos na manipulação genética indiscriminada de organismos não devem ser minimizados em prol de interesses de mercado, sendo essencial a continuidade das pesquisas, desenvolvimento de protocolos adequados de controle e estabelecimento de marcos regulatórios através de discussão dos aspectos técnicos e sócio ambientais, com a consideração dos riscos e ganhos advindos de sua utilização.
Funções
[editar|editar código-fonte]Como verificamos CRISPR apresenta diversos campos de aplicação, assim suas funções podem ser resumidas em:
- Edição- Adição ou supressão de bases do DNA em um ou mais genes;
- Repressão– Controle do gene através do bloqueio datranscrição,sem necessidade de alteração de local especifico.
- Ativação– Pela inserção defatores de transcriçãoe redirecionamento da CRISPR em determinadasregiões promotorasdo gene.
Referências
- ↑abcdefghijklmWiedenheft, Blake; Samuel H. (1 de janeiro de 2012).«RNA-guided genetic silencing systems in bacteria and archaea».Nature.482(7385).doi:10.1038/nature10886
- ↑abcdeSander, Jeffry D; J Keith (1 de janeiro de 2014).«CRISPR-Cas systems for editing, regulating and targeting genomes».Nature Biotechnology.32(4).PMID24584096.doi:10.1038/nbt.2842
- ↑Lead CRISPR Scientist Talks Research Origins, Ethicspor Emma Dyer (2018)
- ↑Gasiunas, Giedrius; Virginijus (11 de janeiro de 2013).«RNA-dependent DNA endonuclease Cas9 of the CRISPR system: Holy Grail of genome editing?».Trends in Microbiology(em English).21(11): 562-567.ISSN0966-842X.PMID24095303.doi:10.1016/j.tim.2013.09.001
- ↑abcdRan, F Ann; Patrick D (1 de janeiro de 2013).«Genome engineering using the CRISPR-Cas9 system».Nature Protocols.8(11).PMID24157548.doi:10.1038/nprot.2013.143
- ↑abcdeBarrangou, Rodolphe; Christophe (23 de março de 2007).«CRISPR Provides Acquired Resistance Against Viruses in Prokaryotes».Science(em inglês).315(5819): 1709-1712.ISSN0036-8075.PMID17379808.doi:10.1126/science.1138140
- ↑MIMIVIRE is a defence system in mimivirus that confers resistance to virophagepor Anthony Levasseur, Meriem Bekliz, Eric Chabrière, Pierre Pontarotti, Bernard La Scola & Didier Raoult, publicado em "Nature" (2016) doi:10.1038/nature17146
- ↑CRISPR-like ‘immune’ system discovered in giant virus - Mimivirus defence system might lead to new genome-editing toolspor Ewen Callaway "Nature" (2016)
- ↑Ishino, Y; H (1 de dezembro de 1987).«Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product.».Journal of Bacteriology.169(12): 5429-5433.ISSN0021-9193.PMID3316184
- ↑Mojica, Francisco J. M.; Cesar (1 de abril de 2000).«Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria».Molecular Microbiology(em inglês).36(1): 244-246.ISSN1365-2958.doi:10.1046/j.1365-2958.2000.01838.x
- ↑Jansen, Ruud.; Jan. D. A. van (1 de março de 2002).«Identification of genes that are associated with DNA repeats in prokaryotes».Molecular Microbiology(em inglês).43(6): 1565-1575.ISSN1365-2958.doi:10.1046/j.1365-2958.2002.02839.x
- ↑«He's a superstar of the science world but no-one knows his name».ABC News(em inglês). 15 de junho de 2018
- ↑abcdeBolotin, A.; Alexander Bolotin|Benoit Quinquis|Alexei Sorokin|S. Dusko (1 de janeiro de 2005).«Clustered regularly interspaced short palindrome repeats (CRISPRs) have spacers of extrachromosomal origin».Microbiology.151(8).doi:10.1099/mic.0.28048-0
- ↑abMojica, Francisco J. M.; Chc)sar (1 de fevereiro de 2005).«Intervening Sequences of Regularly Spaced Prokaryotic Repeats Derive from Foreign Genetic Elements».Journal of Molecular Evolution(em inglês).60(2): 174-182.ISSN0022-2844.doi:10.1007/s00239-004-0046-3
- ↑Pourcel, C.; C. Pourcel|G. Salvignol|G. (1 de janeiro de 2005).«CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA, and provide additional tools for evolutionary studies».Microbiology.151(3).doi:10.1099/mic.0.27437-0
- ↑Makarova, Kira S.; Nick V. (16 de março de 2006).«A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action».Biology Direct(em inglês).1(1). 7 páginas.ISSN1745-6150.PMID16545108.doi:10.1186/1745-6150-1-7
- ↑Barrangou, Rodolphe; Philippe (1 de janeiro de 2012).«CRISPR: New Horizons in Phage Resistance and Strain Identification».Annual Review of Food Science and Technology.3(1): 143-162.PMID22224556.doi:10.1146/annurev-food-022811-101134
- ↑abAndersson, Anders F.; Jillian F. (23 de maio de 2008).«Virus Population Dynamics and Acquired Virus Resistance in Natural Microbial Communities».Science(em inglês).320(5879): 1047-1050.ISSN0036-8075.PMID18497291.doi:10.1126/science.1157358
- ↑Brouns, Stan J. J.; Matthijs M. (15 de agosto de 2008).«Small CRISPR RNAs Guide Antiviral Defense in Prokaryotes».Science(em inglês).321(5891): 960-964.ISSN0036-8075.PMID18703739.doi:10.1126/science.1159689
- ↑Marraffini, Luciano A.; Erik J. (19 de dezembro de 2008).«CRISPR Interference Limits Horizontal Gene Transfer in Staphylococci by Targeting DNA».Science(em inglês).322(5909): 1843-1845.ISSN0036-8075.PMID19095942.doi:10.1126/science.1165771
- ↑abGarneau, Josiane E.; Marie-Ève (1 de janeiro de 2010).«The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA».Nature.468(7320).doi:10.1038/nature09523
- ↑abDeltcheva, Elitza; Krzysztof (1 de janeiro de 2011).«CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III».Nature.471(7340).PMID21455174.doi:10.1038/nature09886
- ↑Sapranauskas, Rimantas; Giedrius (1 de novembro de 2011).«The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli».Nucleic Acids Research(em inglês).39(21): 9275-9282.ISSN0305-1048.PMID21813460.doi:10.1093/nar/gkr606
- ↑Jinek, Martin; Krzysztof (17 de agosto de 2012).«A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity».Science(em inglês).337(6096): 816-821.ISSN0036-8075.PMID22745249.doi:10.1126/science.1225829
- ↑Gasiunas, Giedrius; Rodolphe (25 de setembro de 2012).«Cas9–crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria».Proceedings of the National Academy of Sciences(em inglês).109(39): E2579-E2586.ISSN0027-8424.PMID22949671.doi:10.1073/pnas.1208507109
- ↑Kim, Sojung; Daesik (1 de junho de 2014).«Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins».Genome Research(em inglês).24(6): 1012-1019.ISSN1088-9051.PMID24696461.doi:10.1101/gr.171322.113
- ↑Cong, Le; F. Ann (15 de fevereiro de 2013).«Multiplex Genome Engineering Using CRISPR/Cas Systems».Science(em inglês).339(6121): 819-823.ISSN0036-8075.PMID23287718.doi:10.1126/science.1231143
- ↑abcdefghiMakarova, Kira S.; Daniel H. (1 de janeiro de 2011).«Evolution and classification of the CRISPR–Cas systems».Nature Reviews Microbiology.9(6).PMID21552286.doi:10.1038/nrmicro2577
- ↑Paez-Espino, David; Itai (1 de maio de 2015).«CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus».mBio(em inglês).6(2): e00262-15.ISSN2150-7511.PMID25900652.doi:10.1128/mBio.00262-15
- ↑Scientists Who Said CRISPR Is Dangerous Can't Even Replicate Their Own ResultsWe're not surprisedpor Peter Dockril (2018)
- ↑abCencic, Regina; Hisashi (2 de outubro de 2014).«Protospacer Adjacent Motif (PAM)-Distal Sequences Engage CRISPR Cas9 DNA Target Cleavage».PLoS ONE.9(10): e109213.PMID25275497.doi:10.1371/journal.pone.0109213
- ↑abcdefHsu, Patrick D.; Eric S. (6 de maio de 2014).«Development and Applications of CRISPR-Cas9 for Genome Engineering».Cell(em English).157(6): 1262-1278.ISSN0092-8674.PMID24906146.doi:10.1016/j.cell.2014.05.010
- ↑abcdefghiJore, Matthijs M; Magnus (1 de janeiro de 2011).«Structural basis for CRISPR RNA-guided DNA recognition by Cascade».Nature Structural & Molecular Biology.18(5).doi:10.1038/nsmb.2019
- ↑Wiedenheft, Blake.«Structures of the RNA-guided surveillance complex from a bacterial immune system».NATURE.doi:10.1038/nature10402
- ↑«CRISPR»(em inglês)
- ↑Nishimasu, Hiroshi; F. Ann.«Crystal Structure of Cas9 in Complex with Guide RNA and Target DNA».Cell(em English).156(5): 935-949.ISSN0092-8674.PMID24529477.doi:10.1016/j.cell.2014.02.001
- ↑abHaft, Daniel H; Jeremy (11 de novembro de 2005).«A Guild of 45 CRISPR-Associated (Cas) Protein Families and Multiple CRISPR/Cas Subtypes Exist in Prokaryotic Genomes».PLoS Comput Biol.1(6): e60.PMID16292354.doi:10.1371/journal.pcbi.0010060
- ↑abcHale, Caryn.«Essential Features and Rational Design of CRISPR RNAs that Function with the Cas RAMP Module Complex to Cleave RNAs».Molecular Cell.doi:10.1016/j.molcel.2011.10.023
- ↑Hatoum-Aslan, Asma; Inbal (15 de janeiro de 2014).«Genetic Characterization of Antiplasmid Immunity through a Type III-A CRISPR-Cas System».Journal of Bacteriology(em inglês).196(2): 310-317.ISSN0021-9193.PMID24187086.doi:10.1128/JB.01130-13
- ↑Sánchez-Rivera, Francisco J.; Tyler (1 de janeiro de 2015).«Applications of the CRISPR–Cas9 system in cancer biology».Nature Reviews Cancer.15(7).PMID26040603.doi:10.1038/nrc3950
- ↑«There's CRISPR in Your Yogurt | The Scientist Magazine®».The Scientist.Consultado em 28 de setembro de 2015
- ↑«Gene Editing Will Change Everything—Just Not All at One Time | Insight & Intelligence™ | GEN».GEN.Consultado em 28 de setembro de 2015
- ↑«Powerful Genetic Engineering Technique Could Modify Entire Wild Populations».Consultado em 28 de setembro de 2015
- ↑van Erp, Paul BG; Gary (1 de junho de 2015).«The history and market impact of CRISPR RNA-guided nucleases».Current Opinion in Virology.12:85-90.PMID25914022.doi:10.1016/j.coviro.2015.03.011
- ↑abRiordan, Sean M.; Daniel P. (21 de junho de 2015).«Application of CRISPR/Cas9 for biomedical discoveries».Cell & Bioscience(em inglês).5(1). 33 páginas.ISSN2045-3701.PMID26137216.doi:10.1186/s13578-015-0027-9
- ↑Marraffini, Luciano A.; Erik J. (1 de janeiro de 2010).«CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea».Nature Reviews Genetics.11(3).PMID20125085.doi:10.1038/nrg2749
- ↑Horii, Takuro; Yuji (1 de janeiro de 2014).«Validation of microinjection methods for generating knockout mice by CRISPR/Cas-mediated genome engineering».Scientific Reports.4.doi:10.1038/srep04513
- ↑abcdefYang, Xiao (9 de maio de 2015).«Applications of CRISPR-Cas9 mediated genome engineering».Military Medical Research(em inglês).2(1). 11 páginas.ISSN2054-9369.PMID25984354.doi:10.1186/s40779-015-0038-1
- ↑abYen, Shuo-Ting; Min (1 de setembro de 2014).«Somatic mosaicism and allele complexity induced by CRISPR/Cas9 RNA injections in mouse zygotes».Developmental Biology.393(1): 3-9.PMID24984260.doi:10.1016/j.ydbio.2014.06.017
- ↑Larson, Matthew H; Luke A (1 de janeiro de 2013).«CRISPR interference (CRISPRi) for sequence-specific control of gene expression».Nature Protocols.8(11).PMID24136345.doi:10.1038/nprot.2013.132
- ↑Konermann, Silvana; Mark D. (1 de janeiro de 2014).«Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex».Nature.517(7536).PMID25494202.doi:10.1038/nature14136
- ↑Perez-Pinera, Pablo; D Dewran (1 de janeiro de 2013).«RNA-guided gene activation by CRISPR-Cas9–based transcription factors».Nature Methods.10(10).PMID23892895.doi:10.1038/nmeth.2600
- ↑Ebina, Hirotaka; Naoko (1 de janeiro de 2013).«Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus».Scientific Reports.3.PMID23974631.doi:10.1038/srep02510
- ↑Wu, Yuxuan; Dan (12 de maio de 2013).«Correction of a Genetic Disease in Mouse via Use of CRISPR-Cas9».Cell Stem Cell(em English).13(6): 659-662.ISSN1934-5909.PMID24315440.doi:10.1016/j.stem.2013.10.016
- ↑CRISPR helps heal mice with muscular dystrophypor Jocelyn Kaiser (2015)
- ↑BONORINO, C.«Hacker Biológico: Sistema permite sondar e manipular o DNA de forma rápida e fácil.».Zero Hora.Consultado em 18 de outubro de 2015
