Optogenética
O termooptogenéticarefere-se a técnicas que combinamluz(ótica),genéticaebioengenhariae permitem o estudo decircuitos neuronaisecomportamentosatuando emcélulasespecíficas. O termo “optogenética” (do inglês “optogenetics” ) deve-se, etimologicamente, à combinação de “opto- “, que refere o uso de feixes de luz oulasers,com “genética”, que se deve ao uso degenesdeopsinase de genes que restringem o processo a células específicas. Este termo foi usado pela primeira vez por um grupo de investigação daUniversidade de Stanfordliderado porKarl Deisseroth,em 2005, para designar esta técnica que possibilita o controlo de neurónios geneticamente modificados através de métodos óticos.[1]
Através da expressão génica decanaisativados por luz acomprimentos de ondaespecíficos é possível controlar, com uma precisão demilissegundos,a ativação de células específicas.[2][3]A optogenética permite, assim, analisar em animais vivosneuróniosmarcados seguindo e controlando os seus eventoselétricosebioquímicos,modulando comportamentos.[1][3]
Tal como se tem verificado nos últimos anos, a possibilidade de ativar e/ou silenciar neurónios específicos poderá contribuir muito significativamente para entender como estão definidos os circuitos neuronais em condições normais e patológicas.[4]Além de neurónios, é também possível estudar, através desta técnica,células da glia,musculares,cardíacas ecélulas estaminaisembrionárias, o que potencia o futuro uso desta técnica em diversas terapias como doença deParkinson,depressãooucegueira.[3]
História e evolução
[editar|editar código-fonte]As primeiras técnicas de optogenética eram bastante diferentes daquelas conhecidas por este termo nos dias de hoje, tendo surgido, inicialmente, como simples processos defluorescência.Apenas muito recentemente se deu início ao uso derodopsinaspara controlar atividade celular por meio deluze com comprimentos de onda específicos. Sendo que nos últimos anos a optogenética sofreu melhorias significativas, ganhando uma resolução espaciotemporal elevadíssima e permitindo o controlo remoto decomportamentos.Uma cronologia dos acontecimentos mais importantes que contribuíram para o surgimento da optogenética como a conhecemos hoje é apresentada abaixo.
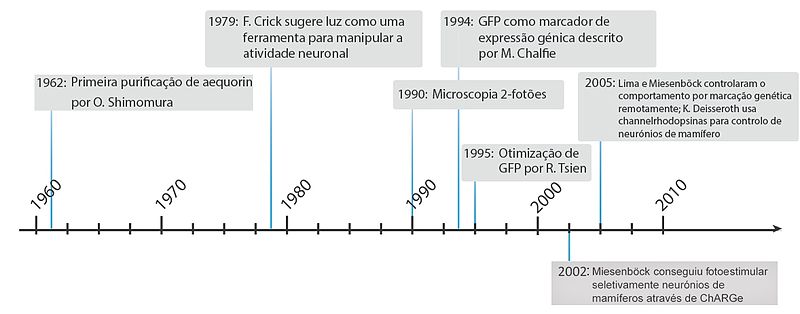
As primeiras técnicas
[editar|editar código-fonte]
O fenómeno dafluorescênciafoi descrito pela primeira vez na segunda metade do século XVI, aquando da mistura de 3 tipos diferentes de madeira numasolução aquosaque levaria a uma reação de produção de um composto fluorescente denominado “matlaline”.Desde essa altura, a fluorescência começou a ser manipulada por cientistas, mas apenas em meados dos anos 90 este fenómeno natural começou a ser combinado com aengenharia genética.Conjugando microscopia ótica com moléculas marcadas por moléculas que emitem luz, foi possível estudar onde determinada molécula era sintetizada na célula e/ou segui-la até aos seus alvos. Esta técnica permite medir as concentrações de cálcio intracelulares como sensores de variações intracelulares.
Aequorina
[editar|editar código-fonte]Aequorinafoi a primeira proteína fluorescente a ser purificada, em 1962 por Osamu Shimomura damedusaAequorea.[5]Estamoléculatem a capacidade de emitir luzazul(469 nm) quando ocálciose liga a determinados locais de ligação. Tornou-se uma ferramenta generalizada de deteção de cálcio intracelular de forma rápida, mas inicialmente tinha que ser injetada.[6]Em 1985, a aequorina foi clonada pela primeira vez e asequência de ADNdo seu gene sequenciada: a partir desse momento, a aequorina pôde ser utilizada como uma ferramenta optogenética, através da inserção do seu gene nogenomade ummodelo animalou celular, passando as células a produzir a seu própria aequorina.[7]
Seja microinjectada ou clonada, a aequorina precisa de umaenzimadesignada coelenterazina que é consumido durante o processo de fluorescência e, por conseguinte, tem de ser continuamente adicionada aomeio de cultura.Esta exigência torna-a inadequada para uso direto em modelos animais complexos.[7]
Proteína Verde Fluorescente
[editar|editar código-fonte]Em 1962, Osamu Shimomura purificou uma outra proteína que também existia naturalmente emAequoreae que absorve a luz azul da aequorina para emitir luzverde,surgindo assim aproteína verde fluorescente(PVF ou GFP do inglês "Green Fluroscent Protein" ). Esta proteína verde fluorescente tornou-se uma potencial ferramenta de investigação após a sua clonagem e sequenciamento em 1992 por Douglas Prasher. Dois anos mais tarde, o laboratório de Martin Chalfie conseguiu expressar uma versão ligeiramente modificada do gene emE. colieC. elegans[8]e, imediatamente, definiu esta molécula como uma ferramentain vivopara monitorizar a expressão genética e localização deproteínas.A GFP tinha as vantagens de trabalhar de forma independente decofatoresousubstratosalém de ser totalmente funcional atemperatura ambiente.
No entanto, a proteína verde fluorescente tinha algumas desvantagens, como o facto de ter um espetro de emissão com dois picos e uma baixa luminosidade geral. Assim, ao longo dos anos, os investigadores desenvolveram uma série de derivados de GFP, o primeiro dos quais foi obtido, em 1995 por Roger Tsien, por um único ponto demutação.[9]Com o objetivo de utilizar várias proteínas fluorescentes ao mesmo tempo, foram necessárias mutações de cor, e assim, os investigadores criaram proteínas fluorescentes azuis,cianoeamarelo.Em 1999, Mikhail Matz criou a primeira proteína fluorescente vermelha a que chamou DsRed.[10]O seu uso foi limitado porque era um tetrâmero obrigatório; mas esta restrição foi quebrada em 2002 por Roger Tsien, que usou com sucesso uma DsRed monomérica.[11]

A fim de superar as limitações da Aequorina em imagiologia por cálcio, Roger Tsien projetou também Cameleonem 1999.[12]Esta construção combina uma proteína fluorescente azul e uma proteína fluorescente verde separadas por um elemento decalmodulina.Na presença de cálcio, a proteína calmodulina sofre uma alteração conformacional, juntando as duas proteínas e permitindo que ressoem (técnica detransferência ressonante de energia por fluorescência- FRET) do menor para o maior comprimento de onda da GFP mutante. Por conseguinte, é possível a utilização de diferentes combinações de mutantes de GFP, contanto que elas possam entrar em ressonância. 2002 foi também o ano da criação de outro derivado de GFP que precisava de fotoativação antes de florescer.[13]Isto tornou possível ativar seletivamente moléculas de GFP dentro de uma célula, permitindo um maior nível de precisão no rastreamento de proteínas e novos usos inovadores de GFP.
GFP tem sido o método preferido no monitoramento daexpressão génicae no rastreamento deproteínasdesde 1994 pela sua facilidade de uso e sua grande flexibilidade, podendo também ser combinado com FRET.[13]
Sensores optogenéticos
[editar|editar código-fonte]Os sensores optogenéticos, como o Cameleon, são moléculas cujas propriedades se alteram em resposta a atividade neuronal quando há alterações no potencial de membrana nos neurónios pós-sinápticos. Os sensores tradicionais ser indicadores iónicos sensíveis a concentrações intracelulares de cálcio ou cloro, pois os potenciais de ação estão, geralmente, associados a abertura de canais de cálcio e aumento da sua concentração intracelular ou a uma diminuição da concentração de cloro. Atualmente existem sensores optogenéticos que permitem a análise da atividade neuronal através de sondas florescentes que detetam alterações temporárias no potencial de membrana quando ocorrem sinapses.[14]
Controlo de potenciais de ação com luz
[editar|editar código-fonte]Os primeiros anos da optogenética focaram-se em monitorizar e observar, mas já em 1979Francis Cricksugeriu que que aluzdeveria ser usada não só para observar mas também para controlar e manipular a atividade celular, e que deveria ser desenvolvida “um método pelo qual todos osneuróniosde um único tipo poderiam ser inativados, deixando os outros inalterados”. Anos mais tarde, afirmou mesmo que deveria ser criada uma técnica que usasse luz e atuasse em neurónios geneticamente alterados para responder acomprimentos de ondaespecíficos.[15]Através do estudo de fenómenos de dispersão de luz efluorescênciaassociada apotenciais de ação,surgiram as primeiras ideias de usar métodos óticos para controlar atividade neuronal. Sendo que por volta de 1970 se introduziu pela primeira vez moléculas sensíveis a voltagem em membranas de neurónios.[16]
Avanços recentes
[editar|editar código-fonte]Na última década, tem havido avanços significativos no desenvolvimento das técnicas de optogenética que fazem uso de ferramentas moleculares e de atuadores sensíveis a luz e restringidos a neurónios geneticamente alterados. A evolução dessas metodologias ocorreu, essencialmente, a partir de ligandos fotoconversíveis que podem ser usados para modular oticamente a atividade neuronal através da ativação de proteínas derecetoresespecíficos.[16]O desenvolvimento das técnicas de optogenética que fazem uso desta abordagem é descrito a seguir.
Primeiras abordagens: fotoestimulação seletiva de neurónios através de chARGe
[editar|editar código-fonte]Em 2002, um grupo de investigação liderado porGero Miesenböckconseguiu fotoestimular neurónios demamíferosde forma seletiva através de uma técnica que designou como “chARGe”. O nome da técnica tem em conta a coexpressão seletiva de genes que codificam para um canal fotoestimulável ( “ch- “do inglês “channel” ) formado com 3 proteínas:Arrestina-2, importante para a desativação darodopsina;Rodopsina presente em moscas da fruta (Drosophila Melanogaster)sensível a luz azul e a subunidade α de um heterodímero deproteínaG.[16][17]Através da expressão destes componentes, foi possível reconstituir uma cascata de fototransdução em que, após excitada e através de proteínas G, a rodopsina sinaliza uma proteína atuadora endógena (fosfolipase C) que, por sua vez, ativa canaiscatiónicosde forma não específica levando adespolarização.[16]
A especificidade da técnica deve-se ao facto de a expressão dos canais chARGe estar restringida a determinados tipos celulares, através dos seuspromotoresgenéticos específicos, ou a certos circuitos neuronais usandovetoresviraisque se propagam através dos contactossinápticos.Com este método tornou-se, assim, possível estimular neurónios específicos mesmo em tecidos intactos ao transformar sinais óticos em atividade elétrica.[17]
Apesar da sua elevada especificidade, o sistema chARGe é complicado de implementar devido aos seus vários componentes e apresenta umacinéticade ativação e desativação lenta, na ordem dos segundos, devido à sua natureza metabotrópica.[16]
Controlo remoto de comportamento através de marcação genética
[editar|editar código-fonte]Em 2005, Lima e Miesenböck conseguiram controlar, remotamente e de forma não invasiva, o comportamento deDrosophilaao fotoestimular neurónios dopaminérgicos específicos moduladores de atividade locomotora.[18]Para isso, expressaram em neurónios dedopamina,sob o controlo do promotor do gene de tirosina hidroxilase (enzima envolvida na via de produção de dopamina), um canal catiónico não presente emDrosophila(purinoreceptorionotrópico P2X2). Ao iluminar asDrosophilas,previamente injetadas com um ligando inerte sequestrado numa vesícula fotolábil, ocorreria então uma ativação dos neurónios geneticamente programados para expressar o recetor. Como resultado desta ativação específica, observaram-se alterações comportamentais nos padrões de atividade locomotora das moscas da fruta, tal como tentativa de voo ou fuga, bater de asas e saltos.[1][18]
De uma forma mais simplificada, usaram desencadeadores depotenciais de açãogeneticamente codificados que funcionam de acordo com um mecanismofotoquímicode chave e fechadura. Neste sistema, um potencial de ação é iniciado na presença de umflashde luz que vai estimular um agonista (chave) de recetores que vai levar à abertura dos respetivos canais num neurónio geneticamente modificado para expressar esses canais (fechadura).[18]Este método revelou-se mais fácil de implementar e com uma maior resolução temporal devido à sua natureza ionotrópica e uso de apenas 2 componentes: o purinoreceptor ionotrópico e o seuagonista.[16]
No entanto, as estratégias de optogenética fotoquímicas como a aqui descrita têm como grande desvantagem a necessidade de fornecer sempre o ligando agonista às células alvo, o que limita o seu uso apenas a preparações com uma fácil difusão de compostos como pequenos organismos como as moscas da fruta, fatias cerebrais ou neurónios em cultura.[16]
Controlo ótico de atividade neuronal com elevada resolução espaciotemporal
[editar|editar código-fonte]Uma técnica ideal de optogenética com atuadores ativados por luz deveria usar um sistema de uma única proteína para que o processo se torna-se mais eficiente e preciso. Esta questão foi resolvida pela introdução de rodopsinas. Algunsmicrorganismos,estando desprovidos de estruturas oculares complexas, possuem proteínas com localização transmembranar ativadas por luz que servem os mesmos propósitos. As rodopsinas, codificadas por genes deopsinas,são uma família dessas proteínas e permitem ativar ou inibir potenciais de ação, ativados por diferentes comprimentos de onda luminosos e com várias propriedades na regulação da condutância aiões.Estas proteínas usamretinaldeído(umcromóforo) para absorverfotões,levando a uma alteração conformacional e funcional que, por sua vez, levará à ativação de determinadas vias de sinalização ou abertura do canal iónico.[16][18]
O uso de rodopsinas foi um fator crucial no desenvolvimento das atuais técnicas de optogenética, permitindo ativar e excitar neurónios de forma seletiva e com elevada resolução espácio-temporal.[16][18]Destaca-se assim a importância dos trabalhos de investigação levados a cabo por Peter Hegemann que verificou que ao expressar channelrhodopsin-1 (ChR1) em oócitos deXenopus laevise na presença de retinaldeído era produzida uma certa condutância semelhante à observada em canais compermeabilidadeseletiva aiões.[19]
Em 2005, surgiu então uma técnica de optogenética, desenvolvida no laboratório liderado por Karl Deisseroth que permitiria analisar neurónios de mamíferos com uma resolução temporal de milissegundos e de forma reprodutível fazendo uso de rodopsinas. Nesta técnica foi introduzido, em neurónios dohipocampoe através de infeção comlentivirus,um gene codificante de um canal catiónico ativado por luz azul, neste caso a channelrodopsina-2 (ChR2), em fusão com uma proteína fluorescente. Existe retinaldeído suficiente nocérebrodevertebradospara permitir a utilização destas técnicas de optogenética não sendo, portanto, necessário introduzir qualquer gene oucomposto químicoadicional.[2]Com esta técnica tornou-se possível controlar a atividade sináptica com elevada precisão tendo grande utilidade em entender a importância da atividade de determinados neurónios (geneticamente definidos) num dado circuito ou comportamento.[1][14][20]
Ainda no final de 2005, o grupo de Georg Nagel conseguiu controlar a atividade de neurónios específicos recorrendo ao uso de ChR2 despoletando determinados comportamentosin vivononematodeC. elegans.[21]
A fotoestimulação localizada de ChR2 permite fazer o mapeamento dos circuitos neuronais quer em fatias cerebrais querinvivo.E,não sendo invasiva, esta técnica pode ser repetida durante várias semanas causando alterações ao nível daplasticidadedo circuito (mudança nas conexões existentes entre neurónios).[1][14][19] As novas técnicas optogenéticas passaram, assim, a usar rodopsinas como atuadores seletivamente permeaveis a iões ou protões e que, quando ativos por fotoestimulação, têm a capacidade de ativar ou inibir um potencial de ação. Este processo está representado na figura abaixo, de forma generalizada.

Hardware para aplicações leves
[editar|editar código-fonte]Outro fator necessário é o hardware (por exemplo, fontes de luz de fibra óptica e de estado sólido integradas) para permitir que tipos de células específicos, mesmo no interior do cérebro, sejam controlados em animais que se comportam livremente. Mais comumente, o último é agora alcançado usando a tecnologia de diodo acoplado a fibra óptica introduzida em 2007, embora para evitar o uso de eletrodos implantados, os pesquisadores desenvolveram maneiras de inscrever uma "janela" feita de zircônia que foi modificado para ser transparente e implantado em crânios de camundongos, para permitir que as ondas ópticas penetrem mais profundamente para estimular ou inibir neurônios individuais. Para estimular áreas cerebrais superficiais, como o córtex cerebral, fibras ópticas ou LEDs podem ser montados diretamente no crânio do animal. Fibras ópticas implantadas mais profundamente têm sido usadas para fornecer luz às áreas cerebrais mais profundas. Complementares às abordagens tethered de fibra, técnicas completamente sem fio foram desenvolvidas utilizando energia fornecida sem fio para LEDs transmitidos pela cabeça para o estudo desimpedido de comportamentos complexos em organismos que se comportam livremente. Progressos recentes investigam o uso de LEDs orgânicos (OLEDs) como estímulos para optogenética.[22]A estimulação precisa e controlada de neurônios que expressam opsina microbiana foi demonstrada in vitro em uma escala de tempo da ordem de um milissegundo. A operação em modo pulsado permite a estimulação neural em baixa temperatura compatível. Além disso, diodos emissores de luz orgânicos (OLED) são adequados para implantação no cérebro por sua espessura muito fina, que pode ser inferior a 1 μm.[22]
Atuadores optogenéticos
[editar|editar código-fonte]Um grande número das atuais abordagens optogenéticas fazem uso de opsinas como atuadores. Existe neste momento uma grande variabilidade de opsinas atualmente conhecidas e artificialmente desenvolvidas ou alteradas. Houve, por exemplo, a necessidade de encontrar estratégias que permitissem o uso das rodopsinas microbianas em neurónios de mamíferos, pois, muitas vezes, as ferramentas microbianas não se expressam adequadamente em células de mamíferos.[2][21]Estas alterações são feitas com recurso a engenharia genética emutagénese dirigida,entre outras técnicas, e permitem inúmeras configurações experimentais. Sendo que os atuadores genéticos são expressos nos neurónios alvo de forma específica através de vírus, como adenovírus ou lentivírus; animais transgénicos; ou linhas celulares geneticamente alteradas com promotores específicos.[2][14]
Alguns tipos de opsinas levam à ativação de potenciais de ação enquanto outros os silenciam. Se, por exemplo, se coexpressarem estes dois tipos de opsinas, cada uma respondendo a uma diferente cor ou comprimento de onda específico, é possível obter um enorme controlo da atividade neuronal.[2][14]
Assim, na escolha de um atuador optogenético para derminado método de fotoestimulação é importante ter em conta a natureza da questão científica.[23]De seguida é apresentada uma breve descrição dos principais atuadores optogenéticos atualmente existentes, assim com um representativo esquema resumo.
- Channelrhodopsin 2 (ChR2):rodopsina com origem na algaChlamydomonas reinhardtii.Possui um canal catiónico composto por 7 subunidadestransmembranaresque abre quando ativado por luz azul-esverdeada (~400-510 nm), permitindo a entrada de iões desódio(Na+) e gerando, assim, correntes que conseguem levar à ativação de um potencial de ação com elevada precisão temporal. A ChR2 pode ser introduzida no cérebro de mamíferos através deinfeçãoviral.[14][20]
- Channelrhodopsin 1 (ChR1 ou VChR1):rodopsina originária da algaVolvox cartericom mecanismo similar à ChR2 e que também pode fotoestimular neurónios de forma rápida e precisa. O facto de ser ativada por luz amarela (~590 nm) ou verde (~535 nm) permite o seu uso em áreas cerebrais mais profundas e pode ser usada de forma combinada com outras rodopsinas, como a ChR2, já que ambas respondem a diferentes comprimentos de onda luminosos. No entanto, as propriedades cinéticas da VChR1 não lhe permitem ser temporalmente tão precisa.[14]
- Bacteriorrodopsin (BR):primeira rodopsina microbiana identificada e originalmente encontrada emhaloarcheaonde liberta protões do citoplasma para o meio extracelular aquando da absorção de luz verde. Desta forma a BR permite um aumento nahiperpolarizaçãolevando a uma inibição dos potenciais de ação.[24]
- Bomba de protões Mac:é uma bomba de protões encontrada no fungoLeptosphaeria maculans(Mac)e,dado que o seu mecanismo é semelhante à BR, pode ser utilizada para inibir neurónios de forma eficaz na presença de luz azul-esverdeada.[25]
- Halorrodopsin (HR ou NpHR):rodopsina encontrada no microrganismoNatronomonaspharaonisque, quando ativa, inibe a atividade neuronal de forma prolongada ao permitir a entrada de iõescloretopara o citoplasma, levando assim a uma hiperpolarização da célula neuronal. Sendo a halorrodopsina ativada por luz amarela (~580 nm) é possível modular de forma bidirecional o potencial de membrana de um neurónio ao coexpressar ChR2 e NpHR.[2][14]Recentemente, foram artificialmente desenvolvidas algumas variantes desta rodopsina a fim de melhorar a sua especificidade, segurança e expressão em células de mamíferosin vivoouin vitrosem, no entanto, causartoxicidade.[26][27]
- Archaerrodopsin (Arch):rodopsina originária deHalorubrum sodomensee quepossibilita o silenciamento de neurónios, quando iluminados por luz amarela-esverdeada, ao permitir a entrada de iões cloreto para ocitoplasmae levando assim a um aumento da hiperpolarização da célula.[28]
- optoXRs:recetores quiméricos derivados de rodopsinas de vertebrados alteradas para incluir subunidades de proteínas G. Respondem a luz verde e podem levar à ativação ou silenciamento de neurónios, consoante a natureza do domínio do recetor acoplado à proteína G, uma vez que existem proteínas G inibitórias e excitatórias.[2]
Vantagens
[editar|editar código-fonte]A optogenética representa a resposta para as dificuldades experimentais em colmatar a complexidade e diversidade daneurofisiologiamolecular e celular com funções sistémicas. Embora seja uma técnica relativamente recente, apresenta várias aplicações e vantagens específicas[2][16]:
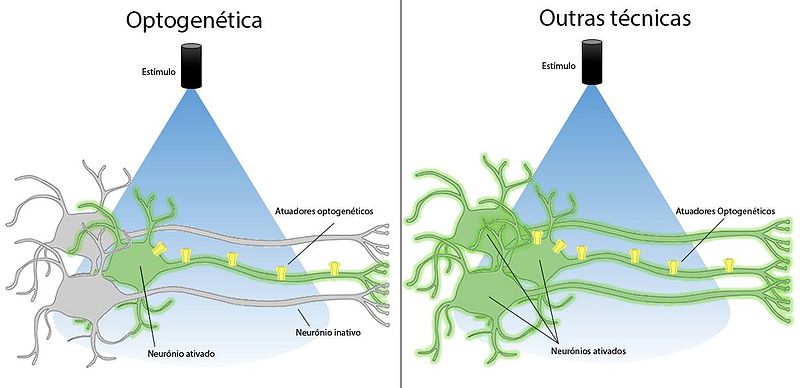
- Possibilidade de controlar remotamente comportamentos específicos e analisar redes neurais através da estimulação ou silenciamento de células nervosas geneticamente marcadas e sem ser necessário saber a sua localização anatómica, com a utilização de um simples feixe de luz e com elevada precisão espaciotemporal. Podem, assim, estimular-se neurónios em regiões inacessíveis por outras abordagens convencionais como osmicroeléctrodosoueletrofisiologia.[1][2][16]Pelo contrário, como esquematizado na figura abaixo, as técnicas de estimulação elétrica interferem com todas as células de forma não específica e, por isso, dificultam a análise da contribuição de dado(s) neurónio(s) para a função do circuito.[29]
- A sua combinação com outras técnicas moleculares possibilita a sua adaptação em diferentes organismos modelo, permitindo abordar um grande leque de questões dentro da área dasneurociências.
- A possibilidade de utilizar proteínas com diferentes características como seletividade iónica, sensibilidade espectral e resolução temporal tem permitido que a técnica seja adaptada a diferentes condições experimentais de acordo com a questão problema colocada. E a sua otimização tem procurado permitir uma expressão mais forte, correntes mais elevadas e mudanças de espetro para que seja possível um controlo combinatório e bidirecional.[30]
- Dado que todos os elementos necessários para uma abordagem optogenética podem ser combinados num único componente, esta técnica torna-se mais adequada para aplicações que outros sistemas mais complexos.[30]
- Otempo de latênciade uma opsina após estimulação com luz é muito curto, o que, associado ao facto de a intensidade de luz requerida não interferir com as funções neuronais, faz da optogenética uma técnica reversível e com uma resolução temporal na ordem dos milissegundos.[30]Esta característica permite uma precisão sem precedentes no controlo de neurónios específicos e comportamentos.[31]
Apesar de todas as vantagens aqui referidas, segundo alguns investigadores, as técnicas de optogenética deverão ainda ser melhoradas e refinadas. Pois ainda não é possível, com as técnicas atuais, um total controlo no número e na localização espacial das células manipuladas; existe uma certa variabilidade no nível de modulação numa mesma população neuronal; é necessária uma maior sincronização das células que expressam os atuadores optogenéticos; existe alguma falta de especificidade nas células marcadas.[31]
Aplicações
[editar|editar código-fonte]Tendo a possibilidade de atuar em neurónios específicos e com elevada resolução espaciotemporal e, desta forma, controlar comportamentos observáveis, as técnicas de optogenética têm tido um grande impacto na área das neurociências ao permitir modular células específicas, mesmo estas fazendo parte detecidosde enorme complexidade.[2]Há, assim, um grande interesse em usar as técnicas de optogenética em váriosanimais modeloa fim de melhor entender determinados circuitos neuronais e os fenómenos celulares subjacentes. Os atuadores optogenéticos devem ser expressos nas células de uma forma muito específica e controlada geneticamente, o que tem proporcionado a criação de linhas celulares geneticamente modificadas ou animaistransgénicos.[32]Será, assim, possível usar o controlo ótico de neurónios específicos para melhor entender como océrebro humanofunciona. Com um crescente conhecimento acerca dos circuitos neuronais, os investigadores estarão melhor preparados para desenvolver terapias eficazes no combate adoenças neurológicasou psiquiátricas.[2]
Modelos animais
[editar|editar código-fonte]
Nemátode (Caenorhabditis Elegans):Considerado como um poderoso modelo de estudos de optogenética, estenematodeé normalmente utilizado em investigação fundamental devido à sua transparência e ao seusistema nervosobem caracterizado. Constituído de apenas 302neuróniose com um mapa de circuitos neuronais bem delineado,C. eleganstem sido alvo de vários estudos decomportamento,funçãosinápticae também de dinâmica de circuitos.[33]Através de ferramentas optogenéticas em células alvo marcadas com ChR2 ou NpHR é possível observar o circuitomotor,o circuito de deposição de ovos e o circuito mecanossensorial deste organismo.[34]

Mosca da fruta (Drosophila melanogaster):Este animal é considerado um bom modelo para o estudo defármacosou mecanismos envolvidos em doenças neurológicas. Além de o seugenomaser relativamente pequeno, simples e estar atualmente muito bem caracterizado, contém uma grande percentagem dosgenesque se sabem estarem envolvidos em doenças humanas. É possível gerar variantes genéticas com relativa facilidade e rapidez, mimetizando padrões de expressão de doenças neurológicas, e asmutaçõesresultam geralmente emfenótiposfacilmente quantificáveis. O sistema nervoso daDrosophilae mecanismos neurológicos, como a sinalização neuronal e excitabilidade membranar, assim, com os processos biológicos em geral são também parecidos aos do Homem.[35]Um dos métodos vulgarmente utilizados nestes animais modelo, em abordagens optogenéticas, é a expressão decanais iónicosfotoestimuláveis em neurónios alvo do sistema nervoso central (SNC) geneticamente modificados. Com iluminação nocomprimento de ondarequerido para ativar os canais, as moscas exibem comportamentos específicos correspondentes à ativação dos neurónios alvo. Alguns exemplos de comportamentos já analisados através de uso de optogenética em neuróniosdopaminérgicos(envolvidos na atividadelocomotora) são a tentativa defuga,batimento deasas,evoo.[18]Estes animais modelo também têm sido alvo de estudos ao nível da respostanociceptivaeaprendizagemde odores apetecíveis/aversivos ao nível derecetoresouneurotransmissores.[2]Apesar da desvantagem de as moscas da fruta apresentarem uma resposta comportamental inata à luz azul, dificultando os estudos comportamentais aquando do uso deopsinaspor ela ativadas, este problema foi contornado através do desenvolvimento de ferramentas optogenéticas ativadas por luzvermelha.[2]

Ratinho/murganho (Mus musculus):Este é um bom modelo animal para estudos optogenéticos pela facilidade em fazermanipulação genética,devido ao facto de o seu genoma estar atualmente bem caracterizado. Além disso, possui genes, mecanismos bioquímicos e doenças em comum com os humanos. Oratinhoé muitas vezes usado para expressar aenzimaCre recombinaseem subpopulações específicas de neurónios.[2][36]
Em 2007, ratinhos foram pela primeira vez usados em técnicas de optogenética, recorrendo à expressão de ChR2, num estudo de neurónioshipotalâmicoshipocretinosenvolvidos na capacidade de adormecer e despertar.[2][37]Através de optogenética foi possível controlar os sistemasmonoaminérgicosmodulando bidireccionalmente os neurónios dolocus coeruleusresponsáveis por essas capacidades.[2]Num outro estudo foi possível observar uma relação entre a atividade de neuróniosdopaminérgicosdaárea tegmental ventral (VTA)e o comportamento de recompensa dos ratinhos, concluindo que uma libertação fásica de dopamina é mais eficaz que uma tónica.[38]São exemplos de outros estudos optogenéticos que envolveram o uso deste modelo animal: determinação dos mecanismos responsáveis pela modulação dedopaminana viciação; mapeamento funcional docórtexmotor; estudo do envolvimento dos circuitos daamígdalaem comportamentos deansiedadeemedo condicionado.[2]

Rato(Ratus norvegicus):Tendo um cérebro relativamente simples, em comparação com o humano, e por ter a capacidade de desempenhar tarefas comportamentais e obter gravações de sinaiseletrofisiológicosde populações neuronais densas, oratoé bastante usado na investigação em doenças neurológicas. Este animal modelo tem sido usado em vários estudos optogenéticos como: avaliação de respostas dependentes do nível de oxigénio no sangue através defMRI;modulação deritmos cardíacosatravés decardiomiócitos,assim como outras modulações a nível da função cardiovascular,respiraçãoepressão sanguínea.[2]
Primatas:A fotoestimulação de neurónios no cérebro deRhesusmacaquepoderá abrir portas para o uso da optogenética na dissecação de circuitos neuronais subjacentes às funçõescognitivashumanas. Océrebrodemacacoconsiderado como um dos melhores sistemas de modelo de estudo emneurobiologiadado ao seu paralelismo com océrebro humano,tem sido largamente utilizado para estudos de identificação de áreas cerebrais e estabelecimento de conectividadesanatómicase funcionais. Sendo possível treinarRhesus macaquea realizar tarefas similares aos testes de habilidades cognitivas humanas, têm sido utilizadas técnicas deeletrofisiologiae neuroimagiologia para identificar circuitos neuronais inerentes a processos como aatenção,tomada de decisãoememória.Contudo, estas técnicas convencionais perturbam os circuitos neuronais analisados e ativam outras regiões externas à área de interesse. Devido à sua elevada especificidade, técnicas de optogenética têm, assim, sido também utilizadas emprimatas.Neste animal modelo são expressos canais iónicos ChR2 com recurso avetoresvirais.[39]

Peixe-zebra (Danio rerio):Opeixe-zebraé um bom animal modelo por apresentar comportamentos facilmente quantificáveis como aprendizagem, sono, vício, entre outros. Além disso, o genoma e os mecanismos genéticos envolvidos na regulação dodesenvolvimentoestão muito conservados em relação ao humano, e existem outras vantagens relacionadas com a facilidade de manipulação e manutenção delarvasde peixe-zebra em laboratório.[40]Este animal modelo tem sido alvo de estudos na área dodesenvolvimento neuronalde neuróniossomatossensoriais.Sendo estes classificados como sensíveis a estímulos termais, mecânicos enociceptivos,pouco se sabe como é codificado um estímulotátil.Para resolver esta questão,manipularam a atividade dos neurónios de peixe-zebra através de fotoestimulação de ChR2 presentes em populações de neurónios somatossensoriais geneticamente modificados. Através de técnicas de optogenética foi possível observar um comportamento defugaatravés da estimulação de um único neuróniosensorial.[40][41]
Estudo de doenças e desenvolvimento de terapias
[editar|editar código-fonte]As técnicas de optogenética permitem aos investigadores atuar em circuitos neuronais intactos ein vivo,interferindo em sintomas de doenças com uma elevadíssima resolução espaciotemporal. As manipulações optogenéticas têm a vantagem de ser imediatamente reversíveis, bastando iniciar ou parar a incidência deluzem determinadoscomprimentos de ondapara provocar e cessar umcomportamento.Este tipo de estudos eram muito complicados com os métodos de investigação tradicionais como é o caso das técnicasfarmacológicas.Desta forma, a optogenética poderá levar a avanços significativos no entendimento dos mecanismos envolvidos em doenças do foro do sistema nervoso e, consequentemente, acelerar o desenvolvimento de terapias ao estabelecer relações causais entre atividade cerebral e comportamento emmodelos animaissaudáveis ou doentes.[42][43]A optogenética poderá ser útil também em outras áreas que não as daneurobiologia,como é exemplo acardiologia.[44]
Desordens de ansiedade (stress pós-traumático, fobias, pânico):através de técnicas de optogenética, foi possível identificar uma população desinapsesnaamígdalacom capacidade para modular os níveis basais deansiedadede forma rápida e reversível em modelos animais. Percebeu-se que ao atuar sobre os circuitos neuronais da amígdala identificados nesse estudo era possível obter um efeito ansiolítico.[43][45]Em estudos semelhantes foram estabelecidas correlações entre: a região central da amígdala emedo condicionado;algumas projeções doTronco Cerebrale estados de ansiedade em modelos animais.[46][47]
Transtorno obessivo-compulsivo:este transtorno neurológico, que também se inclui no espetro das desordens deansiedade,é caracterizado por um elevado número de pensamentos obsessivos e ações comportamentais ou mentais compulsivamente repetidas. Os mecanismos biológicos envolvidos na causa desta doença são ainda desconhecidos, apesar de se terem já formulado algumas hipóteses. Estas têm sido testadas através da estimulação de circuitos específicos com ferramentas optogenéticas, tendo sido possível correlacionar a atividade de certos circuitos com o despoletar dos comportamentos característicos desta doença.[48]Através de abordagens optogenéticas foi também possível bloquear esses comportamentos em modelos animais da doença. Estes resultados poderão ajudar no desenvolvimento de terapias promissoras para pessoas que sofrem detranstorno obsessivo compulsivo.[49]

Vício em drogas:o vício está relacionado com uma desregulação positiva do sistema de recompensa natural docérebro,pelo que um melhor entendimento acerca dos circuitos envolvidos neste sistema poderiam ajudar a tratar e/ou prevenir estapatologia.Sabendo que o sistema de recompensa está relacionado com uma região do cérebro designadaNucleo accumbens(NAc), usaram-se ferramentas optogenéticas para estudar os circuitos neuronais com ela relacionados, observando-se de que forma a ativação de vias neuronais específicas podiam ser traduzidas em “recompensas”. Com esses estudos foi possível identificar novas relações entre regiões do cérebro correlacionadas com a sensação de recompensa e que levam a vício e abuso de drogas patologicamente.[43]
Depressão:Os mecanismos moleculares desta patologia estão muito pouco compreendidos e, por esse motivo, os medicamentosantidepressivosatualmente existentes têm uma elevada taxa de ineficácia. Para perceber melhor os mecanismos daestimulação cerebral profunda(um tipo de terapia paradepressão), foram usadas ferramentas optogenéticas para atuar nos corpos celulares docórtex pré-frontalderatinhoscomo forma de tratamento, tendo-se obtido respostas antidepressivas.[50]
Um dos sintomas de depressão é o sentimento deapatiae a incapacidade de sentir prazer, desde modo, estando os neurónios dedopaminaenvolvidos na motivação e sensação de recompensa, foram usadas técnicas de optogenética para estudar a contribuição de alterações do sistema dopaminérgicos na depressão. Este estudo concluiu que um controlo inibitório ou excitatório de neurónios dopaminérgicos específicos pode ajudar no tratamento da depressão, aliviando alguns dos seus sintomas.[51]
Dado que os atuaismedicamentosprovocam efeitos secundários adversos, a optogenética poderá também ajudar a melhor conhecer a distribuição e funcionalidade dos recetores dos fármacos, melhorando drasticamente a especificidade de atuação do medicamento e reduzindo os efeitos indesejáveis.[52][53]Além disso, a avaliação do estado da depressão num doente é definida apenas pela experiência subjetiva, tornando-se difícil medir os sintomas e correlacioná-los com os animais modelo. Desta forma, as técnicas optogenéticas usadas para dissecar os circuitos responsáveis pela depressão e outras desordens de humor, poderão ajudar a avaliar o grau da doença.[43]
Autismo e esquizofrenia:estas duas doenças partilham vários sintomas como a disfunção social e ambas têm outros tantos sintomas diferentes e tão variáveis que se torna difícil estabelecer uma causa.[43]
Aesquizofreniamanifesta-se muitas vezes poralucinaçõesprovocadas por um não balanceamento desinapsesexcitatórias e inibitórias que leva a circuitos neuronais com um resultado alterado devido a problemas no processamento da informação. Por este motivo têm sido feitos estudos em neurónios envolvidos nestes processos que ajudaram a revelar/confirmar o envolvimento de determinados circuitos na modulação do processamento de informação, nomeadamente os neuróniosparvalbuminosneocorticais.[54][55]
Os sintomas das desordens do espectroautistacaracterizam-se por movimentos repetitivos e estereotipados e problemas de comunicação, entre outros. Tal como a esquizofrenia, uma das suas causas poderia ser um desequilíbrio no número de sinapses excitatórias e inibitórias. Assim, as técnicas de optogenética permitiram confirmar esta hipótese provocando artificialmente esse desequilíbrio.[56]
Epilepsia:esta doença é caracterizada porconvulsõesespontâneas e recorrentes. Sabe-se que este sintoma é devido a um desequilíbrio entresinapsesinibitórias e excitatórias que resulta numa estimulação excessiva de determinados circuitos, no entanto, os tratamentos atuais levam a efeitos secundários significativamente debilitantes. Usando abordagens optogenéticas em que, de forma específica, se inibiram células excitatórias ou silenciaram células inibitórias, foi possível parar as convulsões durante o estudo. Com estes resultados, acredita-se ser possível desenvolver uma abordagem clínica que permita detetar e impedir as convulsões atuando em regiões docérebroespecíficas e, ao mesmo tempo, prevenindo os efeitos adversos secundários das atuais terapêuticas.[57][58]

Retinite pigmentosa:doença hereditária em que ocorre adegeneraçãode fotorrecetores responsáveis pelavisão noturna(fotorrecetores rod) e perda de sensibilidade àluzpelos fotorreceptores responsáveis pelacore visão diurna (fotorrecetores cone), conduzindo progressivamente a umacegueiraincurável. Apesar da perda de sensibilidade à luz, os fotorreceptores cone sobrevivem. Numa abordagem terapêutica com técnicas optogenéticas em que se expressaram channelrodopsins nos cones insensíveis, foi possível substituir a cascata original do processo de fototransdução e, assim, restaurar a sensibilidade da luz em modelos deratinhocomretinite pigmentosa.Os mesmos resultados foram observados em estudos semelhantes realizados comtecidohumano deretinaex vivo.[59]

Doença de Parkinson:esta doençaneurodegenerativa é caracterizada pela morte de neuróniosdopaminérgicosem certas regiões docérebro,o que leva a problemaslocomotores.[60]Não se sabendo bem quais os circuitos responsáveis quais os circuitos neuronais responsáveis pelo planeamento motor e pela seleção de ações afetado nestas doenças, tendo sido descritos dois modelos responsáveis por obter respostas diferentes no funcionamento motor: a via direta e a via indireta. Para determinar o modelo mais correto, utilizaram-se ferramentas optogenéticas, ativando as vias. Foi observado que a excitação da via indireta provocava sintomas deParkinson,como o aumento de imobilização e redução do início de novas ações locomotoras. Pelo contrário, ao ativar a via direta num modelo deratinhocom Parkinson, verificou-se uma melhoria dos sintomas comuns nesta doença. Assim, neste estudo comprovou-se que a modulação do circuito da via direta pode ser usado como estratégia terapêutica para melhorar a deficiência motora.[61]
Aestimulação cerebral profundatem sido estudada como outra possível forma de tratamento para esta doença. Sendo necessária uma elevada precisão na colocação correta doselétrodosno cérebro, a optogenética tem ajudado melhorar a especificidade dos circuitos neuronais e também a perceber melhor quais as células neuronais relevantes para este processo. Utilizando ratinhos modelo com doença de Parkinson, foram demonstrados efeitos terapêuticos ao estimular diretamente osaxóniosdos neurónios projetados para a região donúcleo subtalâmico.[60]
Desordens de sono:Dormir maldevido adores crónicaspode levar a um aumento destressno dia-a-dia e o mecanismo pelo qual a dor interfere com o sono, levando a esta e outras consequências, não é ainda bem conhecido. Fizeram estudos em regiões cerebrais que se sabia serem alteradas em situação de dor crónica, através de técnicas de optogenética. Tendo-se observado que a atividade de certos neurónios dessas regiões era importante para a manutenção de um estado acordado, diminuindo os episódios desonoprofundo. Foi assim possível estabelecer uma correlação entre desregulações de sono em situações de dor crónica, o que poderá ser útil no desenvolvimento de futuras terapias.[62]
Narcolepsia:é outra desordem neurológica relacionada com problemas de sono, mas neste caso o indivíduo sente demasiado sono durante o dia, experienciaalucinaçõesecatalepsia(fraqueza muscular repentina). Estes sintomas, entre outros, levam a que as pessoas que sofrem denarcolepsiaadormeçam em alturas inapropriadas e que, apesar de conseguirem executar tarefas habituais, não se consigam lembrar do que fizeram mais tarde.Esta doença está relacionada com problemas na produção dehipocretina(umpeptídeoneurotransmissor) importante na manutenção de um estado acordado.[63]Osneuróniosprodutores de hipocretina estão presentes nohipotálamomas não se sabia ao certo de que forma estavam relacionados com osono.Com estimulação optogenética destes neurónios foi possível verificar um aumento do estado acordado.[37]
Medicina Regenerativa:As técnicas de optogenética poderão ser usadas em investigação emcélulas estaminaisemedicina regenerativaao permitir alterações napolarizaçãodamembrana celular,modulando os fluxos deiõesde forma rápida, precisa e não invasiva. Adespolarizaçãomembranar parece estar envolvida nadiferenciaçãode células estaminais e ser importante para a sobrevivência e função deneuróniosadultos. Abordagens optogenéticas poderão, assim, ser usadas para controlar a diferenciação de células estaminaisinvitroouin vivo',analisando a contribuição específica das células transplantadas para a função dotecidoou da rede neuronal; e para regular aplasticidadedas células estaminais embrionárias humanas, o que poderá resultar emterapias celulares.[64][65]
Problemas Cardíacos:As técnicas optogenéticas podem também ser aplicadas em áreas fora dasneurociênciascomo acardiologia.Devido à possibilidade de excitar ou inibir células rápida e seletivamente será possível estudar a função de células cardíacas específicas com uma elevada resolução espaciotemporal. Permitem, por exemplo, estudar a origem dearritmiasatravés da estimulação seletiva de células cardíacas. Além disso, através de técnicas optogenéticas, foi já possível criar e controlar umpacemakercardíaco expressando halorrodopsins e channelrodopsins emcardiomiócitosdepeixe-zebracom o objetivo de melhor entender a função de certas células cardíacas durante odesenvolvimento.[66][44]Este tipo de estudos poderá levar ao desenvolvimento de novas estratégias antiarritmia através deinvestigação translacional.[44]
Perspetivas Futuras
[editar|editar código-fonte]A optogenética permite estabelecer uma relação entre funçõescomportamentaiscom padrões de atividade celular e circuitos neuronais. É por isso uma abordagem com um enorme potencial para ainvestigação fundamental,já que a excitação nervosa e o seu silenciamento podem ser realizados reversivelmente e com elevada precisão. Existem já vários estudos, que fazem uso de abordagens optogenéticas, focados na compreensão dos circuitos envolvidos emdoenças neurológicas.A aplicação da optogenética em tipos de células distintos e projeções docérebrojá permitiu perceber um pouco mais sobre os substratos celulares de distúrbios neurológicos e psiquiátricos, incluindo adoença de Parkinson,aansiedade,a degeneração daretina,a disfunção social e adepressão.[2][16]
O avanço na investigação prende-se com a eficácia, agilidade e aplicabilidade dos métodos existentes. Nesse sentido, a prospeção dogenomae aengenharia molecularjá permitiram a descoberta de uma vasta gama de ativadores e inibidores neuronais comcomprimentos de ondade excitação distintos, seletividade iónica ecinética.Ainda assim, continua a tentar-se encontrar ou desenvolverproteínassensíveis a comprimentos de onda deultrassomou gamas de frequência magnética permitirá o controlo remoto de regiões cerebrais sem a necessidade de quaisquer implantes cirúrgicos. Além disso, a descoberta e utilização de novasopsinascomcondutânciaseletiva para opotássioe ocálcio,consideradosiõesimportantes em eventossinápticose vias de sinalização intraneuronais, irão contribuir para uma melhor compreensão do papel dos processos de sinalização específicos na função neural.[30]
A associação da optogenética com outras tecnologias facilitará a análise global das funções cerebrais. Por exemplo, uma combinação de técnicas optogenéticas com aressonância magnéticafuncional permitirá identificar regiões alvo do cérebro e os padrões de atividade correspondentes a funções comportamentais específicas. Além disso, a análise doepigenomae dotranscriptomados circuitos identificados irá facilitar a relação entre a componente molecular e a dinâmica e comportamento do circuito. A capacidade de modular especificamente a atividade elétrica,bioquímicae detranscriçãode circuitos neuronais específicos permitirá igualmente compreender melhor o funcionamento dosistema nervosonormal e em situações de doença. Deste modo, a conjugação da optogenética com outras disciplinas dabiologiae daengenharialevará à descoberta de novos alvos terapêuticos e terapias inovadoras paradoenças neuronais.[30]
Prémios
[editar|editar código-fonte]Sendo uma técnica inovadora, em grande expansão e com uma enorme potencialidade, a optogenética tem valido prémios a alguns investigadores que sobre ela se debruçaram:
- 2010 –Karl Deisseroth daUniversidade de Stanfordganhou o prémioHuman Frontier Science Program“pelo seu trabalho pioneiro no desenvolvimento dos métodos de optogenética para estudar a função das redes neuronais no comportamento”;
- 2010 –a técnica de optogenética foi distinguida como “Método do Ano”pela revista científica Nature Methods;
- 2010 –a optogenética foi reconhecida pela revista científica Science no artigo “Avanços da Década”(do inglês “Breaktroughs of the Decade” );
- 2012 –Gero Miesenböck ganhou oPrêmio Saúde InBev-Baillet Latourpelas suas “abordagens optogenéticas pioneiras para manipular atividade neuronal e controlar comportamento animal”;
- 2013 -Ernst Bamberg, Edward Boyden, Karl Deisseroth, Peter Hegemann, Gero Miesenböck e Georg Nagel ganharam o “Prémio Cérebro”(do inglês “The Brain Prize” ) pela “invenção e refinamento da optogenética”;
- 2013 –Edward Boyden, Karl Deisseroth e Gero Miesenböck ganharam o “16º Prémio Annual Jacob Heskel Gabbay em Biotecnologia e Medicina”pelas suas “contribuições para a descoberta e aplicação da optogenética”.
Referências
- ↑abcdefDeisseroth, K.,et al., Next-generation optical technologies for illuminating genetically targeted brain circuits. J Neurosci, 2006. 26(41): p. 10380-6.
- ↑abcdefghijklmnopqrsFenno, L., O. Yizhar, e K. Deisseroth, The development and application of optogenetics. Annu Rev Neurosci, 2011. 34: p. 389-412.
- ↑abcPlaiasu, V., Update in Genetics. Maedica (Buchar), 2011. 6(1): p. 70.
- ↑Wentz, C.T.,et al.,A wirelessly powered and controlled device for optical neural control of freely-behaving animals. J Neural Eng, 2011. 8(4): p. 046021.
- ↑Shimomura, O., F.H. Johnson, e Y. Saiga, Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol, 1962. 59: p. 223-39.
- ↑Shimomura, O., F.H. Johnson, e Y. Saiga, Microdetermination of Calcium by Aequorin Luminescence. Science, 1963. 140(3573): p. 1339-40.
- ↑abInouye, S., et al., Cloning e sequence analysis of cDNA for the luminescent protein aequorin. Proc Natl Acad Sci U S A, 1985. 82(10): p. 3154-8.
- ↑Chalfie, M.,et al., Green fluorescent protein as a marker for gene expression. Science, 1994. 263(5148): p. 802-5.
- ↑Heim, R., A.B. Cubitt, e R.Y. Tsien, Improved green fluorescence. Nature, 1995. 373(6516): p. 663-4.
- ↑Matz, M.V.,et al., Fluorescent proteins from nonbioluminescent Anthozoa species. Nat Biotechnol, 1999. 17(10): p. 969-73.
- ↑Campbell, R.E.,et al., A monomeric red fluorescent protein. Proc Natl Acad Sci U S A, 2002. 99(12): p. 7877-82.
- ↑Miyawaki, A.,et al., Dynamic and quantitative Ca2+ measurements using improved cameleons. Proc Natl Acad Sci U S A, 1999. 96(5): p. 2135-40.
- ↑abPatterson, G.H. e J. Lippincott-Schwartz, A photoactivatable GFP for selective photolabeling of proteins and cells. Science, 2002. 297(5588): p. 1873-7.
- ↑abcdefghBoyden, E.S.,et al.,Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci, 2005. 8(9): p. 1263-8.
- ↑Crick, F.H.,Thinking about the brain.Sci Am, 1979. 241(3): p. 219-32.
- ↑abcdefghijklDugue, G.P., W. Akemann, e T. Knopfel, A comprehensive concept of optogenetics. Prog Brain Res, 2012. 196: p. 1-28.
- ↑abZemelman, B.V.,et al., Selective photostimulation of genetically chARGed neurons. Neuron, 2002. 33(1): p. 15-22.
- ↑abcdefLima, S.Q. e G. Miesenbock, Remote control of behavior through genetically targeted photostimulation of neurons. Cell, 2005. 121(1): p. 141-52.
- ↑abNagel, G.,et al., Channelrhodopsin-1: a light-gated proton channel in green algae. Science, 2002. 296(5577): p. 2395-8.
- ↑abMancuso, J.J.,et al.,Optogenetic probing of functional brain circuitry. Exp Physiol, 2011. 96(1): p. 26-33.
- ↑abNagel, G.,et al.,Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol, 2005. 15(24): p. 2279-84.
- ↑abMatarèse, Bruno F. E.; Feyen, Paul L. C.; de Mello, John C.; Benfenati, Fabio (2019).«Sub-millisecond Control of Neuronal Firing by Organic Light-Emitting Diodes».Frontiers in Bioengineering and Biotechnology(em inglês).7.doi:10.3389/fbioe.2019.00278
- ↑Gradinaru, V.,et al., Targeting and readout strategies for fast optical neural control in vitro and in vivo. J Neurosci, 2007. 27(52): p. 14231-8.
- ↑Zhang, F.,et al., Channelrhodopsin-2 and optical control of excitable cells. Nat Methods, 2006. 3(10): p. 785-92.
- ↑Yizhar, O.,et al.,Optogenetics in neural systems. Neuron, 2011. 71(1): p. 9-34.
- ↑Husson, S.J.,et al.,Microbial light-activatable proton pumps as neuronal inhibitors to functionally dissect neuronal networks in C. elegans. PLoS One, 2012. 7(7): p. e40937.
- ↑Gradinaru, V., K.R. Thompson, e K. Deisseroth, eNpHR: a Natronomonas halorhodopsin enhanced for optogenetic applications. Brain Cell Biol, 2008. 36(1-4): p. 129-39.
- ↑Zhao, S.,et al.,Improved expression of halorhodopsin for light-induced silencing of neuronal activity. Brain Cell Biol, 2008. 36(1-4): p. 141-54.
- ↑Chow, B.Y.,et al.,High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature, 2010. 463(7277): p. 98-102.
- ↑abcdeRein, M.L. e J.M. Deussing, The optogenetic (r)evolution. Mol Genet Genomics, 2012. 287(2): p. 95-109.
- ↑abMei, Y. e F. Zhang, Molecular tools and approaches for optogenetics. Biol Psychiatry, 2012. 71(12): p. 1033-8.
- ↑Packer, A.M., B. Roska, e M. Hausser, Targeting neurons and photons for optogenetics. Nat Neurosci, 2013. 16(7): p. 805-15.
- ↑Husson, S.J., A. Gottschalk, e A.M. Leifer, Optogenetic manipulation of neural activity in C. elegans: from synapse to circuits and behaviour. Biol Cell, 2013. 105(6): p. 235-50.
- ↑Leifer, A.M.,et al.,Optogenetic manipulation of neural activity in freely moving Caenorhabditis elegans. Nat Methods, 2011. 8(2): p. 147-52.
- ↑van Alphen, B. e B. van Swinderen, Drosophila strategies to study psychiatric disorders. Brain Res Bull, 2013. 92: p. 1-11.
- ↑Hafezparast, M.,et al.,Mouse models for neurological disease. Lancet Neurol, 2002. 1(4): p. 215-24.
- ↑abAdamantidis, A.R.,et al.,Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature, 2007. 450(7168): p. 420-4.
- ↑Tsai, H.C.,et al.,Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science, 2009. 324(5930): p. 1080-4.
- ↑Berdyyeva, T.K. e J.H. Reynolds, The dawning of primate optogenetics. Neuron, 2009. 62(2): p. 159-60.
- ↑abDouglass, A.D.,et al., Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr Biol, 2008. 18(15): p. 1133-7.
- ↑Best, J.D. e W.K. Alderton, Zebrafish: An in vivo model for the study of neurological diseases. Neuropsychiatr Dis Treat, 2008. 4(3): p. 567-76.
- ↑Deisseroth, K., Optogenetics and psychiatry: applications, challenges, and opportunities. Biol Psychiatry, 2012. 71(12): p. 1030-2.
- ↑abcdeTye, K.M. e K. Deisseroth, Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci, 2012. 13(4): p. 251-66.
- ↑abcAbilez, O.J., Cardiac optogenetics. Conf Proc IEEE Eng Med Biol Soc, 2012. 2012: p. 1386-9.
- ↑Tye, K.M.,et al., Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature, 2011. 471(7338): p. 358-62.
- ↑Kim, S.Y.,et al.,Diverging neural pathways assemble a behavioural state from separable features in anxiety. Nature, 2013. 496(7444): p. 219-23.
- ↑Ciocchi, S.,et al., Encoding of conditioned fear in central amygdala inhibitory circuits. Nature, 2010. 468(7321): p. 277-82.
- ↑Ahmari, S.E.,et al., Repeated cortico-striatal stimulation generates persistent OCD-like behavior. Science, 2013. 340(6137): p. 1234-9.
- ↑Burguiere, E.,et al.,Optogenetic stimulation of lateral orbitofronto-striatal pathway suppresses compulsive behaviors. Science, 2013. 340(6137): p. 1243-6.
- ↑Covington, H.E., 3rd,et al., Antidepressant effect of optogenetic stimulation of the medial prefrontal cortex. J Neurosci, 2010. 30(48): p. 16082-90.
- ↑Tye, K.M.,et al.,Dopamine neurons modulate neural encoding and expression of depression-related behaviour. Nature, 2013. 493(7433): p. 537-41.
- ↑Li, X., M.A. Frye, e R.C. Shelton, Review of pharmacological treatment in mood disorders and future directions for drug development. Neuropsychopharmacology, 2012. 37(1): p. 77-101.
- ↑Aston-Jones, G. e K. Deisseroth, Recent advances in optogenetics and pharmacogenetics. Brain Res, 2013. 1511: p. 1-5.
- ↑Sohal, V.S.,et al.,Parvalbumin neurons and gamma rhythms enhance cortical circuit performance. Nature, 2009. 459(7247): p. 698-702.
- ↑Cardin, J.A.,et al.,Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature, 2009. 459(7247): p. 663-7.
- ↑Rubenstein, J.L. e M.M. Merzenich, Model of autism: increased ratio of excitation/inhibition in key neural systems. Genes Brain Behav, 2003. 2(5): p. 255-67.
- ↑Krook-Magnuson, E.,et al.,On-demand optogenetic control of spontaneous seizures in temporal lobe epilepsy. Nat Commun, 2013. 4: p. 1376.
- ↑Bentley, J.N.,et al.,Optogenetics in epilepsy. Neurosurg Focus, 2013. 34(6): p. E4.
- ↑Busskamp, V.,et al.,Genetic reactivation of cone photoreceptors restores visual responses in retinitis pigmentosa. Science, 2010. 329(5990): p. 413-7.
- ↑abGradinaru, V.,et al.,Optical deconstruction of parkinsonian neural circuitry. Science, 2009. 324(5925): p. 354-9.
- ↑Kravitz, A.V.,et al., Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry. Nature, 2010. 466(7306): p. 622-6.
- ↑Ito, H.,et al.,Analysis of sleep disorders under pain using an optogenetic tool: possible involvement of the activation of dorsal raphe nucleus-serotonergic neurons. Mol Brain, 2013. 6(1): p. 59.
- ↑Wurtman, R.J., Narcolepsy and the hypocretins. Metabolism, 2006. 55(10 Suppl 2): p. S36-9.
- ↑Stroh, A.,et al., Tracking stem cell differentiation in the setting of automated optogenetic stimulation. Stem Cells, 2011. 29(1): p. 78-88.
- ↑Weick, J.P.,et al., Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem Cells, 2010. 28(11): p. 2008-16.
- ↑Arrenberg, A.B.,et al.,Optogenetic control of cardiac function. Science, 2010. 330(6006): p. 971-4.
