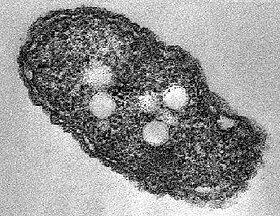
Azotobacter
| Azotobacter | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||||||
| |||||||||||||
| Espécies | |||||||||||||
Azotobacter é um género de bactérias esféricas ou ovais Gram negativas geralmente móveis, que formam quistos de paredes espessas e podem produzir grandes quantidades de mucosidade capsular. São aeróbicas, de vida livre, e vivem principalmente nos solos, onde desempenham um importante papel no ciclo do nitrogénio na natureza, captando nitrogénio atmosférico, que é inacessível às plantas, e libertando-o em forma de íons amónio no solo (fixação de nitrogénio). As espécies deste género, para além de servirem como organismos modelo, são utilizadas para a produção de biofertilizantes, aditivos alimentares e alguns biopolímeros. O primeiro representante do género, Azotobacter chroococcum, foi descoberto e descrito em 1901 pelo microbiólogo e botânico holandês Martinus Beijerinck. As Azotobacter encontram-se em solos neutros e alcalinos,[1][2] na água e em associação com algumas plantas.[3][4]
Características biológicas
[editar | editar código-fonte]Morfologia
[editar | editar código-fonte]
As células do género Azotobacter são relativamente grandes para o tamanho normal de uma bactéria (1–2 micrómetros de diâmetro). São geralmente ovais, mas podem adoptar várias formas desde a de bacilos à de cocos. Em preparações microscópicas, as células podem estar dispersas ou formar grupos irregulares ou ocasionalmente cadeias de vários tamanhos. Nas culturas frescas as células são móveis devido aos seus numerosos flagelos.[5] Posteriormente as células perdem a sua mobilidade, tornando-se quase esféricas e produzem uma grossa camada de mucosidade, formando a cápsula da célula. A forma da célula é afectada pelo aminoácido glicina, que está presente na peptona do meio nutritivo.[6]
Em observações ao microscópio as células apresentam inclusões, algumas das quais se encontram coloreadas. Em inícios da década de 1900 considerava-se que as inclusões coloreadas eram "grãos reprodutivos", ou gonidia, um tipo de célula embrionária.[7] Mas mais tarde demonstrou-se que os grânulos não participavam na divisão da célula.[8] Os grânulos coloreados são compostos por volutina, enquanto que as inclusões incolores são gotas de gordura que atuam como reservas energéticas.[9]
Quistos
[editar | editar código-fonte]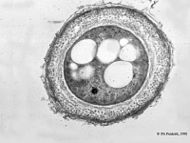
Os quistos do género Azotobacter são mais resistentes a factores ambientais adversos do que as células vegetativas, e em particular, são duas vezes mais resistentes à luz ultravioleta. São também resistentes à secagem, ultrassons e irradiação solar e gama, mas não ao calor.[10]
A formação de quistos é induzida por mudanças na concentração de nutrientes no meio e pela adição de algumas substâncias orgânicas como o etanol, o n-butanol ou o β-hidroxibutirato. Em meios líquidos é rara a formação de quistos.[11] A formação de quistos é induzida por factores químicos e é acompanhada por alterações metabólicas que afectam o catabolismo, a respiração celular e a biossíntese de macromoléculas;[12] esta também é afectada pelas aldeído desidrogenase[13] e pelo regulador da resposta AlgR.[14]
O quisto de Azotobacter é esférico e consiste no chamado corpo central (uma cópia reduzida de células vegetativas com vários vacúolos) e na cobertura de duas camadas. A parte interna da cobertura chama-se intina e tem uma estrutura fibrosa.[15] A parte externa apresenta uma estrutura cristalina hexagonal, a qual se denomina exina.[16] A exina é parcialmente hidrolizada pela tripsina e é resistente à lisozima, ao contrário do corpo central.[17] O corpo central pode isolar-se num estado viável com alguns agentes quelantes.[18] Os principais constituintes da cobertura externa são os alquilresorcinóis, compostos por longas cadeias alifáticas e anéis aromáticos. Os alquilresorcinóis também se encontram noutras bactérias, animais e plantas.[19]Anderson Miranda
Germinação de quistos
[editar | editar código-fonte]Os quistos do género Azotobacter são a forma de repouso de uma célula vegetativa. Contudo, enquanto as células vegetativas são reprodutoras, o quisto de Azotobacter não serve para a reprodução, senão para resistir a factores ambientais adversos. Depois de recuperadas as condições ambientais ideais, que incluem um determinado valor de pH, temperatura e fontes de carbono, os quistos germinam e as células vegetativas originadas começam a multiplicar-se por fissão simples. Durante a germinação, os quistos são danificados e libertam uma célula vegetativa maior. Microscopicamente, a primeira manifestação de germinação consiste na diminuição gradual na refração da luz dos quistos, que se detecta com um microscópio de contraste de fase. A germinação de quistos é um processo lento que demora entre 4 e 6 horas. Durante a germinação, o corpo central cresce e captura os grânulos de volutina que se encontram localizados na intina (a camada mais interna). Depois a exina eclode e a célula vegetativa liberta-se da exina, a qual possui uma forma característica de ferradura.[20] Este processo é acompanhado por alterações metabólicas. Imediatamente depois de lhes serem subministrada uma fonte de carbono, os quistos começam a absorver oxigénio e emitem dióxido de carbono; o ritmo deste processo aumenta gradualmente e satura em 4 horas. A síntese de proteínas e ARN ocorre paralelamente, mas só se intensifica depois de passadas 5 horas desde a adição da fonte de carbono. A síntese de ADN e fixação do nitrogénio têm início 5 horas depois da adição de glicose num meio nutriente sem nitrogénio.[21]
A germinação dos quistos é acompanhada por mudanças na intina, visíveis com microscópio electrónico. A intina é formada por carboidratos, lípidos e proteínas, e tem quase o mesmo volume que o corpo central. Durante a germinação dos quistos, a intina hidroliza-se e a célula utiliza-a para a síntese dos seus componentes.[22]
Propriedades fisiológicas
[editar | editar código-fonte]O género Azotobacter apresenta respiração aeróbia, recebendo energia de reacções redox, e utiliza compostos orgânicos como doadores de electrões. As Azotobacter podem utilizar diversos carboidratos, alcoóis e sais de ácidos orgânicos como fontes de carbono, e podem fixar pelo menos 10 microgramas de nitrogénio por grama de glicose consumida. Para esta fixação do nitrogénio são necessários íons molibdénio, mas podem ser parcialmente substituídos por íons vanádio, ou mesmo prescindir de ambos. As fontes de nitrogénio podem ser nitratos, íons amónio ou aminoácidos. O pH ideal para o crescimento e a fixação de nitrogénio é de 7,0–7,5, mas o crescimento é mantido no intervalo de pH entre 4,8 e 8,5.[23] As Azotobacter podem também crescer mixotroficamente, num meio sem nitrogénio que contenha manose; este modo de crescimento depende do hidrogénio. O hidrogénio encontra-se disponível no solo, assim sendo, esta forma de crescimento pode ocorrer na natureza.[24]
Quando crescem, as Azotobacter produzem colónias planas, viscosas como uma pasta com um diâmetro de 5–10 mm, as quais podem formar biofilmes em meios nutritivos líquidos. As colónias podem ser castanhas escuras, verdes ou doutra cor, ou mesmo incolores, dependendo da espécie. Crescem melhor a uma temperatura de 20–30 °C.[25]
As bactérias do género Azotobacter são também conhecidas por formar inclusões intracelulares de polihidroxialcanoatos sob determinadas condições ambientais (por exemplo, falta de elementos como fósforo, nitrogénio, ou oxigénio combinada com um suprimento excessivo de fontes de carbono).[26][27]
Pigmentos
[editar | editar código-fonte]O género Azotobacter produz pigmentos. Por exemplo, o Azotobacter chroococcum forma um pigmento de melanina hidrossolúvel castanho escuro. Este processo ocorre num alto nível metabólico durante a fixação do nitrogénio, e pensa-se que protege o sistema da nitrogenase dos efeitos do oxigénio.[28] Outras espécies de Azotobacter produzem pigmentos com cores desde o amarelo esverdeado ao púrpura,[29] entre eles um pigmento verde que é fluorescente com luz amarelo-esverdeada e outro com fluorescência azul esbranquiçado.[30]
Genoma
[editar | editar código-fonte]Foi parcialmente determinada a sequência de nucleótidos do cromossoma de Azotobacter vinelandii cepa AvOP. Este cromossoma é uma uma molécula de ADN circular que contém 5 342 073 pares de bases e 5 043 genes, dos quais 4 988 codificam proteínas. A fracção de pares G + C é de 65 moles por cento. O número de cromossomas nas células e o conteúdo de ADN aumenta conforme a idade da célula e na fase de crescimento estacionária, os cultivos podem conter mais de 100 cópias dum cromossoma por célula. O conteúdo original de ADN (uma cópia) é restaurado na replantação do cultivo num meio fresco.[31] Para além do ADN cromossómico, o Azotobacter pode conter plasmídeos.[32]
Distribuição
[editar | editar código-fonte]As espécies de Azotobacter são ubíquas em solos de pH neutro ou ligeiramente alcalino, mas não em solos ácidos.[33] Também se encontram em solos da região ártica e antártica, apesar do clima frio ali reinante, da curta estação de crescimento e dos valores de pH do solo relativamente baixos.[34] Em solos secos, a Azotobacter pode sobreviver em forma de quistos até 24 anos.[35]
Representantes do género Azotobacter também vivem em ambientes aquáticos, inclusive em águas doces[36] e pântanos salgados.[37] Vários membros estão associados a plantas e encontram-se na rizosfera, estabelecendo certas relações com as raízes das plantas.[38] Algumas cepas encontram-se também nos casulos de minhocas da espécie Eisenia fetida.[39]
Fixação do nitrogénio
[editar | editar código-fonte]As Azotobacter são bactérias fixadoras de nitrogénio de vida livre, o que as diferencia das espécies de Rhizobium, que actuam nos nódulos radiculares. As Azotobacter normalmente fixam o nitrogénio molecular da atmosfera sem estabelecerem relações simbióticas com as plantas, embora também existam algumas espécies de Azotobacter associadas com plantas.[40] A fixação do nitrogénio é inibida na presença de fontes de nitrogénio disponíveis, como íons amónio e nitratos.[41]
As Azotobacter necessitam de uma ampla variedade de enzimas para a fixação do nitrogénio, entre as quais: ferredoxina, hidrogenase e a importante enzima nitrogenase. O processo de fixação do nitrogénio requer um fluxo de energia em forma de adenosina trifosfato (ATP). A fixação do nitrogénio é bastante sensível à presença de oxigénio e, por isso, as Azotobacter evoluiram um mecanismo defensivo especial contra o oxigénio, que consiste principalmente numa intensificação significativa do metabolismo que reduz a concentração de oxigénio nas células.[42] Existe também uma proteína protectora da nitrogenase especial chamada Shethna, que protege a nitrogenase e está implicada na proteção das células do oxigénio. Os mutantes que não produzem esta proteína morrem por causa do oxigénio durante a fixação do nitrogénio na ausência de uma fonte de nitrogénio no meio.[43] Os íons homocitrato desempenham um certo papel no processo de fixação do nitrogénio por Azotobacter.[44]
Nitrogenase
[editar | editar código-fonte]A nitrogenase é a enzima mais importante envolvida na fixação do nitrogénio. As espécies de Azotobacter possuem vários tipos de nitrogenase. O tipo básico é a nitrogenase de molibdénio-ferro.[45] Um tipo alternativo é a nitrogenase de vanádio, que é independente dos íons de molibdénio[46][47][48] e mais activa que a nitrogenase de Mo-Fe a baixas temperaturas. Deste modo, pode fixar nitrogénio a temperaturas baixas de até 5 °C e a sua actividade a temperaturas baixas é 10 vezes maior do que a da nitrogenase de Mo-Fe.[49] O denominado cluster P desempenha um importante papel na maturação da nitrogenase de Mo-Fe.[50] A síntese da nitrogenase é controlada pelos genes nif.[51] A fixação do nitrogénio é regulada pela proteína amplificadora NifA e a flavoproteína "detectora" NifL, que modula a activação da transcrição genética da fixação do nitrogénio a partir de um sistema de comutação dependente de redox.[52] Este mecanismo regulador, que depende de duas proteínas que formam complexos entre si, é pouco comum no controlo de outros sistemas.[53]
Importância
[editar | editar código-fonte]
A fixação do nitrogénio tem um importante papel no ciclo do nitrogénio. As Azotobacter também sintetizam algumas substâncias biologicamente activas, entre elas as fitohormonas como as auxinas,[54] que estimulam o crescimento das plantas.[55][56] Também facilitam a mobilidade de metais pesados no solo e assim podem potenciar a biorremediação da contaminação por metais pesados do solo, como o cádmio, mercúrio e chumbo.[57] Alguns tipos de Azotobacter podem também biodegradar compostos aromáticos que contenham cloro, como o 2,4,6-triclorofenol. Este composto foi inicialmente usado como insecticida, fungicida e herbicida mas mais tarde veio-se a descobrir que tinha efeitos mutagénicos e carcinogénicos.[58]
Aplicações
[editar | editar código-fonte]Devido à sua capacidade de fixar nitrogénio molecular e assim aumentar a fertilidade do solo e estimular o crescimento das plantas, as Azotobacter são muito utilizadas na agricultura,[59] especialmente em biofertilizantes de nitrogénio. São também utilizadas na produção de ácido algínico (E400),[60][61][62] que se aplica em medicina como antiácido, e na indústria alimentícia como aditivo para os gelados, pudins e cremes,[63] e ainda na bioabsorção de metais.[64]
Taxonomia
[editar | editar código-fonte]O género Azotobacter foi descoberto em 1901 pelo microbiólogo e botânico holandês Martinus Beijerinck, um dos fundadores da microbiologia ambiental. Ele seleccionou e descobriu a espécie Azotobacter chroococcum, o primeiro fixador de nitrogénio de vida livre aerobiótico.[65]
Em 1909, Lipman descreveu a espécie Azotobacter vinelandii e, um ano depois, a Azotobacter beijerinckii, que ele nomeou em homenagem a Beijerinck. Em 1949 o microbiólogo russo Nikolai Krasilnikov identificou a espécie Azotobacter nigricans, que foi dividida em 1981 por Thompson Skerman em duas subespécies chamadas Azotobacter nigricans subsp. nigricans e Azotobacter nigricans subsp. achromogenes. Nesse mesmo ano, Thompson e Skerman descreveram Azotobacter armeniacus. Em 1991, Page e Shivprasad revelaram a descoberta de uma espécie microaerófila e aerotolerante que denominaram Azotobacter salinestris, que dependia de íons sódio.[66]
Inicialmente os representantes deste género foram atribuídos à família Azotobacteraceae PRIBRAM, 1933, mas mais tarde foram transferidos para a família Pseudomonadaceae com base em estudos das sequências de nucleotídeos do ARNr de 16S. Em 2004, um estudo filogenético revelou que Azotobacter vinelandii pertencia ao mesmo clado que a bactéria Pseudomonas aeruginosa,[67] e em 2007 foi sugerido que os géneros Azotobacter, Azomonas e Pseudomonas estão relacionados e poderiam ser sinónimos.[68]
Referências
- ↑ Gandora V., Gupta R. D., Bhardwaj K. K. R. (1998). «Abundance of Azotobacter in great soil groups of North-West Himalayas». Journal of the Indian Society of Soil Science. 46 (3): 379–383
- ↑ Martyniuk S., Martyniuk M. (2003). «Occurrence of Azotobacter Spp. in Some Polish Soils» (PDF). Polish Journal of Environmental Studies. 12 (3): 371–374
- ↑ Tejera N., Lluch C., Martínez-Toledo M. V., González-López J. (2005). «Isolation and characterization of Azotobacter and Azospirillum strains from the sugarcane rhizosphere» (PDF). Plant and Soil. 270 (1–2): 223–232. doi:10.1007/s11104-004-1522-7
- ↑ Kumar R., Bhatia R., Kukreja K., Behl R. K., Dudeja S. S., Narula N. (2007). «Establishment of Azotobacter on plant roots: chemotactic response, development and analysis of root exudates of cotton (Gossypium hirsutum L.) and wheat (Triticum aestivum L.)». Journal of Basic Microbiology. 47 (5): 436–439. PMID 17910096. doi:10.1002/jobm.200610285
- ↑ Baillie A., Hodgkiss W., Norris J. R. (1962). «Flagellation of Azotobacter spp. as Demonstrated by Electron Microscopy». Journal of Applied Microbiology. 25 (1): 116–119. doi:10.1111/j.1365-2672.1962.tb01126.x
- ↑ Vela G. R., Rosenthal R. S. (1972). «Effect of Peptone on Azotobacter Morphology». Journal of Bacteriology. 111 (1): 260–266. PMC 251266
 . PMID 4591479
. PMID 4591479
- ↑ Jones D. H. (1920). «Further Studies on the Growth Cycle of Azotobacter». Journal of Bacteriology. 5 (4): 325–341. PMC 378887
 . PMID 16558880
. PMID 16558880
- ↑ Lewis I. M. (1941). «The cytology of bacteria». Bacteriological Reviews. 5 (3): 181–230. PMC 440852
 . PMID 16350071
. PMID 16350071
- ↑ Lewis I. M. (1937). «Cell Inclusions and the Life Cycle of Azotobacter». Journal of Bacteriology. 34 (2): 191–205. PMC 545221
 . PMID 16560046
. PMID 16560046
- ↑ Socolofsky M. D., Wyss O. (1962). «Resistance of the Azotobacter Cyst». Journal of Bacteriology. 84 (1): 119–124. PMC 277776
 . PMID 13914732
. PMID 13914732
- ↑ Layne J. S., Johnson E. J. (1964). «Natural Factors Involved in the Induction of Cyst Formation in Azotobacter». Journal of Bacteriology. 87 (3): 684–689. PMC 277071
 . PMID 14127586
. PMID 14127586
- ↑ Sadoff H. L. (1975). «Encystment and Germination in Azotobacter vinelandii». Microbiological Reviews. 39 (4): 516–539. PMC 408343
 . PMID 1212151
. PMID 1212151
- ↑ Gama-Castro S., Núñez C., Segura D. , Moreno S., Guzmán J., and Espín G. (2001). «Azotobacter vinelandii Aldehyde Dehydrogenase Regulated by ς54: Role in Alcohol Catabolism and Encystment». Journal of Bacteriology. 183 (21): 6169–6174. PMC 100092
 . PMID 11591659. doi:10.1128/JB.183.21.6169-6174.2001
. PMID 11591659. doi:10.1128/JB.183.21.6169-6174.2001
- ↑ Núñez C., Moreno S., Soberón-Chávez G., Espín G. (1999). «The Azotobacter vinelandii Response Regulator AlgR Is Essential for Cyst Formation». Journal of Bacteriology. 181 (1): 141–148. PMC 103542
 . PMID 9864323
. PMID 9864323
- ↑ Pope L. M., Wyss O. (1970). «Outer Layers of the Azotobacter vinelandii Cyst». Journal of Bacteriology. 102 (1): 234–239. PMC 284991
 . PMID 4191240
. PMID 4191240
- ↑ Page W. J., Sadoff H. L. (1975). «Relationship Between Calcium and Uronic Acids in the Encystment of Azotobacter vinelandiil». Journal of Bacteriology. 122 (1): 145–151. PMC 235651
 . PMID 235508
. PMID 235508
- ↑ Lin L. P., Sadoff H. L. (1969). «Preparation and Ultrastructure of the Outer Coats of Azotobacter vinelandii Cysts». Journal of Bacteriology. 98 (3): 1335–1341. PMC 315331
 . PMID 4977988
. PMID 4977988
- ↑ Parker L. T., Socolofsky M. D. (1968). «Central Body of the Azotobacter Cyst». Journal of Bacteriology. 91 (1): 297–303. PMC 315948
 . PMID 4955249
. PMID 4955249
- ↑ Funa N., Ozawa H., Hirata A., Horinouchi S. (2006). «Phenolic lipid synthesis by type III polyketide synthases is essential for cyst formation in Azotobacter vinelandii». Proceedings of the National Academy of Sciences of the United States of America. 103 (16): 6356–6361. PMC 1458882
 . PMID 16597676. doi:10.1073/pnas.0511227103
. PMID 16597676. doi:10.1073/pnas.0511227103
- ↑ Wyss O., Neumann M. G., Socolofsky M. D. (1961). «Development and germination of the Azotobacter cyst». Journal of Biophysical and Biochemical Cytology. 10 (10): 555–565. doi:10.1083/jcb.10.4.555
- ↑ Loperfido B., Sadoff H. L. (1973). «Germination of Azotobacter vinelandii Cysts: Sequence of Macromolecular Synthesis and Nitrogen Fixation». Journal of Bacteriology. 112 (2): 841–846. PMC 285299
 . PMID 4690966
. PMID 4690966
- ↑ Lin L. P., Pankratz S., Sadoff H. L. (1978). «Ultrastructural and physiological changes occurring upon germination and outgrowth of Azotobacter vinelandii cysts». Journal of Bacteriology. 135 (2): 641–646. PMC 222425
 . PMID 681284
. PMID 681284
- ↑ George M. Garrity, ed. (2005). «Part B: The Gammaproteobacteria». Bergey's Manual of Systematic Bacteriology. The Proteobacteria 2 ed. New York: Springer. ISBN 0-387-95040-0
- ↑ Wong T.-Y., Maier R. J. (1985). «H2-Dependent Mixotrophic Growth of N2-Fixing Azotobacter vinelandii». Journal of Bacteriology. 163 (2): 528–533. PMC 219154
 . PMID 4019408
. PMID 4019408
- ↑ Tepper EZ, Shilnikova VK, Pereverzev, GI (1979). Workshop on Microbiology. M.: [s.n.] p. 216
- ↑ S.-S. Kung, Y.-C. Chuang, C.-H. Chen e C.-C. Chien (2007). «Isolation of polyhydroxyalkanoates-producing bacteria using a combination of phenotypic and genotypic approach». doi:10.1111/j.1472-765X.2006.02090.x
- ↑ T.V. Ojumu, J. Yu, e B.O. Solomon (2004). «Production of Polyhydroxyalkanoates, a bacterial biodegradable polymer». African Journal of Biotechnology. 3
- ↑ Shivprasad S., Page W. J. (1989). «Catechol Formation and Melanization by Na+ -Dependent Azotobacter chroococcum: a Protective Mechanism for Aeroadaptation?». Applied and Environmental Microbiology. 55 (7): 1811–1817. PMC 202955
 . PMID 16347974
. PMID 16347974
- ↑ Jensen H. L. (1954). «The Azotobacteriaceae». Bacteriological Reviews. 18 (4): 195–214. PMC 440985
 . PMID 13219046
. PMID 13219046
- ↑ Johnstone D. B. (1955). «Azotobacter Fluorescence». Journal of Bacteriology. 69 (4): 481–482. PMC 357568
 . PMID 14367310
. PMID 14367310
- ↑ Maldonado R., Jimenez J., Casadesus J. (1994). «Changes of Ploidy during the Azotobacter vinelandii Growth Cycle». Journal of Bacteriology. 176 (13): 3911–3919. PMC 205588
 . PMID 8021173
. PMID 8021173
- ↑ Maia M., Sanchez J. M., Vela G. R. (1988). «Plasmids of Azotobacter vinelandii». Journal of Bacteriology. 170 (4): 1984–1985. PMC 211066
 . PMID 3350795
. PMID 3350795
- ↑ Yamagata U., Itano A. (1923). «Physiological Study of Azotobacter chroococcum, beijerinckii and vinelandii types». Journal of Bacteriology. 8 (6): 521–531. PMC 379037
 . PMID 16559016
. PMID 16559016
- ↑ Boyd W. L., Boyd J. W. (1962). «Presence of Azotobacter species in Polar Regions». Journal of Bacteriology. 83 (2): 429–430. PMC 277747
 . PMID 16561931
. PMID 16561931
- ↑ Moreno J., Gonzalez-Lopez J., Vela G. R. (1986). «Survival of Azotobacter spp. in Dry Soils». Applied and Environmental Microbiology. 51 (1): 123–125. PMC 238827
 . PMID 16346962
. PMID 16346962
- ↑ Johnstone D. B. (1967). «Isolation of Azotobacter Insignis From Fresh Water». Ecology. 48 (4): 671–672. JSTOR 1936516. doi:10.2307/1936516
- ↑ Dicker H. J., Smith D. W. (1980). «Enumeration and Relative Importance of Acetylene-Reducing (Nitrogen-Fixing) Bacteria in a Delaware Salt Marsh». Applied and Environmental Microbiology. 39 (5): 1019–1025. PMC 291468
 . PMID 16345564
. PMID 16345564
- ↑ van Berkum P., Bohlool B. (1980). «Evaluation of Nitrogen Fixation by Bacteria in Association with Roots of Tropical Grasses». Microbiological Reviews. 44 (3): 491–517. PMC 373190
 . PMID 6775181
. PMID 6775181
- ↑ Zachmann J. E., Molina J. A. E. (1993). «Presence of Culturable Bacteria in Cocoons of the Earthworm Eisenia fetida». Applied and Environmental Microbiology. 59 (6): 1904–1910. PMC 182179
 . PMID 16348968
. PMID 16348968
- ↑ Kass D. L., Drosdoff M., Alexander M. (1971). «Nitrogen Fixation by Azotobacter paspali in Association with Bahiagrass (Paspalum notatum)». Soil Science Society of America Journal. 35 (35): 286–289. doi:10.2136/sssaj1971.03615995003500020031x
- ↑ Bürgmann H., Widmer F., Sigler W. V, Zeyer J. (2003). «mRNA Extraction and Reverse Transcription-PCR Protocol for Detection of nifH Gene Expression by Azotobacter vinelandii in Soil». Applied and Environmental Microbiology. 69 (4): 1928–1935. PMC 154784
 . PMID 12676666. doi:10.1128/AEM.69.4.1928-1935.2003
. PMID 12676666. doi:10.1128/AEM.69.4.1928-1935.2003
- ↑ Shank Yu, Demin O., Bogachev AV (2005). «Respiratory Protection nitrogenase complex in Azotobacter vinelandii» (PDF). Success Biological Chemistry (Sat). 45: 205–234. Consultado em 30 de Agosto de 2010. Arquivado do original (PDF) em 22 de Julho de 2011
- ↑ Maier R. J., Moshiri F. (2000). «Role of the Azotobacter vinelandii Nitrogenase-Protective Shethna Protein in Preventing Oxygen-Mediated Cell Death». Journal of Bacteriology. 182 (13): 3854–3857. PMC 94562
 . PMID 10851006. doi:10.1128/JB.182.13.3854-3857.2000
. PMID 10851006. doi:10.1128/JB.182.13.3854-3857.2000
- ↑ Durrant M. C., Francis A., Lowe D. J., Newton W. E., Fisher K. (2006). «Evidence for a dynamic role for homocitrate during nitrogen fixation: the effect of substitution at the α-Lys426 position in MoFe-protein of Azotobacter vinelandii». Biochemistry Journal. 397 (2): 261–270. PMC 1513279
 . PMID 16566750. doi:10.1042/BJ20060102
. PMID 16566750. doi:10.1042/BJ20060102
- ↑ Howard J. B., Rees D. C. (2006). «How many metals does it take to fix N2? A mechanistic overview of biological nitrogen fixation». Proceedings of the National Academy of Sciences of the United States of America. 103 (46): 17088–17093. PMC 1859894
 . PMID 17088547. doi:10.1073/pnas.0603978103
. PMID 17088547. doi:10.1073/pnas.0603978103
- ↑ Bellenger J. P., Wichard T., Kraepiel A. M. L. (2008). «Vanadium Requirements and Uptake Kinetics in the Dinitrogen-Fixing Bacterium Azotobacter vinelandii». Applied and Environmental Microbiology. 74 (5): 1478–1484. PMC 2258613
 . PMID 18192412. doi:10.1128/AEM.02236-07
. PMID 18192412. doi:10.1128/AEM.02236-07
- ↑ Rüttimann-Johnson C., Rubio L. M., Dean D. R., Ludden P. W. (2003). «VnfY Is Required for Full Activity of the Vanadium-Containing Dinitrogenase in Azotobacter vinelandii». Journal of Bacteriology. 185 (7): 2383–2386. PMC 151482
 . PMID 12644512. doi:10.1128/JB.185.7.2383-2386.2003
. PMID 12644512. doi:10.1128/JB.185.7.2383-2386.2003
- ↑ Robson R. L., Eady R. R., Richardson T. H., Miller R. W., Hawkins M., Postgate J. R. (1986). «The alternative nitrogenase of Azotobacter chroococcum is a vanadium enzyme». Nature. 322 (6077): 388–390. doi:10.1038/322388a0
- ↑ Miller R. W., Eady R. R. (1988). «Molybdenum and vanadium nitrogenases of Azotobacter chroococcum. Low temperature favours N2 reduction by vanadium nitrogenase». Biochemistry Journal. 256 (2): 429–432. PMC 1135427
 . PMID 3223922
. PMID 3223922
- ↑ Hu Y., Fay A. W., Lee C. C., Ribbe M. W. (2007). «P-cluster maturation on nitrogenase MoFe protein». Proceedings of the National Academy of Sciences of the United States of America. 104 (25): 10424–10429. PMC 1965529
 . PMID 17563349. doi:10.1073/pnas.0704297104
. PMID 17563349. doi:10.1073/pnas.0704297104
- ↑ Curatti L., Brown C. S., Ludden P. W., Rubio L. M. (2005). «Genes required for rapid expression of nitrogenase activity in Azotobacter vinelandii». Proceedings of the National Academy of Sciences of the United States of America. 102 (18): 6291–6296. PMC 1088376
 . PMID 15845763. doi:10.1073/pnas.0501216102
. PMID 15845763. doi:10.1073/pnas.0501216102
- ↑ Hill S., Austin S., Eydmann T., Jones T., Dixon R. (1996). «Azotobacter vinelandii NIFL is a flavoprotein that modulates transcriptional activation of nitrogen-fixation genes via a redox-sensitive switch». Proceedings of the National Academy of Sciences of the United States of America. 93 (5): 2143–2148. PMC 39924
 . PMID 8700899. doi:10.1073/pnas.93.5.2143
. PMID 8700899. doi:10.1073/pnas.93.5.2143
- ↑ Money T., Barrett J., Dixon R., Austin S. (2001). «Protein-Protein Interactions in the Complex between the Enhancer Binding Protein NIFA and the Sensor NIFL from Azotobacter vinelandii». Journal of Bacteriology. 183 (4): 1359–1368. PMC 95010
 . PMID 11157949. doi:10.1128/JB.183.4.1359-1368.2001
. PMID 11157949. doi:10.1128/JB.183.4.1359-1368.2001
- ↑ Ahmad F., Ahmad I., Khan M. S. (2005). «Indole Acetic Acid Production by the Indigenous Isolates of Azotobacter and Fluorescent Pseudomonas in the Presence and Absence of Tryptophan» (PDF). Turkish Journal of Biology (29): 29–34
- ↑ Oblisami G., Santhanakrishan P., Pappiah C. M., Shabnugavelu K. G. «Effect of Azotobacter Inoculant And Growth Regulators on the Growth of Cashew». Acta Horticulturae (ISHS) (108): 44–49
- ↑ Rajaee S., Alikhani H. A., Raiesi F. (2007). «Effect of Plant Growth Promoting Potentials of Azotobacter chroococcum Native Strains on Growth, Yield and Uptake of Nutrients in Wheat». Journal of Science and Technology of Agriculture and Natural Resources. 11 (41): 297 PDF copy
- ↑ Chen J. H., Czajka D. R., Lion L. W., Shuler M. L., Ghiorse W. C. (1995). «Trace metal mobilization in soil by bacterial polymers». Environmental Health Perspectives. 103 (1): 53–58. JSTOR 3432013. PMC 1519318
 . PMID 7621800. doi:10.2307/3432013
. PMID 7621800. doi:10.2307/3432013
- ↑ Li D. Y., Eberspächer J., Wagner B., Kuntzer J., Lingens F. (1991). «Degradation of 2,4,6-trichlorophenol by Azotobacter sp. strain GP1». Applied and Environmental Microbiology. 57 (7): 1920–1928. PMC 183500
 . PMID 1892382
. PMID 1892382
- ↑ Neeru Narula, ed. (2000). Azotobacter in Sustainable Agriculture. [S.l.]: New Delhi. ISBN 81-239-0661-7
- ↑ Galindo E., Peña C., Núñez C., Segura D., Espín G. (2007). «Molecular and bioengineering strategies to improve alginate and polydydroxyalkanoate production by Azotobacter vinelandii». Microbial Cell Factories. 6 (7). 7 páginas. PMC 1805506
 . PMID 17306024. doi:10.1186/1475-2859-6-7
. PMID 17306024. doi:10.1186/1475-2859-6-7
- ↑ Page W. J., Tindale A., Chandra M., Kwon E. (2001). «Alginate formation in Azotobacter vinelandii UWD during stationary phase and the turnover of poly-ß-hydroxybutyrate». Microbiology. 147 (Pt 2): 483–490. PMID 11158365
- ↑ Ahmed M., Ahmed N. (2007). «Genetics of Bacterial Alginate: Alginate Genes Distribution, Organization and Biosynthesis in Bacteria». Current Genomics. 8 (3): 191–202. PMC 2435354
 . PMID 18645604. doi:10.2174/138920207780833810
. PMID 18645604. doi:10.2174/138920207780833810
- ↑ Hans Günter Schlegel, C. Zaborosch, M. Kogut (1993). General microbiology. [S.l.]: Cambridge University Press. p. 380. ISBN 0-521-43980-9
- ↑ Emtiazia G., Ethemadifara Z., Habibib M. H. (2004). «Production of extra-cellular polymer in Azotobacter and biosorption of metal by exopolymer» (PDF). African Journal of Biotechnology. 3 (6): 330–333
- ↑ Beijerinck M. W. (1901). «Ueber Oligonitrophile Mikroben». Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten und Hygiene. Abteilung II (em alemão) (7): 561–582
- ↑ Page W. J., Shivprasad S. (1991). «Azotobacter salinestris sp. nov., a sodium-dependent, microaerophilic, and aeroadaptive nitrogen-fixing bacterium». International Journal of Systematic Bacteriology. 41 (3): 369–376. doi:10.1099/00207713-41-3-369[ligação inativa]
- ↑ Rediers H., Vanderleyden J., De Mot R. (2004). «Azotobacter vinelandii: a Pseudomonas in disguise?». Microbiology. 150 (Pt 5): 1117–1119. PMID 15133068. doi:10.1099/mic.0.27096-0
- ↑ Young J. M., Park D.-C. (2007). «Probable synonymy of the nitrogen-fixing genus Azotobacter and the genus Pseudomonas». International Journal of Systematic and Evolutionary Microbiology. 57 (Pt 12): 2894–2901. PMID 18048745. doi:10.1099/ijs.0.64969-0
Ligações externas
[editar | editar código-fonte]- «Azotobacter» (em inglês). MicrobeWiki
- «Azotobacter Beijerinck 1901» (em inglês). Lista de nomes de Procariontes
- «Azotobacter.org» (em inglês). Um projeto que estuda o o genoma de Azotobacter vinelandii
- Amy Crum. «Azotbacter». SOIL MICROBIOLOGY BIOL/CSES 4684. Consultado em 30 de Agosto de 2010. Arquivado do original em 23 de Janeiro de 2012
- «Azotobacter vinelandii». John Innes Centre – Molecular Microbiology Department
- «Azotobacter vinelandii». JGI
- Iwao WATANABE (JICA/Cantho Univ. Expert Mar–Apr. 2000). (30 de março de 2000). «Biological Nitrogen Fixation and its Use in Agriculture». Lecture in Cantho University, Vietnam
- «Azotobacter». Microbiology Video Library. MicrobiologyBytes. Consultado em 30 de Agosto de 2010. Arquivado do original em 20 de Agosto de 2011