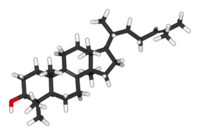
Lanosterol
Aspeto
| Lanosterol Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Nome IUPAC | lanosta-8,24-dien-3-ol |
| Identificadores | |
| Número CAS | |
| MeSH | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C30H50O |
| Massa molar | 426.70 g/mol |
| Ponto de fusão |
138-140 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O lanosterol é um triterpenóide tetracíclico. É o composto a partir do qual todos os esteróides são derivados.Em 2015 um estudo divulgado na revista nature mostrou que este tipo de esteroide é capaz de derreter cataratas e impedir o desenvolvimento desta quando administrado regularmente em pacientes por meio de um colírio desenvolvido.[1][2][3]
Papel na criação dos esteróides
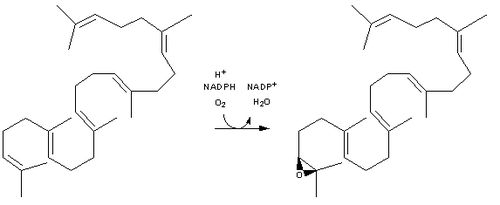
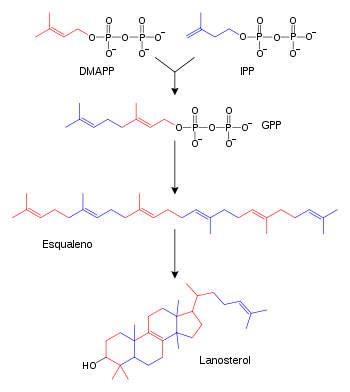
[editar | editar código-fonte]O lanosterol é bioquimicamente sintetizado a partir de farnesil pirofosfato. O passo crítico é a conversão enzimática do esqualeno (terpeno acíclico) em lanosterol (policíclico), via 2,3-oxidoesqualeno. Um processamento mais elaborado através de catálise enzimática, dá origem à estrutura base dos esteróides. A 14-demetilação do lanosterol pelo citocromo P450 dá origem ao colesterol.
Biossíntese
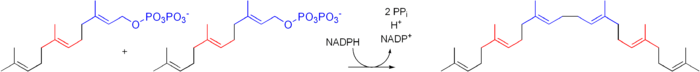
[editar | editar código-fonte]- Duas moléculas de farnesil pirofosfato condensam-se, com redução do NADPH, dando origem ao esqualeno - pela enzima esqualeno sintase;
- O esqualeno é reduzido pelo NADPH em 2,3-oxidoesqualeno - pela enzima esqualeno monooxigenase;
- O 2,3-oxidoesqualeno é convertido num anião proesterol e finalmente convertido em lanosterol, catalisado pela enzima lanosterol sintase:
Ver também
[editar | editar código-fonte]Referências
- ↑ «Colírio contra catarata | G1 - Ciência e Saúde - Espiral». Espiral
- ↑ Zhao, Ling; Chen, Xiang-Jun; Zhu, Jie; Xi, Yi-Bo; Yang, Xu; Hu, Li-Dan; Ouyang, Hong; Patel, Sherrina H.; Jin, Xin (julho de 2015). «Lanosterol reverses protein aggregation in cataracts». Nature (em inglês). 523 (7562): 607–611. ISSN 0028-0836. doi:10.1038/nature14650
- ↑ Zhao, Ling; Chen, Xiang-Jun; Zhu, Jie; Xi, Yi-Bo; Yang, Xu; Hu, Li-Dan; Ouyang, Hong; Patel, Sherrina H.; Jin, Xin (30 de julho de 2015). «Lanosterol reverses protein aggregation in cataracts». Nature. 523 (7562): 607–611. ISSN 1476-4687. PMID 26200341. doi:10.1038/nature14650
- E. J. Corey, W. E. Russey, P. R. Ortiz de Montellano (1966). «2,3-Oxidosqualene, an Intermediate in the Biological Synthesis of Sterols from Squalene». Journal of the American Chemical Society. 88 (20): 4750 - 4751. doi:10.1021/ja00972a056
- I. Abe, M. Rohmer, G. D. Prestwich (1993). «Enzymatic cyclization of squalene and oxidosqualene to sterols and triterpenes». Chemical Reviews. 93 (6): 2189 - 2206. doi:10.1021/cr00022a009