Vanadato

Em química, umvanadatoé umcomplexo de coordenaçãoaniônicodevanádio.Frequentemente, vanadato se refere aoxoânionsdevanádio,a maioria dos quais existe em seuestado de oxidaçãomais alto de +5. Um íon vanadato simples é o ânion ortovanadato tetraédrico, VO3–
4
(que também é chamado de vanadato (V)), que está presente, por exemplo, noortovanadato de sódioe em soluções deV
2O
5embase forte(pH> 13[1]). Convencionalmente, esseíoné representado com uma únicaligação dupla;no entanto, esta é uma forma deressonância,pois o íon é um tetraedro regular com quatro átomos de oxigênio equivalentes.
Além disso, existe uma gama de íons polioxovanadatos que incluem íons discretos e íonspoliméricos"infinitos".[2]Existem também vanadatos, como o vanadato deródio,RhVO
4,que tem uma estrutura estatística derutiloonde os íons Rh3+e V5+ocupam aleatoriamente as posições Ti4+na rede de rutilo,[3]que não contêm uma rede decátionseânionsvanadatos de equilíbrio, mas sãoóxidosmistos.
Exemplos de íons oxovanadato
[editar|editar código-fonte]
O elemento vanádio é conhecido por formar uma rica química de oxoânions em estado sólido e em solução, formando desde oxoânions simples atépolioxometalatoscom estruturas complexas. Alguns exemplos incluem:
- VO3–
4,o íon simples ortovanadato tetraédrico, análogo aofosfato;[4] - V
2O4–
7,íon divanadato ou pirovanadato, análogo aopirofosfatoedicromato.É composto por dois tetraedros VO
4compartilhando um vértice;[5] - V
3O3–
9,um anel de seis membros de tetraedros VO
4compartilhando 2 vértices;[6] - V
4O4–
12,um anel de oito membros.[7] - V
5O3–
14,anel bicíclico de tetraedros VO
4compartilhando 2 ou 3 vértices.[8] - V
6O6–
18,anel de 12 membros.[9] - V
10O6–
28,decavanadato, um polioxometalato com estrutura complexa formado por octaedros VO
6compartilhando arestas e vértices.[10] - V
12O4–
32,um polioxometalato formado por octaedros fundidos. - V
13O3–
34,polioxometalato formado por octaedros fundidos. - V
18O12–
42,polioxometalato formado por octaedros fundidos.
Há também espécies poliméricas de vanadatos:
- (VO–
3)n,íon metavanadato, formado por uma cadeia “infinita” de tetraedros VO
4encadeados, compartilhando dois vértices.[11] - (V
3O–
8)n,um polímero baseado no ânion V
3O3–
9[12]
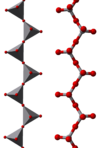 |
 |
 |
Cadeia polimérica do íon metavanadato, VO–
3 |
V
5O3– 14 |
Íon decavanadato, V
10O6– 28 |
Nestes íons, o vanádio exibecoordenação tetraédrica,piramidal quadrada eoctaédrica.Neste aspecto, o vanádio mostra similaridades com otungstatoe omolibdato,enquanto ocromo,no entanto, tem uma gama mais limitada de íons.
Síntese
[editar|editar código-fonte]

Sais de vanadato podem ser produzidos a partir da reação dopentóxido de vanádiocom umabase.[13]V
2O
5é umóxidoanfótero(embora seja preponderantementeácido), dissolvendo-se tanto em soluções de ácidos quanto de bases.[14]Em meio básico forte, o V
2O
5laranja se dissolve dando uma solução de ortovanadato incolor:
- V
2O
5+ 6NaOH —> Na
3VO
4+ 3H
2O
Ortovanadato também pode ser obtidos a partir da reação de sais catiônicos de vanádio +5 com bases fortes:
- VOCl
3+ 6NaOH —> Na
3VO
4+ 3NaCl + 3H
2O - VO+
2NO–
3+ 4KOH —> K
3VO
4+ KNO
3+ 2H
2O
Também podem ser formados pelo tratamento de um composto de vanádio em estado de oxidação mais baixo com umoxidanteadequado em meio básico:
- 2VO2+SO2–
4+ 12NaOH + Cl
2—> 2Na
3VO
4+ 2Na
2SO
4+ 2NaCl + 2H
2O
- 2VCl
3+ 12KOH + O
2—> 2K
3VO
4+ 6KCl + 6H
2O
Vanadatos de estruturas mais complexas podem ser obtidos a partir da acidulação cuidadosa de soluções de ortovanadato. O homopoliânion decavanadato, V
10O6–
28,um ânion distinto por sua cor laranja intensa em solução,[15]é um dos polivanadatos mais estáveis em soluções aquosas.[16]
- 10VO3–
4+ 24H+—> [V
10O
28]6–+ 12H
2O
O íon decavanadato também pode ser produzido tratando-se V
2O
5com solução deamôniae deixando a solução em repouso por algumas horas. A solução a princípio incolor torna-se laranja devido à presença do sal decavanadato de amônio.[carece de fontes]
- 5V
2O
5+ 6NH
4OH —> (NH
4)
6[V
10O
28] + 3H
2O
Reações
[editar|editar código-fonte]
Quando tratados com ácidos fortes, os vanadatos são protonados e precipitam na forma de flocos de pentóxido de vanádio hidratado alaranjado por volta do pH 2. Em pH mais baixo, o precipitado redissolve com a formação de sais depervanadila.
- 2VO3–
4+ 6H+—> V
2O
5+ 3H
2O - V
2O
5+ 2H+—> 2VO+
2+ H
2O
O tratamento cuidadoso de soluções de ortovanadato com ácido produz polivanadatos de estruturas mais complexas,[17] como os metavanadatos poliméricos e os decavanadatos:
- nNa
3VO
4+ 2nH+—>nNaH
2VO
4+ 2nNa+—> (NaVO
3)n+ 2nNa++nH
2O
- 10VO3–
4+ 24H+—> [V
10O
28]6–+ 12H
2O
Os vanadatos reagem com operóxido de hidrogênioformando uma solução amarela contendo operoxocomplexoaniônico tetraperoxovanadato(V). O tratamento dessa solução com ácidos leva a um produto de cor vermelha, o qual é um peroxocomplexo catiônico.
- Na
3VO
4+ 4H
2O
2—> Na
3[V(O
2)
4] + 4H
2O - Na
3[V(O
2)
4] + 4HCl + 4H
2O —> [VO(O
2)(H
2O)
3]Cl + 3NaCl + 3H
2O
2
Hipovanadatos
[editar|editar código-fonte]Hipovanadatos, algumas vezes chamados vanaditos, são ânions oxigenados de vanádio em seu estado de oxidação +4, diferente dos vanadatos que são oxoânions de vanádio no estado +5. São formados quando o dióxido de vanádio (VO
2) ou algum sal de vanádio tetravalente são tratados com bases fortes.[18]Hipovanadatos são ânions de cor marrom-amarelada e fortemente redutores, sendo facilmente oxidados pelo ar para vanadatos.
Quando compostos de vanádio (IV) são tratados com soluções moderadamente básicas, o ânion tetramérico V
4O2–
9é formado:
- 4VO
2+ 2NaOH —> Na
2[V
4O
9] + H
2O
- 4VO2++ 10NaOH —> Na
2[V
4O
9] + 5H
2O
Em pH básico muito forte, por volta de 13 a 14, o ânion simples tetraédrico orto-hipovanadato é formado:
- VO
2+ 4OH–—> VO4–
4+ 2H
2O
Pervanadatos
[editar|editar código-fonte]Quando soluções básicas de vanadatos são tratadas com peróxido de hidrogênio, sais do complexo peróxido aniônicoperoxovanadato(V)de cor amarela intensa[19][V(O
2)
4]3–(também conhecido comopervanadato) são formados. Esseperoxocomplexolentamente se decompõe em água para formar vanadato e gásoxigênio.
- Na
3VO
4+ 4H
2O
2—> Na
3[V(O
2)
4] + 4H
2O
Complexos não-oxoânions com o nome “vanadato”
[editar|editar código-fonte]Na nomenclatura da química de coordenação, quando o termo "vanadato" faz parte do nome do composto, isso indica que o mesmo contém um ânion complexo com umátomode vanádio central, não necessariamente ligado aooxigênioou no estado de oxidação +5. Por exemplo, o composto químico (NH
4)
3[VF
6], sem oxigênio e no estado +3, é nomeado comohexafluorovanadato(III) de amônio.
De forma semelhante, os complexos [V(CN)
6]3–e [VO(C
2O
4)
2]2–são chamados dehexacianovanadato(III)eoxobis(oxalato)vanadato(IV),respectivamente.
Soluções aquosas
[editar|editar código-fonte]A dissolução dopentóxido de vanádioem solução aquosa fortemente básica produz o íon incolor ortovanadato, VO3–
4.Na acidificação, a cor desta solução escurece gradualmente através do laranja para o vermelho em torno dopH7. O V
2O
5hidratado laranja-marrom precipita em torno do pH 2, redissolvendo-se em pH mais baixo para formar uma solução amarelo claro contendo o íonpervanadila,[VO
2(H
2O)
4]+.O número e a identidade dos oxoânions que existem entre pH 13 e 2 dependem do pH, bem como da concentração. Por exemplo, a protonação do vanadato inicia uma série de condensações para produzir íons polioxovanadato:[20]
- pH 9–12: HVO2–
4,V
2O4–
7 - pH 4–9: H
2VO–
4,V
4O4–
12,HV
10O5–
28 - pH 2–4: H
3VO
4,H
2V
10O4–
28
Aplicações
[editar|editar código-fonte]Alguns ortovanadatos têm sido utilizados por suas características ópticas e, em particular, luminescentes por um longo tempo, e estão presentes em aplicações importantes como fósforos,cintiladoresderaios Xeraios gama,materiais catodoluminescentes, termofósforos, materiais hospedeiros de laser e polarizadores ópticos.
O ortovanadato de ítrio, YVO
4,é um material muito utilizado em dispositivos ópticos. É um cristal incolor usado para fazerprismaspolarizadoreseficientes de alta potência, semelhantes aos prismas de Glan-Taylor.[21]Quando dopado comeurópio,é utilizado para produzir materiais fluorescentes emissores de luz vermelha, como os fosfóreos de monitores CRT.[22]Dopado comneodímio,é usado como um meiolaserativo usado em lasers de estado sólido bombeados pordiodo.[23]
O ortovanadato debismutoBiVO
4é um composto amarelo vivo que tem sido empregado na produção de pigmentos amarelos para tintas, em substituição ao altamente tóxicocromato de chumbo,anteriormente usado para esse fim. Esse composto também encontra uso como um fotocatalisador.[24]
Ocorrência natural
[editar|editar código-fonte]O íon ortovanadato é isoestrutural ao íon fosfato, e partilha com ele várias propriedades em comum.[25]De forma que esse íon pode substituir o fosfato em alguns de seus minerais (substituição isomórfica). Um importante mineral fonte de vanádio é avanadinita,um sal duplo de ortovanadato-cloretodechumboPb
5(VO
4)
3Cl. Outro mineral importante de vanadato é acarnotita,KUO
2VO
4• 3/
2H
2O, um importante minério deurânioe vanádio.
O vanádio é o segundometal de transiçãomais abundante em solução nas águas do mar aberto, perdendo em abundância apenas para omolibdênio.[26]Ele está presente principalmente na forma dos íonsvanadila(VO2+)[27]e dihidrogeno-ortovanadato (H
2VO–
4).[28]
Propriedades farmacológicas
[editar|editar código-fonte]O vanadato é um inibidor potente de certasATPasesdamembrana plasmática,como a Na+/K+-ATPase e a Ca2+-ATPase (PMCA). Atuando como um análogo deestado de transiçãodofosfato,o vanadato sofre ataquenucleofílicopela água durante a transferência de fosforila, essencialmente "aprisionando" as ATPases do tipo P em seu estado E2 fosforilado.[29][30]Ele também inibe a atividade daactomiosinaMgATPasedo músculo esquelético[31]e a geração de força ativada pelocálciopela actomiosina no aparelho contrátil do músculo esquelético intacto.[32]No entanto, ele não inibe outras ATPases, como a SERCA (Ca2+-ATPase doretículo sarco/endoplasmático) ou a ATPasemitocondrial.[33][34][35]
Referências
- ↑Predefinição:Cotton&Wilkinson6th
- ↑Verevkin, A.; Pearlman, A.; Slstrokysz, W.; Zhang, J.; Currie, M.; Korneev, A.; Chulkova, G.; Okunev, O.; Kouminov, P.; Smirnov, K.; Voronov, B.; N. Gol'tsman, G.; Sobolewski, Roman (2004). "Ultrafast superconducting single-photon detectors for near-infrared-wavelength quantum communications". Journal of Modern Optics 51 (12): 1447–1458. doi:10.1080/09500340410001670866.
- ↑Wells A.F. (1984)Structural Inorganic Chemistry5th edition Oxford Science PublicationsISBN0-19-855370-6
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑Hamilton EE; Fanwick PE; Wilker JJ (2002). "O elusivo vanadato (V 3 O 9 ) 3−: isolamento, estrutura cristalina e comportamento de solução não úmida". J. Sou. Soc. 124 (1): 78–82. doi: 10.1021/ja010820r. PMID11772064.
- ↑G.-Y. Yang, D.-W. Gao, Y. Chen, J.-Q. Xu, Q.-X. Zeng, H.-R. Sun, Z.-W. Pei, Q. Su, Y. Xing, Y.-H. Ling e H.-Q. Jia (1998). "[Ni( C10H8N2 ) 3 ] 2 [ V4O12 ] · 11H2O". Acta Crystallographica C. 54 ( 5): 616–618. Bibcode: 1998AcCrC..54..616Y. doi: 10.1107 / S0108270197018751.
- ↑VW Day; Walter G. Klemperer; OM Yaghi (1989). "Um novo tipo de estrutura na química de polioxoanions: síntese e estrutura do V 5O3-14 ânion". J. Am. Chem. Soc. 111 (12): 4518. doi: 10.1021/ja00194a068.
- ↑Guang-Chuan Ou.; Tong-Bu Lu (2009). "Complexos de metais macrocíclicos com pontes de polioxoânion de vanádio: de estruturas unidimensionais a tridimensionais". Dalton Transactions. 1 (1): 71–76. doi: 10.1039/B810802A.PMID 19081973.S2CID 35209358.
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑ Fechar [ 10 ] Jouanneau, S.; Guyomard, D. (2003). "Sobre um novo vanadato de cálcio: síntese, estrutura e comportamento de inserção de Li". Journal of Solid State Chemistry. 172 (1): 116–122. Bibcode: 2003JSSCh.172..116J. doi: 10.1016/S0022-4596(02)00164-0.
- ↑Greenwood, Norman N.; Earnshaw, Alan (1984). Química dos Elementos. Oxford: Pergamon Press. pp. 1140, 1144.ISBN 978-0-08-022057-4..
- ↑https://chemistry.stackexchange /questions/181700/amphoteric-character-of-v2o5
- ↑Johnson, G.; Murmann, R. K.; Deavin, R.; Griffith, W. P. (2007). «Sodium and Ammonium Decavanadates». Inorganic Syntheses. 19: 140–145. doi:10.1002/9780470132500.ch32
- ↑Tracey, AS; Crans, DC (1998). Compostos de vanádio. Washington DC: Sociedade Química Americana.ISBN 0-8412-3589-9.
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑https:// britannica /science/vanadium-oxide
- ↑https://inis.iaea.org/search/search.aspx?orig_q=RN:19007747
- ↑Greenwood, Norman N.; Earnshaw, Alan (1997). Química dos Elementos (2ª ed.). Butterworth-Heinemann.ISBN 978-0-08-037941-8.
- ↑patent
- ↑Caro, Paul (1 de junho de 1998).«Rare earths in luminescence».Rare earths.[S.l.]: Editorial Complutense. pp. 323–325.ISBN978-84-89784-33-8
- ↑Koechner, Walter (2006).«Nd:YVO4».Solid-state laser engineering.[S.l.]: Springer. 69 páginas.ISBN978-0-387-29094-2
- ↑https:// chembk /en/chem/Bismuth%20orthovanadate
- ↑https:// sciencedirect /science/article/pii/S0021925819811894
- ↑https:// sciencedirect /science/article/pii/S0021925819811894
- ↑Rehder, Dieter (2008). Química bioinorgânica do vanádio. Química inorgânica (1ª ed.). Hamburgo, Alemanha: John Wiley & Sons, Ltd. pp. 5 e 9–10. doi: 10.1002/9780470994429.ISBN 9780470065099.
- ↑https:// sciencedirect /science/article/abs/pii/S0020169316309409
- ↑Kühlbrandt, Werner (April 2004). «Biology, structure and mechanism of P-type ATPases».Nature Reviews. Molecular Cell Biology.5(4): 282–295.ISSN1471-0072.PMID15071553.doi:10.1038/nrm1354Verifique data em:
|data=(ajuda) - ↑Davies, Douglas R.; Hol, Wim G.J. (19 de novembro de 2004). «The power of vanadate in crystallographic investigations of phosphoryl transfer enzymes».FEBS Letters(em inglês).577(3): 315–321.ISSN0014-5793.PMID15556602.doi:10.1016/j.febslet.2004.10.022

- ↑Goodno, C.C.; Taylor, E.W. (1982).«Inhibition of actomyosin ATPase by vanadate».Proceedings of the National Academy of Sciences USA.79(1): 21–25.Bibcode:1982PNAS...79...21G.PMC345653
 .PMID6459580.doi:10.1073/pnas.79.1.21
.PMID6459580.doi:10.1073/pnas.79.1.21
- ↑Wilson, G.J.; Shull, S.E.; Cooke, R. (1995).«Inhibition of muscle force by vanadate».Biophysical Journal.68(1): 216–226.Bibcode:1995BpJ....68..216W.PMC1281679
 .PMID7711244.doi:10.1016/S0006-3495(95)80177-3
.PMID7711244.doi:10.1016/S0006-3495(95)80177-3
- ↑Luo D.; Nakazawa M.; Yoshida Y.; Cai J.; Imai S. (2000). «Effects of three different Ca2+pump ATPase inhibitors on evoked contractions in rabbit aorta and activities of Ca2+pump ATPases in porcine aorta».General Pharmacology: The Vascular System.34(3): 211–220.PMID11120383.doi:10.1016/S0306-3623(00)00064-1
- ↑Bowman B.J.; Slayman C.W. (1979). «The Effects of Vanadate on the Plasma Membrane ATPase of Neurospora crassa».Journal of Biological Chemistry.254(8): 2928–2934.PMID155060.doi:10.1016/S0021-9258(17)30163-1

- ↑Aureliano, Manuel; Crans, Debbie C. (2009).«Decavanadate (V10O6−
28) and oxovanadates: Oxometalates with many biological activities».Journal of Inorganic Biochemistry.103(4): 536–546.ISSN0162-0134.PMID19110314.doi:10.1016/j.jinorgbio.2008.11.010line feed character character in|title=at position 15 (ajuda)
