Alcool
| Deși acest articol conține o listă de referințe bibliografice,surselesale rămân neclare deoarece îi lipsescnotele de subsol. Puteți ajuta introducândcitări mai preciseale surselor. |

Închimia organică,unalcooleste uncompus organichidroxilic, care conține ogrupă funcționalăhidroxil(-OH), aceasta fiind legată de un atom de carbon saturat, în starea dehibridizaresp3.Grupahidroxilpoate fi legată de o catenă a unuialcan(catenă saturată), din partea saturată a catenei uneialchene,sau de catena laterală a unei hidrocarburi aromatice. Formula generală pentru un alcool simplu, aciclic, esteCnH2n+1OH.
În limbajul curent, termenul dealcoolse referă aproape întotdeauna laetanol,cunoscut și caalcool de cereale,și deseori la orice băutură care conține etanol (vezibăutură alcoolică). Acest sens stă la baza termenului dealcoolism(dependențăde alcool). Reținerea de a nu consuma alcool se numeșteabstinență,iar legea dinSUAdin anii 1900 de interzicere a consumului de alcool se numeaprohibiție.Camedicament,etanolul este cunoscut ca având un efect depresiv, care scade acuitatea reflexelorsistemului nervos central.Alte forme de alcool sunt de obicei denumite cu un adjectiv de rigoare, precumalcool izopropilicsau prin sufixul-ol,ca înizopropanol.
Cuvântul datează dinsecolul XVI,când a fost folosit pentru se denumi orice substanță la care se ajungea prinsublimare.Acesta derivă din termenul latin medievalalcool( "pudră destibiu"), originar dinarabăal-kuḥūl(كحول), care este de asemenea sursa termenuluikohlși legat de rădăcinak-ḥ-l,atestată în cuvântul arab pentrumachiaj.
Structură
[modificare|modificare sursă]
Grupa funcționalăa unui alcool estegrupa hidroxillegată de un atom decarbonhibridizatsp3.Astfel se poate spune că alcoolii sunt derivați aiapei,cu o gruparealchilînlocuind un hidrogen. Dacă o gruparearileste prezentă în locul uneia alchil, compusul se numeștefenol.De asemenea, dacă grupa hidroxil este legată de un carbonhibridizatsp2dintr-o grupă alchenil, compusul se numeșteenol.Oxigenul dintr-un alcool face un unghi de aproximativ 109° (c.f. 104,5° în apă) și două perechi de electroni libere. Legătura O-H din metanol (CH3OH) are o lungime de aproximativ 96 picometri.
Alcooli primari, secundari și terțiari
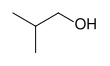
[modificare|modificare sursă]Există trei mari categorii de alcooli- 'primari' (1°), 'secundari' (2°) și 'terțiari' (3°), bazate pe numărul de atomi de carbon de care este legat carbonul C-OH (evidențiat cu roșu).Metanoluleste singurul alcool "nular", cel mai simplu alcool primar fiind Etanolul. Cel mai simplu alcool secundar esteizopropanol(propan-2-ol) și cel mai simplu alcool terțiar esteterț-butanol(2-metilpropan-2-ol).
Alcooli saturați, nesaturați și aromatici
[modificare|modificare sursă]După natura radicalilor de care se leagă grupa funcțională hidroxil, alcooli pot fi saturați (proveniți de la alcani), nesaturați (proveniți de la alchene sau alchine) sau aromatici (proveniți de la arene).

| ||
| Alcool normal butilic | Alcool alilic | Alcool benzilic |
Monoalcooli și polialcooli
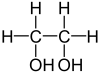
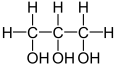
[modificare|modificare sursă]Alcoolii se mai pot clasifica și după numărul de grupe hidroxil conținute în moleculă. Astfel, există monoalcooli, cu o singură grupă hidroxil (toți cei prezentați mai sus sunt monoalcooli), și polialcooli, cu mai mult de o grupă hidroxil.
|
|
| Etandiol (1,2 dihidroxoetan) | 1,2,3 Propantriol |
Metanol și etanol
[modificare|modificare sursă]Cei mai simpli și cei mai folosiți alcooli suntmetanolulșietanolul(numele comune sunt alcoolmetilicși alcooletilic), care au structurile de mai sus.
Metanolul se obținea în trecut prin distilarea lemnului, de aceea se numea „alcool de lemn ". În prezent, este o substanță chimică la îndemâna oricui, care se produce prin reacția la presiune a monoxidului de carbon cu hidrogenul. În limbajul colocvial, termenul de „alcool" denumește deseori etanolul sau „alcool de cereale ".Spirtul metilat,numit și "spirt medicinal", este o formă de etanol devenit necomestibil prin adăugarea de metanol șicoloranțide regulăalbastru de metil.Pe lângă utilizarea principală în băuturile alcoolice, etanolul este folosit (deși foarte bine controlat) drept solvent industrial și materie primă.
Utilizări
[modificare|modificare sursă]Alcoolii sunt folosiți la scară largă în industrie și știință, drept reactanți,solvențicombustibili. Etanolul și metanolul pot arde creând mai puține substanțe nocive decâtbenzinasaumotorina.Datorită toxicității scăzute și capacității de a dizolva substanțe nepolare, etanolul este folosit deseori ca solvent în medicamente,parfumuriși esențe vegetale, precumvanilia.Însinteza organică,alcoolii apar deseori ca intermediari adaptabili.
Etanolul este, de asemenea, folosit frecvent în băuturi după fermentație pentru a evidenția aromele sau pentru a induce intoxicarea euforică numită "beție". Utilizarea etanolului pentru acest scop este interzisă în unele jurisdicții. În asemenea cazuri de consum, alcoolul este un drog psihoactiv, cu un potențial imediat de supradoză, otrăvire și dependență fiziologică (știută caalcoolism). Alcoolismul a devenit una dintre cele mai comune cauze de dependență (poate dupăcofeină) din lume. Dependența fiziologică cauzată de alcoolism înseamnă că persoana dependentă trece prinsevraj(sub forma unei dureri de cap cunoscută ca "mahmureală,"unei anxietăți crescute, știută ca" friguri "și oboseală sau probleme cu somnul) la încetarea sau descreșterea folosirii.
Surse
[modificare|modificare sursă]Mulți alcooli pot fi creați prinfermentațieafructelorsaucerealelorcudrojdie,dar doar etanolul este produs comercial în acest fel, în principal pentru combustibil și băuturi. Alți alcooli sunt în general produși pe cale sintetică dingaze naturale,petrolsaucărbune,de exemplu prin hidratarea acidă aalchenelor.
Nomenclatură
[modificare|modificare sursă]Nume sistematice
[modificare|modificare sursă]În sistemulIUPAC,numele alcanului primește ca sufix "ol", ca, de exemplu, "metanol" și "etanol". Când este necesar, poziția grupei hidroxil este indicată prin plasarea unui număr între numele catenei și sufixul "ol":propan-1-olpentruCH3CH2CH2OH,propan-2-olpentruCH3CH(OH)CH3.Uneori, numărul de poziție este scris în fața denumirii: 1-propanol și 2-propanol. Dacă este prezent un grup de prioritate mai mare (precum oaldehidă,cetonăsauacid carboxilic), atunci este necesar să se specifice și poziția acestora. De exemplu, 1-hidroxi-2-propanonă pentruCH3COCH2OH.
Iată câteva exemple de alcooli simpli cu modele de denumire:
Numele comune ale alcoolilor apar de obicei prin preluarea numelui radicalului alchil de bază și adăugarea cuvântului „alcool ", de exemplumetilalcohol,etilalcool sauterț-butilalcool.Propilalcoolul poate fin-propil alcool sau isopropil alcool, depinzând de poziția la care este legat hidroxilul, respectiv carbonul 1 sau carbonul 2. Isopropil alcoolul este numit ocazional șisec-propil alcool.
După cum s-a menționat mai sus, alcoolii sunt clasificați ca fiind primari (1°), secundari (2°) sau terțiari (3°), iar numele comune arată acest lucru prin prefixul radicalului alchil. De exemplu,(CH3)3COHeste un alcool terțiar și este numit comunterț-butil alcool. Acesta s-ar numi 2-metilpropan-2-ol conform regulilor UICPA, indicând un lanț de propan ce are grupele metil și hidroxil legate de carbonul din mijloc (al doilea).
Un alcool cu două grupări hidroxil este în general numit "glicol", de exempluHO-CH2-CH2-OHesteetilen glicol.Numele UICPA este etan-1,2-diol, "diol" indicând cele două grupe hidroxil, iar 1,2 indicând pozițiile la care sunt legate ele. Glicolii geminali (care au hidroxilii legați la un același atom de carbon), precum etan-1,1-diol, sunt de obicei instabili. Pentru trei sau patru grupe, se folosesc sufixele "triol" și "tetraol".
Etimologie
[modificare|modificare sursă]Cuvântul „alcool "provine aproape sigur dinlimba arabă(prefixul „al- "fiind articolul hotărât arabic); în orice caz, originea precisă este nesigură. A fost introdus înEuropa,împreună cu artadistilăriiși cu substanța însăși, în aproximativsecolul XIIde către diferiți autori europeni care traduceau și popularizau descoperirilealchimiștilorislamici.
O teorie populară, găsită în multe dicționare, este că provine din الكحل =ALKHL=al-kuhul,la început acesta fiind numele unei pudre foarte fine desulfurădestibiuSb2S3folosită caantisepticși machiaj pentru ochi. Pudra este preparată prinsublimareaunui mineral natural, stibnit, într-un vas închis. Conform acestei teorii, înțelesul cuvântuluialkuhular fi fost extins mai întâi pentru substanțele distilate în general, iar apoi restrâns doar pentru etanol. Această etimologie circulă înAngliacel puțin din1672(DEO).
Oricum, această derivare nu este întru totul acceptată, deoarece cuvântul arabic curent pentru alcool, الكحول =ALKHWL=al???,nu derivă dinal-kuhul.Coranul,în versetele 37:47, folosește cuvântul الغول =ALGhWL=al-ghawl— însemnând "spirit" ( "ființă spirituală" ) sau "demon"— cu sensul de" lucrul care dă vinului tăria ". Cuvântulal-ghawla dus la apariția cuvântuluienglez"ghoul" (creatură imaginară care mănâncă persoane moarte; vampir), și numelesteleiAlgol.
Conform unei a doua teorii, etimologia populară și scrierea cuvântului „alcool "nu ar fi apărut datorită generalizării cuvântuluiALKHL,ci confuziei alchimiștilor și autorilor occidentali a cuvintelorALKHLșiALGhWL,care au fost într-adevăr traduse în multe feluri greșit.
Proprietăți fizice și chimice
[modificare|modificare sursă]Gruparea hidroxil face ca, în general, alcoolul să fie moleculă polară. Acele grupări pot formalegături de hidrogenuna cu alta și cu alți compuși. La alcooli există două posibilități de dizolvare: tendința grupei polare-OHde a îl face solubil în apă și cea a catenei laterale de a i se opune. De aceea, metanolul, etanolul și propanolul sunt solubile în apă deoarece influența grupării hidroxil este mai puternică decât cea a catenei.Butanolul,cu patru carboni în catenă, este moderat solubil datorită echilibrului dintre cele două tendințe. Alcoolii monohidroxilici cu cinci sau mai mulți carboni (pentanolsau mai mari) sunt insolubili în apă datorită dominării catenei laterale.
Datoritălegăturii de hidrogen,alcoolii tind să aibă puncte de fierbere mai ridicate față dehidrocarburișieteri.Toți alcoolii simpli sunt solubili în solvenți organici. Legăturile de hidrogen arată că alcoolii pot fi folosiți ca solvenți protici.
Orbitalul dielectronic al oxigenului hidroxilului formează alcoolii nucleofili.
Alcoolii, ca și apa, pot avea fie proprietăți acide, fie bazice la grupareaO-H.Cu unpKade în jur de 16-19, sunt ușor mai puțin acizi decâtapa,dar sunt capabili să reacționeze cu baze puternice precum hidrură de sodiu sau cu metale reactive precumsodiul.Sărurile care rezultă se numescalcoxizi,având formula generalăRO-M+.
Alcoolii legați de nuclee benzenice au o aciditate mai scăzută (un pKa în jur de 10). Grupările care iau electroni participă la creșterea acidității alcoolilor. De exemplu, para-nitro fenolul are un pKa de 7,15.
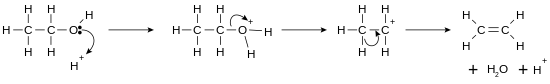
Oxigenul are un orbital dielectronic pe ultimul strat, ceea ce face alcoolul slab bazic în prezența unor acizi tari, precumacidul sulfuric.De exemplu, cu metanol:
Alcoolii pot fi de asemenea supuși oxidării pentru a formaaldehide,cetonesauacizi organici,sau pot fi deshidratați pentru a formaalchene.Pot reacționa pentru formarea deesteriși pot fi supuși (dacă sunt mai întâi activați) reacțiilor de substituție nucleofilă. Pentru mai multe detalii, vezi secțiunea#Reacții ale alcoolilor.
Toxicitate
[modificare|modificare sursă]Etanolula fost consumat de oameni încă din preistorie sub forma băuturilor alcoolice, pentru o varietate de motive: igienice, alimentare, medicinale, religioase, distractive. Deși consumul rar de etanol în cantități mici nu are efecte negative, ci dimpotrivă, dozele mai mari duc la starea numită "ebrietate" sau intoxicare și, depinzând de doză și de regularitatea consumului, poate cauza probleme respiratorii acute sau decesul, iar ingestia cronică are repercusiuni medicale grave.
Alți alcooli sunt mult mai otrăvitori decât etanolul, în mare parte pentru că durează mai mult până să fie metabolizați, iar nu de puține ori metabolismul lor duce la apariția unor substanțe mai toxice. Metanolul, saualcoolul de lemn,de exemplu, este oxidat de enzime înficatși duce la creareaformaldehidei,care poate cauza orbirea sau moartea.
Un tratament eficient pentru prevenirea toxicității cu formaldehidă după ingestia de metanol este administrarea de etanol. Aceasta va preveni transformarea metanolului în formaldehidă, iar formaldehida existentă va fi convertită înacid formicși eliminată prinexcrețieînainte de a provoca vreun rău.
Prepararea alcoolilor
[modificare|modificare sursă]Laborator
[modificare|modificare sursă]Există mai multe metode pentru prepararea alcoolilor în laborator.
- Compușii halogenați alifatici reacționează cu hidroxidul de sodiu sau hidroxid de potasiu, obținându-se astfel alcooli
- Aldehideelesaucetonelesunt reduse cuborohidrură de sodiusau hidroborat de litiu la alcooli.
- Alcheneleadiționează apa, într-un mediu acid, folosind drept catalizatoracid sulfuricconcentrat.
Formarea unui alcool secundar prin reducere și hidratare:

Industrie
[modificare|modificare sursă]Industrial, alcoolii se obțin în mai multe feluri.
- prinfermentațiefolosindglucozăprodusă de zahăr, obținând hidroliza amidonului, în prezența drojdiei și a unei temperaturi de sub 37 °C pentru producerea etanolului.
- Prin hidratare directă: folosindetenăsau altealchene,cu un catalizator de acid fosforic, la temperatură și presiune mari.
- Metanoluleste produs din vapori de apă: este creat din gaz sintetizat, unde monoxidul de carbon și doi echivalenți ai hidrogenului sunt combinați pentru producerea metanolului, folosind drept catalizatoricupru,oxid de zincșioxid de aluminiula 250 °C și o presiune de 50-100 atm.
Reacții ale alcoolilor
[modificare|modificare sursă]Deprotonare
[modificare|modificare sursă]Alcoolii se pot comporta ca acizi slabi, supuși deprotonării. Reacția de cedare a protonilor pentru a produce o sarealcoxidicăeste făcută fie cu o bază tare, precumhidrură de sodiusaun-butillitiu,fie cusodiusaupotasiu.
- 2 R-OH + 2Na→ 2R-O−Na+
- ex. 2CH3CH2-OH+ 2 Na → 2 CH3-CH2-O−Na+
Apa este similară înpKacu mulți alcooli, deci cuhidroxid de sodiuapare un echilibru de obicei deplasat spre stânga:
- R-OH +NaOHR-O-Na++ H2O (echilibru la stânga)
Totuși, trebuie observat că bazele folosite ladeprotonareaalcoolilor sunt tari. Bazele folosite și alcoxizii obținuți sunt reactanți chimici foarte sensibili la umezeală.
Substituție nucleofilă
[modificare|modificare sursă]GrupareaOHnu este o grupă care se desprinde ușor în reacțiile desubstituție nucleofilă,așa că alcooli neutri nu iau parte la aceste reacții. Totuși, dacă oxigenul este întâi protonat pentru a formaR−OH2+,gruparea care pleacă (apă) este mult mai stabilă, iar substituția poate avea loc. De exemplu, alcoolii terțiari reacționează cuacidul clorhidricpentru a produce halogenuri alchilice terțiare, unde gruparea hidroxil este înlocuită de un atom declor.Dacă se dorește ca un alcool primar sau secundar să reacționeze cu acidul clorhidric, este nevoie de un activator precum clorura de zinc. Alternativ, conversia poate fi făcută folosindclorură de tionil.
Alcoolii pot de asemenea fi convertiți în bromuri alchilice folosindacid hidrobromicsautribromură de fosfor,de exemplu:
- 3 R-OH + PBr3→ 3 RBr + H3PO3
Îndezoxigenarea Barton-McCombie,un alcool este dezoxigenat într-un alcan cu complex hibrid tributiltină sau trimetimboran într-o reacție de substituție a radicalului.
Deshidratare
[modificare|modificare sursă]Alcoolii sunt substanțenucleofile,deciR−OH2+poate reacționa cuROHpentru a produceeteriși apă într-o reacție de deshidratare, deși aceasta este rareori folosită, cu excepția fabricării dietil eterului.
Mai folositoare este reacția de eliminare a alcoolilor pentru a producealchene.Reacția urmeazăregula lui Zaițev,care spune că cea mai stabil alchenă se formează. Alcooli terțiari se transformă ușor la temperatura camerei, dar cei primari au nevoie de temperaturi mai ridicate.
Aceasta este o diagramă a deshidratării acide a etanolului pentru a produceetenă:
Esterificare
[modificare|modificare sursă]Pentru a formaesteridintr-un alcool și unacid carboxilic,reacția, numităesterificare Fischer,este de obicei realizată cu ajutorul unui catalizator deacid sulfuricconcentrat:
- R-OH + R'-COOHR'-COOR + H2O
Pentru ca echilibrul să fie deplasat la dreapta și să se obțină unrandamentmare de transformare în ester, apa este eliminată, fie printr-un exces deH2SO4,fie prin folosireaaparatului Dean-Stark.Esterii mai pot fi obținuți și prin reacția unui alcool cu oclorură acidăîn prezența unei baze precumpiridină.
Alte tipuri de esteri sunt preparați similar - de exemplu, esterii tosil (tosilați) sunt obținuți prin reacția unui alcool cu clorură de p-toluensulfonil în piridină.
Oxidare
[modificare|modificare sursă]Alcoolii primari se transformă de obicei înaldehidesauacizi carboxiliciprin oxidare organică, pe când alcoolii secundari se transformă încetone.În mod tradițional, se folosesc oxidanți puternici, precum ionul dicromat sau permanganatul de potasiu în mediu acid, de exemplu:
- 3CH3-CH(-OH)-CH3+K2Cr2O7+ 4H2SO4→ 3CH3-C(=O)-CH3+ Cr2(SO4)3+ K2SO4+ 7H2O
De multe ori în preparareaaldehideloracești reactanți reprezintă o problemă, deoarece supra-oxideazăacidul carboxilic.Pentru ca aceasta să se evite, alți reactanți sunt preferați, cum ar ficlorocromat de piridiniu,periodinan Dess-Martin,acid2-iodoxibenzoicsau metode precumoxidarea Swern.
Alcoolii terțiari rezistă oxidării, dar pot fi oxidați de reactanți precum 2,3-dicloro-5,6-diciano-1,4-benzoquinonă.
Vezi și
[modificare|modificare sursă]Bibliografie
[modificare|modificare sursă]- Sci-toys website explanation of denatured alcohol designations
- Ioniță,Curs de chimia compușilor organici cu funcțiuni simple.Universitatea din București,2008.
Legături externe
[modificare|modificare sursă]- enCe este alcoolul, până la urmă?Arhivatîn,laWayback Machine.Informații interesante despre alcooli.
| ||||||||||||||||||||