Carbon
| Carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Grafitul (stânga) și diamantul (dreapta), doi dintre cei mai cunoscuți alotropi ai carbonului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Liniile spectrale ale carbonului | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume,Simbol,Număr | Carbon, C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | nemetale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă,Perioadă,Bloc | 14, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 2267kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | negru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7440-44-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | 12,0107u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 70 (67)pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază de covalență | 77pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază van der Waals | 150pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | [He] 2s22p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronipenivelul de energie | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | -4, 0, +2, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | acid slab | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | hexagonală | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 3550°C;3823.15K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 4827°C; 5100.15K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de fuziune | n/akJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de evaporare | 355,8kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volum molar | 5,29×10-6m³/kmol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presiune de vapori | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 18.350m/sla 20°C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate(Pauling) | 2,55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldură specifică | 710J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate electrică | 61×103S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 129W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primaenergie de ionizare | 1086,5kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-aenergie de ionizare | 2352,6kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-aenergie de ionizare | 4620,5kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-aenergie de ionizare | 6222,7kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-aenergie de ionizare | 37.831,1kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-aenergie de ionizare | 47.277,0kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-aenergie de ionizare | {{{potențial_de_ionizare_7}}}kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-aenergie de ionizare | {{{potențial_de_ionizare_8}}}kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-aenergie de ionizare | {{{potențial_de_ionizare_9}}}kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-aenergie de ionizare | {{{potențial_de_ionizare_10}}}kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UnitățileSIși condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modificătext |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Carbonul(dinlatină:carbo,„cărbune” ) este unelement chimiccusimbolulCșinumărul atomic6. Este un elementnemetalictetravalent, ceea ce înseamnă că poate formalegături covalenteprin punerea în comun a patru electroni. În natură sunt răspândiți trei izotopi,12Cși13Cfiind stabili, iar14Ceste unizotop radioactivcu untimp de înjumătățirede aproximativ 5.730 de ani.[1]Carbonul este unul dintrepuținele elemente cunoscute din antichitate.[2]
Carbonul este al 15-lea cel mai abundent element din scoarța terestră, și al patrulea cel mai răspândit element din univers după masă, primele fiindhidrogenul,heliulșioxigenul.Răspândirea naturală mare a carbonului, diversitatea specifică acompușilorsăiorganiciși abilitatea sa unică de a formapolimerila temperaturi terestre i-au permis carbonului să fie elementul chimic comun allumii vii.Este al doilea cel mai abundent element dincorpul uman,după oxigen, reprezentând aproximativ 18,5% în procente de masă.[3]
Atomii de carbon se potlegaîntre ei în diferite moduri, formândalotropiicarbonului. Cele mai cunoscute exemple de alotropi suntgrafitul,diamantulșifulerenele.[4]Proprietățile fiziceale carbonului variază mult în funcție de aceste forme alotropice. De exemplu, grafitul este negru, moale și opac, în timp ce diamantul este transparent și extrem de dur (mai exact, cel mai dur material natural cunoscut). Grafitul este un bunconductor electric,în timp ce diamantul are oconductivitate electricăscăzută. În condiții normale de temperatură și presiune, diamantul, nanotuburile de carbon șigrafenulsunt materialele cu cea mai mare stabilitate termodinamică cunoscută. În aceste condiții, toți alotropii carbonului sunt materiale solide, grafitul fiind cel mai stabil termodinamic. Sunt puțin reactivi, de aceea au nevoie de temperatură ridicată chiar și pentru a reacționa cuoxigenul.
Cel mai întâlnitnumăr de oxidareal carbonul este +4 și se regăsește încompușii anorganici,în timp ce +2 se regăsește înmonoxidul de carbonși în complecșii carbonilici aimetalelor tranziționale.Cele mai mari surse naturale de carbon anorganic suntcalcarul,dolomitulșidioxidul de carbon,iar majoritatea carbonului se găsește în materiile organice, în depozitele decărbune,turbă,petrolșiclatrați de metan.Carbonul formează un număr mare decompuși chimici,mai mulți decât orice alt elemente, existând aproximativ zece milioane de compuși descriși până în prezent,[5]acest număr fiind mic în comparație cu numărul teoretic de compuși posibili pe care carbonul îi poate forma. Din acest motiv, carbonul a fost numit și „regele elementelor”.[6]
Istoric[modificare|modificare sursă]

Carbonul a fost descoperit încă dinPreistorieși a fost cunoscut în forma sa alotropică decărbuneîncă din cele mai îndepărtate timpuri, anume la începutul civilizațiilor umane. O altă formă a sa,diamantul,a fost cel mai probabil cunoscut începând cu anii 2500 î.Hr. înChina,în timp cecărbuneleera fabricat în perioada romană prin aceeași metodă folosită și în prezent.[7][8]
În1722,René-Antoine Ferchault de Réaumura demonstrat căfierulputea fi transformat înoțelprin absorbția unei anumite substanțe, iar ulterior s-a înțeles că aceasta era de fapt carbonul.[9]În1772,Antoine Lavoisiera arătat că diamantele reprezintă o formă rară de carbon; acesta a ars bucăți de cărbune și de diamant și a ajuns la concluzia că niciuna dintre ele nu a eliminat apă (deci nu conțineauhidrogen), însă ambele au eliminat aceeași cantitate dedioxid de carbonpergram. În1779,[10]Carl Wilhelm Scheelea demonstrat căgrafitul,despre care se credea că este o formă deplumb,era de fapt identic din punct de vedere chimic cu cărbunele, dar cu o mică cantitate defier,întrucât prin tratarea cu un amestec deacid azoticse obținea dioxid de carbon.[11]În1786,savanții franceziClaude Louis Berthollet,Gaspard Mongeși C. A. Vandermonde au confirmat faptul că grafitul era în majoritate alcătuit din carbon, oxidându-l cuoxigenprin aceeași metodă folosită mai devreme de Lavoisier pentru diamant.[12]De asemenea, în urma arderii a rămas un reziduu de fier, despre care savanții au crezut că era necesar pentru structura grafitului. În lucrarea publicată, aceștia au propus numele decarbon(latinăcarbonum) pentru elementul constituent al grafitului, care elimina gazul de dioxid de carbon prin încălzire. Ulterior, Antoine Lavoisier a introdus carbonul în lista deelemente chimiceîn cartea sa din 1789.[13] Oformă alotropicărelativ nouă a carbonului,fulerenele,a fost descoperită mai recent, în1985[14],și include forme nanostructurale precumBuckminsterfullereneleșinanotuburile de carbon.[15]Savanții care au descoperit fulerenele,Robert Curl,Harold KrotoșiRichard Smalley,au primitPremiul Nobel pentru Chimieîn anul1996.[16]Rezultatele au dus treptat la mărirea interesului legat de noile forme ale carbonului, iar recent au fost descoperiți alotropi „exotici”, precum carbonul sticlos saugrafenele.[17]
Etimologie[modificare|modificare sursă]
Denumirea decarbonprovine dintermenul francezcharbone,care, la rândul său, provine dinlatinesculcarbo,care înseamnăcărbune.[18]O adaptare interesantă pentru denumirea elementului este întâlnită înlimba germană,danezășiolandeză,undeKohlenstoff,kulstofșikoolstofînseamnă, literal, „substanță de cărbune”.
Structură atomică[modificare|modificare sursă]

Carbonul este cel de-al șaseleaelement chimicdinSistemul periodic al elementelor,și are în forma sa fundamentală următoareaconfigurație electronică:1s22s22p2.Se poate remarca faptul că cei patruelectronidin stratul 2 suntelectronii de valențăai elementului. Razele covalente ale carbonului sunt de obicei considerate a fi 77,2 pm (C–C), 66,7 pm (C=C) și respectiv 60,3 pm (C≡C), deși acestea pot varia în funcție de numărul de coordinare și de atomul de care se leagă carbonul. În general, raza covalentă descrește cu scăderea numărului de coordinare și cu creșterea ordinului de legătură.[19]
Prin apartenența sa la perioada a doua, carbonul este singurul element din grupa a 14-a care este capabil să fie hibridizat sp2și sp, dând naștere lalegături duble(sigma-pi) și lalegături triple(sigma-2pi), spre deosebire de restul elementelor din grupă. În combinațiile carbonului cu numărul de coordinare 4, cei patru orbitali din configurația fundamentală hibridizează, formând patru orbitali echivalenți sp3.[20]
Carbonul formează aproape în totalitate patru legături chimice cu alți atomi, în special încompușii organici,conferindu-i geometria specificătetraedrică,[21]totuși au fost întâlnite excepții. În2016,a fost confirmat faptul căhexametilbenzenulconține un atom de carbon ce formează șase legături, față de numărul obișnuit de patru.[22]
Proprietăți fizice[modificare|modificare sursă]
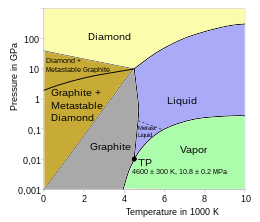
Printreformele alotropicediferite ale carbonului se numără una dintre cele mai moi substanțe cunoscute, anumegrafitul,și cea mai dură substanță întâlnită în natură, anumediamantul.Carbonul este un element remarcabil din mai multe motive, unul dintre acesta fiind capacitatea deosebită de a formalegături chimicecu alțiatomimici, incluzând atomii de carbon, iar mărimea sa îl face capabil de a formalegături covalentemultiple cu atomi multivalenți. Datorită acestor proprietăți, carbonul poate forma aproape zece milioane decompuși chimicidiferiți, majoritatea compușilor care există.[5]De asemenea, carbonul are cel mai marepunct de sublimaredintre toate elementele. Lapresiunea atmosferică,nu are niciunpunct de topire,iarpunctul triplueste la 10,8 ± 0,2 MPa și 4.600 ± 300 K (~4,330 °C),[23][24]așadar sublimează la aproximativ 3.900 K.[25][26]
Carbonul sublimează într-un arc de carbon ce are o temperatură de aproximativ 5.530 °C. Astfel, el rămâne solid la temperaturi mai înalte decât cele mai mari puncte de topire ale metalelor, precumwolframulsaureniul,indiferent de forma sa alotropică. Deși are din punct de vedere termodinamic o tendință de oxidare, carbonul rezistă la oxidare mai bine decât elemente precumfierulsaucuprul,care suntagenți reducătorimai slabi la temperatura camerei.
Valorile pentru primele patruenergii de ionizareale carbonului, 1086,5 kJ/mol, 2352,6 kJ/mol, 4620,5 kJ/mol și 6222,7 kJ/mol, sunt cu mult mai mari decât în cazul celorlalte elemente mai grele din grupa a 14-a.Electronegativitateacarbonului este 2,5, cu mult mai mare decât a elementelor mai grele din aceeași grupă, a căror electronegativitate variază între 1,8 și 1,9, dar destul de apropiată de cea anemetalelorvecine și de a unormetale tranziționaledin perioadele 5 și 6.
Cele mai reprezentative proprietăți fizice extreme ale formelor alotropice ale carbonului au fost aranjate în tabelul de mai jos:
| Grafitul este unul dintre cele mai moi materiale cunoscute. | Diamantul nanocristalin sinteticeste cel mai dur material cunoscut.[27] |
| Grafitul este unlubrifiantfoarte bun, fiind un superlubrifiant.[28] | Diamantul este unul dintre cele mai buneabrazive. |
| Grafitul este unconductoral electricității.[29] | Diamantul este unizolator electricexcelent.[30] |
| Unele forme de grafit sunt utilizate ca șiizolator termic,dar unele sunt conductori termici buni. | Diamantul este cel mai bun conductor termic întâlnit în natură. |
| Grafitul esteopac. | Diamantul este puternic transparent. |
| Grafitul cristalizează în sistemul hexagonal.[31] | Diamantul cristalizează în sistemul cubic. |
| Carbonulamorfeste completizotrop. | Nanotuburile de carbon sunt printre cele maianizotropemateriale cunoscute. |
Forme alotropice[modificare|modificare sursă]
Carbonulatomiceste o specie chimică cu o durată de viață foarte scurtă, de aceea carbonul, ca și element, se stabilizează prin intermediul unor structuri multi-atomice, cu diferite configurații moleculare, numitealotropisauforme alotrope.Cele mai cunoscute trei forme alotrope ale carbonului suntgrafitul,diamantulși carbonul amorf. Deși în trecut erau considerate forme exotice,fulerenelesunt în prezent sintetizate în mod comun și utilizate în cercetare; din această clasă fac partebuckminsterfullerenele,[15][32]nanotuburile de carbon,[33],carbon nanobuds („nano-muguri”)[34]și nanofibrele de carbon.[35][36]Alți câțiva alotropi au fost descoperiți, precum lonsdaleitul,[37]carbonul sticlos,[17]nanospuma de carbon[38]și carbonul acetilenic liniar, numit și carbină.[39]
Din2009,grafenelepar a fi cele mai dure sau puternice materiale testate vreodată.[40]Procedeul de separare al grafenei dingrafitnecesită o viitoare dezvoltare tehnologică, pentru a fi potrivit economic pentru procedee industriale.[41]Dacă cercetările vor fi de succes, grafenele ar putea fi utilizate pentru eventuala construcție a unuilift spațial.De asemenea, o altă utilizare a lor ar putea fi cea de rezervor pentru hidrogen în automobilele care au motoare pe bază de hidrogen.[42]

Forma amorfăa carbonului reprezintă o aranjare a atomilor de carbon într-o stare non-cristalină, neregulată, asemănătoaresticlei,care nu este susținută de o macrostructură cristalină. Are aspectul unei pudre și este constituentul primar al unor substanțe precum:mangalul,funinginea șicărbunele activ.În condiții normale de presiune, carbonul ia formagrafitului,în a cărui structură sunt întâlniți atomi legați între ei prin trei legături, cu o geometrie trigonală, într-un plan compus din nucleehexagonalefuzionate, asemănătoare ca formă cunucleele aromatice.[43]Rețeaua atomică rezultată este bidimensională, iar straturile sunt atașate unul deasupra celuilalt prin intermediulforțelor van der Waalsslabe. Această structură îi conferă grafitului proprietățile sale de a fi foarte moale și de aclivaușor (adică straturile bidimensionale se pot despica paralel cu rețeaua structurii). Datorită delocalizării unuia dintre electronii externi la fiecare atom din structură, ceea ce duce la formarea unui nor electronic de tip π, grafitul conduceelectricitatea,dar doar în planul fiecărui stratlegat covalent.Ca și rezultat,conductivitatea electricăa carbonului va fi mai mică decât cea a majoritățiimetalelor.Delocalizarea electronilor este de asemenea și motivul pentru stabilitatea energetică a grafitului, în comparație cu diamantul, la temperatura camerei.

a)diamant;b)grafit;c) lonsdaleit;
d–f)fulerenele(C60,C540,C70);
g) carbon amorf; h)nanotub de carbon.
La presiuni foarte mari, carbonul trece în forma sa alotropică mult mai compactă,diamantul,care are o densitate aproximativ de două ori mai mare decât grafitul. În cazul acestui alotrop, fiecare atom se leagă de alți patru atomi de carbon, ceea ce induce orientareatetraedricăa legăturilor, formându-se astfel o rețea tridimensională de nuclee atomice cu șase membri. Diamantul are structura cristalină cubică, aceeași cu asiliciuluișigermaniului,iar datorită puterii legăturilor carbon-carbon, este cea mai dură substanță întâlnită în natură, având maximul pescara de duritate Mohs.Deși se spune în popor că „diamantele sunt veșnice”, acestea sunt instabile termodinamic în condiții normale și se transformă astfel îngrafit.[4]Datorită unei energii de activare mari, tranziția spre starea de grafit este atât de înceată la temperaturi normale, încât nu poate fi observată. Sub unele condiții, carbonul cristalizează hexagonal sub formă delonsdaleit,în a cărui structură toți atomii sunt legați covalent, iar proprietățile sale sunt asemănătoare cu cele ale diamantului.[37]
Fulerenelesunt formațiuni cristaline sintetice cu o structură asemănătoare grafitului, dar în locul hexagonelor avempentagoane,sau câteodată și heptagoane de atomi de carbon. Atomii care lipsesc, sau care sunt în plus față de structura specifică grafenului, sunt motivul pentru care straturile iau forme desferă,elipsăsau chiarcilindru.Proprietățile fulerenelor nu au fost încă analizate în totalitate și reprezintă un domeniu de interes pentru cercetare în științananomaterialelor.Denumirile de „fulerenă” și de „buckminsterfulerenă” provin de la numele luiRichard Buckminster Fuller,savantul care a popularizat conceptul dedom geodezic,care din punct de vedere structural este similar fulerenelor. Buckminsterfulerenele au molecule relativ mari, formate în totalitate din atomi de carbon legați trigonal, cu formă desferoid.Cel mai simplu exemplu este fulerena C60,cu formă deminge de fotbal).[15]Nanotuburile de carbon sunt similare din punct de vedere structural cu fulerenele, exceptând faptul că fiecare atom este legat trigonal în cadrul unui strat curbat, care formează uncilindrugol la interior.[32][33]Un alotrop nou,carbon nanobuds(„nano-muguri”), a fost descoperit în2007și este un material hibrid între buckminsterfulenere și nanotuburile de carbon (fulerenele sunt legate covalent de partea externă a unui nanotub), care combină proprietățile ambilor alotropi într-o singură structură.[34]
Proprietăți chimice[modificare|modificare sursă]

Grafitul este mult mai reactiv decât diamantul, în condiții standard, în ciuda faptului că este mai stabil din punct de vedere termodinamic. Însă acesta este alcătuit dintr-un sistempi-delocalizat,cu atomii de carbon hibridizați sp2,ceea ce induce o anumită vulnerabilitate. De exemplu, grafitul poate fi oxidat deacidul azoticconcentrat la încălzire (acid azoticfumans), cu obținerea acidului melitic, C6(CO2H)6,un acid hexacarboxilic în a cărui structură sunt păstrate unitățile hexagonale ale grafitului.[44][45]
Compușii de carbon reprezintă baza vieții pe Pământ șiciclul carbon-azotproduce o parte din energia radiată deSoareși de altestele.Deși formează o varietate extraordinară de compuși, majoritatea formelor de carbon sunt destul de nereactive în condiții normale. În condiții standard de temperatură și presiune, carbonul este rezistent la acțiuneaagenților oxidanți,cu excepția oxidanților puternici. Carbonulnureacționează cuacidul sulfuric,acidul clorhidric,clorulsaumetalele alcaline.
Reacția cu nemetale și oxizi nemetalici[modificare|modificare sursă]
La temperaturi ridicate, carbonul reacționează cuoxigenulformândoxizii de carbon.Monoxidul de carbonse obține prin combinarea carbonului cu o cantitate insuficientă de oxigen, sau prin efectuarea reacției la o temperatură înaltă, la care dioxidul de carbon nu este stabil:[46]
- C(s)+ O2(g)→ 2 CO(g)
Carbonul reacționează cusulfulpentru a obținesulfură de carbon:
- C(s)+ S(s)→ CS2(l)
O reacție specifică este reacția de formare agazului de apă,prin care se suflă aburi (apă în stare gazoasă) printr-un strat de cărbune incandescent, formându-se amestecul de oxizi de carbon șihidrogengazos:[46]
- C(s)+ H2O(g)→ CO(g)+ H2(g)
Reacția cu metale și oxizi metalici[modificare|modificare sursă]
Carbonul preia oxigenul din oxizii metalici, cu obținereametaluluielementar. Aceastăreacție exotermăeste folosită în industria fierului și oțelului pentru obținerea fierului și în vederea controlării conținutului de carbon dinoțel:
- Fe
3O
4+ 4 C(s)→ 3 Fe(s)+ 4 CO(g)
Carbonul se combină cu unele metale și oxizi metalice la temperaturi înalte cu formare decarburi metalice.Un exemplu estecarbura de wolfram,un compus utilizat pe larg ca șiabrazivși pentru fabricarea unor unelte de tăiat.
Carbura de calciu,numită șicarbid,un alt exemplu de carbură importantă din punct de vedere industrial, se obține la nivel industrial prin reducerea varului nestins (oxidul de calciu) cu cărbune de lemn saucocs,la o temperatură de 2500°C:[47]
- CaO + 3 C → CaC2+ CO
Izotopi[modificare|modificare sursă]

Izotopiicarbonului sunt acelenuclee atomicecare conțin șaseprotoniplus un anumit număr deneutroni(care variază de la 2 la 16). Carbonul are doiizotopinaturali stabili.[1]Izotopulcarbon-12(12C) reprezintă 98,93% din totalitatea carbonului de pe Pământ, iar izotopulcarbon-13(13C) reprezintă restul de 1,07%.[1]Concentrația de12C este chiar mai mare în materialele biologice, întrucât în cadrul reacțiilorbiochimiceacest izotop are prioritate față de13C.[48]În 1961,Uniunea Internațională de Chimie Pură și Aplicată(IUPAC) a adoptat izotopulcarbon-12ca fiind baza pentrumasele atomice.[49]Experimentele de identificare a carbonului prinrezonanță magnetică nucleară(RMN) se realizează cu ajutorul izotopului13C.
Carbon-14sauradiocarbonul(14C) este unradioizotopîntâlnit în natură, care se formează în atmosfera superioară (partea inferioară astratosfereiși cea superioară atroposferei) în urma interacției dintre atomii deazotșiradiațiile cosmice.[50]Pe Pământ, este întâlnit în cantități extrem de mici, aproximativ o parte la untrilion(0,0000000001%), fiind în majoritate prins în atmosferă și în depozitele de suprafață, în special înturbăși în alte materiale organice.[51]Acest izotop este instabil și se dezintegrează prinemisie β−.Datorităperioadei de înjumătățirerelativ scurte, de aproximativ 5730 ani,14C este absent în rocile antice. Cantitatea de izotop14C dinatmosferăși din organismele vii este oarecum constantă, dar scade în corpurile acestora după moarte. Acest principiu este folosit pentrudatarea cu radiocarbon,o metodă inventată în 1949 și folosită pentru determinarea vârstei unor materiale pe bază de carbon, cu condiția ca aceasta să nu depășească aproximativ 40.000 ani.[52][53]
Există aproximativ 15 izotopi cunoscuți ai carbonului, iar cel cu cea mai scurtă durată de viață este8C, care se dezintegrează prin emisie de protoni șidezintegrare alfa,și are un timp de înjumătățire de 1,98739x10−21secunde.[54]Izotopul19C prezintă proprietăți interesante, în sensul cărazasa este cu mult mai mare decât s-a prezis pentru situația în carenucleul său atomicar fi osferăcudensitateconstantă.[55]
Compuși[modificare|modificare sursă]
Carbonul este elementul capabil să formeze cel mai mare număr de compuși: aproximativ zece milioane de compuși posibili. Întrucâtchimia organicăeste adesea denumită „chimia carbonului”, deoarece aceasta studiază majoritatea compușilor carbonului (în combinație cu hidrogenul și alte elemente), sunt puțini compuși așa-zisanorganiciai carbonului, precum: oxizii de carbon,carbonații,cianurile,cianații,tiocianații,fulminații,precum și acizii corespunzători. De asemenea, mai sunt luate în considerare șicarburile.
Compuși organici[modificare|modificare sursă]


Carbonul are capacitatea de a forma lanțuri sau catene foarte lungi prin legături carbon-carbon. Această proprietate se numeșteconcatenare,și este restrânsă doar la câteva elemente (în afară de carbon, siliciul, borul și azotul). Legăturile carbon-carbon sunt destul de puternice și anormal de stabile. Această caracteristică este importantă deoarece permite carbonului să formeze un număr extrem de mare de compuși; de fapt, există mai mulți compuși chimici care conțin carbon decât toți compușii celorlalte elemente chimice la un loc.[56][57]
Cea mai simplă formă de moleculă organică estehidrocarbura- o familie mare demolecule organicecare sunt alcătuite din atomi dehidrogenlegați de un lanț de atomi de carbon. Lungimea catenei,catenele laterale(ramificațiile) șigrupele funcționaleinfluențează proprietățile moleculelor organice. Cea mai simplă hidrocarbură și, respectiv, cel mai simplu compus organic estemetanul.
După natura atomilor din compuși, există două clase majore decompuși organici:hidrocarburile,compuși formați prin saturarea cu hidrogen a catenelor saturate sau nesaturate de carbon șicompușii organici cu funcțiuni,o categorie care conține extrem de multe clase de substanțe importante din punct de vedere industrial și biologic, după cum se poate vedea în continuare. Compușii cu funcțiuni simple, monovalente suntcompușii hidroxilici(alcoolii,enolii,fenolii),nitroderivații,derivații halogenați șiaminele,compușii cu funcțiuni divalente suntcompușii carbonilici(aldehideleșicetonele), iar compușii cu funcțiuni trivalente suntacizii carboxilici.De asemenea, există și derivați ai acestor categorii, precumesterii,anhidridele acide,amideleșibiomoleculele(proteinele,polizaharidele,lipideleșiacizii nucleici), toate acestea având ca element de bază carbonul.[58][59]
Carbonul este răspândit în toate viețuitoare și formele de viață, reprezentând elementul central alchimiei organice.Când se unește cuhidrogenul,se obțin forme variate de hidrocarburi importante din punct de vedere industrial, fiindagenți frigorifici,lubrifianți,solvențiși ca precursori în procesele de fabricație alematerialelor plastice,produselor petrochimiceși acombustibililor fosil.
Când se combină cuhidrogenulșioxigenul,carbonul poate forma o mare varietate de categorii de compuși importanți din punct de vedere biologic, printre care se numărăzaharidele,chitinele,alcoolii,grăsimile,esteriiaromatici,carotenoiziișiterpenele.Cuazotulformeazăalcaloizi,iar prin adăugarea desulfse obținantibioticele,aminoaciziișicauciucurile.Prin adăugarea defosforla aceste elemente, se obținacizii nucleici,ADN-ul șiARN-ul, esențiali pentru codificarea informației genetice specifice fiecărei viețuitoare. De asemenea,ATP-ul (adenozintrifosfatul) este cea mai importantă moleculă de transfer și de stocare a energiei din celulele vii.
Compuși anorganici[modificare|modificare sursă]

În categoria compușilor anorganici ai carbonului intră acei compuși care sunt asociați cumineraleleși nu conținhidrogensaufluor,însă această definiție lasă deschise anumite interpretări. Printre cei mai simpli compuși anorganici ai carbonului se numărăoxizii de carbon.Cel mai cunoscut și important oxid al carbonului estedioxidul de carbon(CO2). Este un component minor alatmosferei Pământului,un compus volatil produs și folosit de toate ființele vii, și care era principalul component al paleoatmosferei.[60]Dizolvat înapăformează urme deacid carbonic(H2CO3), dar ca majoritatea compușilor cu mai mulți atomi de oxigen la un singur carbon, acesta este instabil.[61]Totuși, prin acest intermediar, sunt produșiionicarbonat,structuri stabilizate prinrezonanță.Unelemineraleimportante sunt carbonați, precumcalcitulșiazuritul.Disulfura de carbon(CS2) are o structură similară.[44]
Celălalt oxid comun al carbonului estemonoxidul de carbon(CO), compus ce se formează prin combustia incompletă a carbonului și este un gaz incolor și inodor. Fiecare moleculă conține olegătură triplă,care este foarte puținpolară,rezultând tendința de a se atașa permanent de moleculele dehemoglobină,înlocuind oxigenul și formând carboxihemoglobina. Se poate concluziona astfel că gazul este foarte toxic.[62][63]Ionul cianură(CN-), are o structură similară și se comportă ca un ionhalogenură.De exemplu, poate formacianogenul((CN)2,zis și dician), cu o structură similară halogenurilor diatomice. Printre ceilalți oxizi mai puțin comuni se numărăsuboxidul de carbon(C
3O
2),[64]monoxidul de dicarbon, instabil (C2O),[65][66]trioxidul de carbon (CO3),[67][68]ciclopentanpentona (C5O5),[69]ciclohexanhexona (C6O6),[69]și anhidrida melitică (C12O9).
Cumetalelereactive, precumwolframul,carbonul formează fiecarburi metalice(C-), fieacetiluri metalice(C22-). De asemenea, formeazăaliajecu puncte de topire foarte înalte. Aceștianionisunt astfel asociați cumetanulșiacetilena,ambii fiindacizifoarte slabi. Cu oelectronegativitatede 2,5,[70]carbonul are o preferință de a formalegături covalente.Unele carburi au matrice covalente, de exemplucarbura de siliciusau carborundul (SiC), fiind asemănătoare cudiamantul.Totuși, chiar și cele mai polare și saline carburi nu sunt completionice.[71]
Compuși organometalici[modificare|modificare sursă]
Prin definiție, compușii organometalici conțin cel puțin o legătură de tipul carbon-metal. Există o varietate largă de astfel de compuși, iar printre principalele clase se numără: compuși simpli alchil-metal (de exemplu, tetraetilplumbul), compuși η2-alchene (de exemplu,sarea lui Zeise) și compuși η3-alil (de exemplu, dimerul clorurii de alilpaladiu);metalocenelesunt acei compuși care conținliganzide tipciclopentadienil(de exemplu,ferocenul). Există mulțicarbonilici metalici(de exemplu, tetracabonilul de nichel).
Deși se credea că carbonul formează exclusiv patru legături, a fost recent descoperit un compus complex organometalic ce conține un atom de carbon hexacoordinat, cu geometrie octaedrică. Cationul acestui compus este [(Ph3PAu)6C]2+,cu denumireahexakis(trifenilfosfanaurio)metan. Se crede că acest fenomen este cauzat de aurofilicitatea pentru liganzii deaur.[72]
În natură[modificare|modificare sursă]
Formarea în stele[modificare|modificare sursă]
Carbonul nu a fost creat în timpulBig Bang-ului, deoarece are nevoie de producerea unei coliziuni triple de particule alfa (nuclee deheliu). Universul s-a extins inițial și apoi s-a răcit prea repede pentru ca acest lucru să fie posibil. Oricum, este produs în interiorulstelelorînramura orizontală,unde un nucleu deheliueste transformat în carbon prinprocesul triplu-alfa.A fost de asemenea creat în stări multi-atomice.
Răspândire[modificare|modificare sursă]



Carbonul esteal patrulea cel mai abundent elementdin univers după masă, situat în top dupăhidrogen,heliușioxigen.Este răspândit înSoare,stele,cometeși înatmosferamajoritățiiplanetelor.[73]Uniimeteorițiconțin diamante microscopice, care s-au format în perioada în caresistemul solarera încă undisc protoplanetar.[74]De asemenea, este posibil ca diamantele microscopice să se fi putut forma datorită presiunii intense și a temperaturilor extrem de ridicate din timpul impacturilor dintre meteoriți.[75]
În 2014,NASAa anunțat publicarea uneibaze de datefolosită pentru urmărireahidrocarburilor aromatice policiclice(HAP) dinunivers.Mai mult de 20% din carbonul din univers poate fi asociat cu aceste HAP, care sunt compuși complecși ai carbonului și hidrogenului, fără oxigen.[76]Acești compuși sunt notabili fiindcă este luată în considerare ipoteza că HAP au avut un rol înabiogenezăși în aparițiavieții.Se pare că HAP s-au format la câteva miliarde de ani dupăBig Bang,fiind foarte răspândite în univers și asociate cuapariția stelelorși cuexoplanetele.[73]
S-a estimat că partea solidă a Pământului conține aproximativ 730 ppm (părți per milion) carbon, cu aproximativ 2000 ppm în nucleu și 120 ppm în manta și în scoarța terestră.[77]Din moment cemasa Pământuluieste aproximativ5972×1024kg,asta implică faptul că ar conține aproximativ 4360 milioane degigatonede carbon.
În combinație cuoxigenul,mai exact îndioxidul de carbon,carbonul este răspândit înatmosfera terestră(aproximativ 810 gigatone de carbon) și dizolvat în toate elementele hidrologice (aproximativ 36.000 gigatone de carbon). Aproximativ 1.900 gigatone de carbon sunt prezente și înbiosferă.De asemenea, șihidrocarburile(precumcărbunele,petrolulșigazele naturale) conțin carbon.Rezervele de cărbunesunt de aproximativ 900 gigatone, iar resursele probabil 18,000 Gt.[78]Rezervele petroliere sunt de aproximativ 150 gigatone. Sursele descoperite de gaze naturale sunt de aproximativ 175 1012metri cubi (conținând aproximativ 105 gigatone de carbon), dar studiile au estimat alți 900 1012metri cubi de depozite neconvenționale, precum degaz de șist,care ar reprezenta aproximativ 540 gigatone de carbon.[79]
Carbonul este de asemenea întâlnit înhidrații de metandin regiunile polare și de pe fundul mărilor. Valorile estimate pentru carbonul din acești compuși este de 500 până la 2500Gt,[80]sau chiar 3.000 Gt.[81]
În trecut, cantitatea de hidrocarburi la nivel mondial era mult mai mare. Conform unor surse, în perioada dintre anii 1751 și 2008 aproximativ 347 de gigatone de carbon au fost eliberate în atmosferă sub formă de dioxid de carbon, prin ardereacombustibililor fosili.[82]Alte surse estimează totalul la 879 Gt, iar cantitatea care face referire la gazele ajunse în atmosferă, oceane și pe pământ (precum înturbării) ajunge la 2.000 Gt.[83]
Carbonul este un constituent a cantității extrem de mare de roci cu conținut decarbonat(aproximativ 12% în procente de masă, printre care se numără:calcarul,dolomiteleșimarmura.Cărbuneleeste foarte bogat în carbon (de exemplu,antracitulconține 92–98% carbon)[84]și este cea mai mare sursă comercială de carbon mineral, măsurând 4.000 gigatone și reprezentând 80% din totalulcombustibililor fosili.[85]
În ceea ce privește alotropii carbonului, grafitul este întâlnit în cantități mari înStatele Unite(în majoritate înNew YorkșiTexas),Rusia,Mexic,GroenlandașiIndia.Diamantele naturale sunt întâlnite în roca numităkimberlit,dinvulcani.Majoritatea depozitelor de diamante sunt răspândite înAfrica,în special înAfrica de Sud,Namibia,Botswana,Republica CongoșiSierra Leone.De asemenea, au fost întâlnite depozite de diamante și înArkansas,Canada,zonaarcticărusă,BraziliașiAustraliade nord și de vest. În prezent, diamantele mai sunt extrase de pe fundul oceanului în zonaCapului Bunei Speranțe.
Izotopul carbon-14 se formează în straturile superioare aletroposfereiși înstratosferă,la altitudini cuprinse între 9–15 km, în urma unei reacții care este precipitată deradiațiile cosmice.[86]Neutronii termici sunt produșii care se unesc cu nucleul izotopului azot-14, formând carbon-14 și un proton. Astfel, 1,2 × 1010% din dioxidul de carbon atmosferic conține carbon-14.[19]
Asteroizii cu un conținut bogat de carbon sunt relativ răspândiți în părțile exterioare alecenturii de asteroiziși alesistemului solar.Oamenii de știință încă nu au realizat teste pe eșantioane obținute direct de pe acești asteroizi, însă ei ar putea fi folosiți în viitor pentrumineritulîn afara Pământului, o tehnologie care este încă indisponibilă.[87]
Rol biologic[modificare|modificare sursă]

Carbonul este un element esențial pentru toate formele de viață cunoscute, fiind un micronutrient. Fiind atât de răspândit în aproape toți compușii cu importanță biologică majoră (exceptândsărurile,apași restul compușilor bioanorganici), carbonul poate fi considerat cel mai important element pentru existențaviețiiașa cum este ea cunoscută. De ladioxidul de carbonexpirat de animale și utilizat de plante și până lamacromoleculelecomplexe, carbonul este elementul de bază, fără de care acești compuși nu ar exista.
Circuitul carbonului[modificare|modificare sursă]
În condițiile naturale de pe Pământ, conversia unui element într-altul este un fenomen foarte rar întâlnit. De aceea, cantitatea de carbon care se află pe Pământ este efectiv constantă. Astfel, procesele care utilizează carbon trebuie să procure de undeva elementul, iar apoi să-l depună într-un anumit loc. Totalitatea acestor schimburi ale carbonului sunt cunoscute sub numele decircuitul carbonului în natură.De exemplu, plantelefotosintetizatoareextragdioxidul de carbondinatmosferă(sau dinapa de mare) și îl folosesc pentru a construi biomasă printr-un proces numitfixarea carbonului.O parte din această biomasă este consumată de către animale ca parte alanțului trofic,iar o altă cantitate de carbon este eliminată înapoi în atmosferă prin expirarea dioxidului de carbon de către acestea. Totuși, circuitul carbonului este mult mai complicat decât atât, deoarece în transportul acestui element sunt implicate și elementele abiotice. De exemplu, o parte din dioxidul de carbon se dizolvă înoceane,iar dacă bacteriile nu îl consumă, atunci plantele sau animalele moarte se pot transforma în timp înpetrolsaucărbune,care eliberează carbonul prin ardere.[88][89]
Obținere[modificare|modificare sursă]
Preparare în laborator[modificare|modificare sursă]
Producția la scară industrială[modificare|modificare sursă]
Carbonul este răspândit în natură în stare elementară în cele două forme alotropice:grafitulșidiamantul,fiind deci minat direct din zonele în care aceste minerale se găsesc, deci nu este nevoia neapărată a unor reacții chimice industriale pentru producerea acestuia. Se mai poate consideră, în anumite circumstanțe, șicărbuneleca o sursă importantă de carbon, deși procentul este mai mic decât în cazul celor două forme pure. Totuși,negrul de fum,o varietate tehnică de cărbune negru, sub formă de cenușă, se poate produce la nivel industrial prin arderea cu aer insuficient a unor gudroane de cărbuni, a unorfracțiuni greledepetrol,aacetileneisau ametanului,după cum urmează:[90]

- C2H2+ O½→ 2 C + H2O
- CH4+ O2→ C + 2H2O
Grafitul[modificare|modificare sursă]
Depozite valoroase de grafit (numit și plombagină) se găsesc în multe zone ale lumii, însă cele mai importante din punct de vedere economic se situează înChina,India,BraziliașiCoreea de Nord.Depozitele de grafit sunt de origine metamorfică, fiind întâlnite în asociație cucuarțul,micasaufeldspațiiîn șisturi,gnaisulșigresiașicalcarulmetamorfozat sub formă delentilesaufiloaneînpegmatite,câteodată cu o grosime de un metru sau chiar mai mare. În rocile metamorfice bogate în surse de carbon, depozitele de grafit s-au format pe măsură ce materialul organic din calcar a fost alterat de căldură și presiune.[91][92]Depozitele de grafit dinBorrowdale,Cumberland,Angliaerau în trecut de o puritate atât de ridicată și atât de mari încât, până în secolul al XIX-lea,creioaneleerau realizate prin simpla atașare a lemnului asupra minelor de grafit, care erau direct tăiate din blocurile de grafit.[93]
Grafitul apare în natură sub diferite forme: poate fi cristalin (extrem de rar), amorf, granular, sau stratificat. Grafitul amorf este cel mai abundent și cel cu calitatea cea mai scăzută. Deși este denumit „amorf”, această denumire a grafitului face referire de fapt la o formă ce conține cristale foarte mici și este folosit pentru fabricarea unor produse cu valoare scăzută. Depozite mari de grafit amorf sunt situate în China, Europe, Mexic și Statele Unite.[93]
ConformUSGS,producția la nivel mondial de grafit natural în anul 2010 era de 1,1 milioane de tone, dintre care China a contribuit cu 800.000 t, India cu 130.000 t, Brazilia cu 76.000 t, Coreea de Nord cu 30.000 t, iar Canada cu 25.000 t. ÎnStatele Unite,în anul 2009 au fost sintetizate aproximativ 118,000 t de grafit sintetic, cu o valoare de 998 milioane de dolari.[93]
Diamantul[modificare|modificare sursă]

Doar o micăfracțiedin așa-zisele „mine de diamante” reprezintă de fapt diamante. Zăcămintele sunt zdrobite, însă procedeul se face cu multă grijă pentru a evita distrugerea diamantelor de mărimi mai mari, iar ulterior particulele sunt sortate după densitate. În ziua de azi, diamantele sunt localizate în fracțiile cu conținut bogat de diamante cu ajutorul fluorescenței curaze X,după care etapele finale de sortare sunt realizate manual. Înainte de folosirea acestei metode cu raze X, separarea se făcea cu ajutorul unor curele cu grăsime, întrucât diamantele au o tendință mai mare de a se lipi de grăsimi decât celelalte minerale componente ale zăcământului.[94]
Cărbunii[modificare|modificare sursă]
Cărbunele se obține pe cale artificială, deși există și în natură compuși cu o compoziție asemănătoare. Există mai multe tipuri de cărbuni, precum cărbunii fosili, care formează zăcăminte bogate în multe locuri de la suprafață. Unii cărbuni fosili conțin până la 99% carbon. Deci, aceștia conțin întotdeauna impurități care influențează proprietățile lor. Alte tipuri de cărbune sunt:cocsul,mangalulși cărbunii tehnici (negrul de fum, negrul de oase, etc.).[95]
Aplicații[modificare|modificare sursă]






Carbonul este un element esențial pentru toate formele de viață cunoscute, iar fără acesta viața pe care o cunoaștem nu ar putea exista. Principala utilizare economică a carbonului, în afara industriei alimentare și a lemnului, se situează în domeniulhidrocarburilor,unde se remarcă produse importante precum:metanulgazos ca șicombustibil fosilșipetrolulsauțițeiul.Petrolul estedistilatînrafinăriiprin intermediulindustriei petrochimice,pentru a se obținebenzina,kerosenulși alți produși.Celulozaeste un polimer natural ce conține carbon, produs în corpul plantelor, și care poate fi prelucrat sub formă delemn,bumbacsaupânză.[96]În corpul plantelor, principala sa utilizare este una mecanică, de a conferi suport și are astfel un rol structural. Printre polimerii de origine animală cu valoare comercială se numărălâna,cașmirulșimătasea.Materialele plasticesunt fabricate din polimeri sintetici de carbon, care mai conțin și atomi deoxigenși deazotîn catena principală. Materialele de bază pentru multe din aceste substanțe sintetice provin din industria petrolieră. Diferite forme de carbon sunt adsorbante eficiente de gaze[97][98][99],materiale promițătoare pentru preparareacatalizatorilor[100][101][102]șielectrocatalizatorilor[103][104][105].
Precum compușii carbonului sunt extrem de variați, astfel sunt și aplicațiile acestora. Carbonul poate forma diversealiajecufierul,cel mai comun fiindoțelul.Grafitulse poate combina cuargilelepentru a forma uzualele mine de grafit care sunt folosite pentruscrisșigrafică.Este folosit ca șilubrifiantșipigment[106],ca material de turnare în procesul de fabricare alsticlei,ca șielectrodîn unele tipuri debateriiși ca moderator nuclear înreactoarele nucleare.
Cărbunele(și implicitmangalul) are multiple utilizări, printre care se numără aplicațiile în domeniulgraficii(ca și material de desen), ca sursă de căldură pentru grătare, înmetalurgie,etc.Lemnul,cărbunii șipetrolulsunt folosiți ca șicombustibilipentru producerea deenergieși ca sursă decăldură.Diamantulcu calitățile necesare este utilizat pentru fabricareabijuteriilor,iar diamantele industriale intră în componența instrumentelor folosite pentru forajul, tăierea și polizareametalelorși a unor pietre prețioase. Materialele plastice sunt fabricate din hidrocarburile fosile, iarfibra de carbon,care este fabricată prinpirolizafibrelor sintetice depoliester,este utilizată pentru consolidarea materialelor plastice.
Negrul de fumeste utilizat ca șipigmentde culoare neagră, în anumitecerneli,vopsele pe bază de ulei și de apă, hârtia de carbon și încauciucuriși materiale plastice, ca și aditiv.Cărbunele activeste un material cu proprietățiabsorbanteșiadsorbante,fiind utilizat ca șimedicamentîn tratamentul intoxicațiilor cauzate prin ingerare, înmăștile de protecție contra gazelorși în sistemele de purificare a apei[107].Carbonul este folosit, la temperaturi ridicate, în reacțiile chimice dereducere.Cocsuleste folosit pentru reducereaminereuluide fier, pentru obținerea acestui metal.Carburiledesiliciu,wolfram[108],bor și titan sunt printre cele mai dure materiale cunoscute, fiind utilizate ca șiabrazivi.De asemenea, trebuie menționată și implicarea izotopuluicarbon-14în procesul dedatare cu radioizotop,care are extrem de multe aplicații (în special înarheologie).[52]
Diamante[modificare|modificare sursă]
Măsuri de protecție[modificare|modificare sursă]

Carbonul pur are otoxicitateextrem de mică asupraoamenilorși poate fi manipulat sau chiar ingerat fără probleme, în cazulgrafituluiși a unorcărbuni.Este rezistent la dizolvare sau la atacul agenților chimici, chiar și în mediul acid din interiorul tractului digestiv. Din acest motiv, odată ingerat sau ajuns în țesutul uman, este posibil să rămână acolo o perioadă nedefinită. Negrul de fum a fost probabil unul dintre primii pigmenți folosiți pentrutatuare,și se pare că mumiaÖtziavea tatuaje pe bază de carbon, care au supraviețuit timp de 5200 de ani după moartea sa.[109]Inhalarea în cantități mari a prafului de cărbune sau a funinginii poate fi periculoasă, având ca rezultat iritarea țesutului pulmonar și cauzarea unor probleme de respirație congestive care pot duce lapneumoconioză.Praful de diamant, utilizat pe larg ca și abraziv, poate fi toxic prin inhalare sau ingerare. Micropariculele de carbon, care sunt produse în gazele de eșapament ale motoarelor diesel, pot să se acumuleze în plămâni.[110]În toate exemplele date, toxicitatea provine mai degrabă de la contaminanți (de exemplu, compuși organici și metale grele) decât de la elementul în sine.
În cazul celorlalteviețuitoarede pe Pământ, carbonul este la fel de puțin toxic ca și pentru oameni. Conform unor cercetări, se pare că nanoparticulele de carbon sunt mortale pentru adulții speciilor din genulDrosophila.[111]
Carbonul poate lua foc și poate arde puternic la temperaturi înalte, în prezența aerului. Cantități mari acumulate decărbune,care au fost izolate timp de sute de milioane de ani în absența oxigenului, pot să ardă spontan când sunt expuse aerului.[112][113]
Înaplicațiile nucleare,unde grafitul este utilizat pe post de moderator nuclear, este posibilă să aibă loc un incendiu spontan ca urmare a acumulării energiei Wigner. Un exemplu de incident în care materialele din reactor (grafit solid) au început să ardă spontan esteaccidentul nuclear din WindscaledinMarea Britanie,ce avut loc pe10 octombrie1957.
Marea varietate de compuși ai carbonului include atât substanțe toxice, precumtetrodotoxina,lectinaricinădin semințele dericin(Ricinus communis),cianurile(CN−) șimonoxidul de carbon,cât și substanțe esențiale vieții, precumglucozașiproteinele.
Vezi și[modificare|modificare sursă]
- Cărbuni:antracit,cocs,huilă,lignit,mangal,turbă
- Diamant
- Fulerenă
- Grafen
- Grafit
- Nanotub de carbon
- Reacție Boudouard
- Stea de carbon
Referințe[modificare|modificare sursă]
- ^abc„Carbon – Naturally occurring isotopes”.WebElements Periodic Table.Accesat în.
- ^„History of Carbon”.Arhivat dinoriginalla.Accesat în.
- ^„Biological Abundance of Elements”.The Internet Encyclopedia of Science.Accesat în.
- ^ab„World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)”.Accesat în.
- ^abChemistry Operations ().„Carbon”.Los Alamos National Laboratory. Arhivat dinoriginalla.Accesat în.
- ^Deming, Anna ().„King of the elements?”.Nanotechnology.21.doi:10.1088/0957-4484/21/30/300201.Accesat în.
- ^„Chinese made first use of diamond”.BBC News..Accesat în.
- ^van der Krogt, Peter.„Carbonium/Carbon at Elementymology & Elements Multidict”.Accesat în.
- ^Ferchault de Réaumur, R.-A. ().L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956).Paris, Chicago.
- ^„Carbon”.Canada Connects. Arhivat dinoriginalla.Accesat în.
- ^Senese, Fred.„Who discovered carbon?”.Frostburg State University.Accesat în.
- ^Giolitti, Federico ().The Cementation of Iron and Steel.McGraw-Hill Book Company, inc.
- ^Senese, Fred ().„Who discovered carbon”.Frostburg State University.Accesat în.
- ^Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (). „C60:Buckminsterfullerene”.Nature.318(6042): 162–163.Bibcode:1985Natur.318..162K.doi:10.1038/318162a0.
- ^abcUnwin, Peter.„Fullerenes(An Overview)”.Accesat în.
- ^„The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"”.Accesat în.
- ^abHarris, PJF ().„Fullerene-related structure of commercial glassy carbons”(PDF).Philosophical Magazine.84(29): 3159–3167.Bibcode:2004PMag...84.3159H.doi:10.1080/14786430410001720363.Arhivat dinoriginal(PDF)la.Accesat în.
- ^„Carbon”laDEX online- Etimologia cuvântuluicarbon;accesat la 13 august 2017
- ^abGreenwood and Earnshaw, pp. 276–8
- ^Nenițescu,Chimie Generală,p. 786
- ^Reid, Danielle.„The 4 Types of Bonds Carbon Can Form”.study.com.
- ^Ritter, Stephen K.„Six bonds to carbon: Confirmed”.Chemical & Engineering News.
- ^Haaland, D (). „Graphite-liquid-vapor triple point pressure and the density of liquid carbon”.Carbon.14(6): 357.doi:10.1016/0008-6223(76)90010-5.
- ^Savvatimskiy, A (). „Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”.Carbon.43(6): 1115.doi:10.1016/j.carbon.2004.12.027.
- ^Greenville Whittaker, A. (). „The controversial carbon solid−liquid−vapour triple point”.Nature.276(5689): 695–696.Bibcode:1978Natur.276..695W.doi:10.1038/276695a0.
- ^Zazula, J. M. ().„On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam”(PDF).CERN.Accesat în.
- ^Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (). „Materials: Ultrahard polycrystalline diamond from graphite”.Nature.421(6923): 599–600.Bibcode:2003Natur.421..599I.doi:10.1038/421599b.PMID12571587.
- ^Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny ().„Superlubricity of Graphite”(PDF).Physical Review Letters.92(12).Bibcode:2004PhRvL..92l6101D.doi:10.1103/PhysRevLett.92.126101.
- ^Deprez, N.; McLachan, D. S. (). „The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction”.Journal of Physics D: Applied Physics.Institute of Physics.21(1): 101–107.Bibcode:1988JPhD...21..101D.doi:10.1088/0022-3727/21/1/015.
- ^Collins, A. T. (). „The Optical and Electronic Properties of Semiconducting Diamond”.Philosophical Transactions of the Royal Society A.342(1664): 233–244.Bibcode:1993RSPTA.342..233C.doi:10.1098/rsta.1993.0017.
- ^Delhaes, P. ().Graphite and Precursors.CRC Press.ISBN90-5699-228-7.
- ^abEbbesen, T. W., ed. ().Carbon nanotubes—preparation and properties.Boca Raton, Florida: CRC Press.ISBN0-8493-9602-6.
- ^abDresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., ed. (). „Carbon nanotubes: synthesis, structures, properties and applications”.Topics in Applied Physics.Berlin: Springer.80.ISBN3-540-41086-4.
- ^abNasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. (). „A novel hybrid carbon material”.Nature Nanotechnology.2(3): 156–161.Bibcode:2007NatNa...2..156N.doi:10.1038/nnano.2007.37.PMID18654245.
- ^Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (). „Investigations of NanoBud formation”.Chemical Physics Letters.446:109–114.Bibcode:2007CPL...446..109N.doi:10.1016/j.cplett.2007.08.050.
- ^Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (). „Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2over nickel catalyst”.Applied Catalysis A: General.274:1–8.doi:10.1016/j.apcata.2004.04.008.
- ^abClifford, Frondel; Marvin, Ursula B. (). „Lonsdaleite, a new hexagonal polymorph of diamond”.Nature.214(5088): 587–589.Bibcode:1967Natur.214..587F.doi:10.1038/214587a0.
- ^Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (). „Structural analysis of a carbon foam formed by high pulse-rate laser ablation”.Applied Physics A: Materials Science & Processing.69(7): S755–S758.doi:10.1007/s003390051522.
- ^Heimann, Robert Bertram; Evsyukov, Sergey E.; Kavan, Ladislav ().Carbyne and carbynoid structures.Springer. pp. 1–.ISBN978-0-7923-5323-2.Accesat în.Parametru necunoscut
|last-author-amp=ignorat (ajutor) - ^Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (). „Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene”.Science.321(5887): 385–8.Bibcode:2008Sci...321..385L.doi:10.1126/science.1157996.PMID18635798.Sumar pentru neinițiați.
- ^Sanderson, Bill ().„Toughest Stuff Known to Man: Discovery Opens Door to Space Elevator”.nypost.com. Arhivat dinoriginalla.Accesat în.
- ^Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. ().„Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage”.Chemistry of Materials.23(4): 923–925.doi:10.1021/cm1025188.ISSN0897-4756.
- ^Jenkins, Edgar ().The polymorphism of elements and compounds.Taylor & Francis. p. 30.ISBN0-423-87500-0.Accesat în.
- ^abGreenwood and Earnshaw, pp. 289–292
- ^Nenițescu,Chimie Generală,pp. 791-792
- ^abNenițescu,Chimie Generală,pp. 806-820
- ^Nenițescu,Chimie Generală,pp. 827-829
- ^Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul (). „Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology”.Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology.119(3): 725–737.doi:10.1016/S1095-6433(98)01016-2.
- ^„Official SI Unit definitions”.Accesat în.
- ^Bowman, S. ().Interpreting the past: Radiocarbon dating.British Museum Press.ISBN0-7141-2047-2.
- ^Brown, Tom ().„Carbon Goes Full Circle in the Amazon”.Lawrence Livermore National Laboratory.Accesat în.
- ^abLibby, W. F. ().Radiocarbon dating.Chicago University Press and references therein.
- ^Westgren, A. ().„The Nobel Prize in Chemistry 1960”.Nobel Foundation.Accesat în.
- ^„Use query for carbon-8”.barwinski.net.Accesat în.
- ^Watson, A. ().„Beaming Into the Dark Corners of the Nuclear Kitchen”.Science.286(5437): 28–31.doi:10.1126/science.286.5437.28.
- ^Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. ().Chemistry3: Introducing Inorganic, Organic and Physical Chemistry.Oxford University Press. p. 70.ISBN978-0-19-873380-5.Accesat în.
- ^Nenițescu, Costin D. ().Chimie organică(ed. VII). Editura Didactică și Pedagogică. p. 12.
- ^„Functional Groups and Classes of Organic Compounds”,Chemistry LibreTexts,,accesat în
- ^Arsene, Paraschiva; Popescu, Ștefan ().Chimie și probleme de chimie organică.București: Editura Tehnică. pp. 23–25.
- ^Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (). „The prebiological paleoatmosphere: stability and composition”.Origins of Life and Evolution of Biospheres.12(3): 245–259.Bibcode:1982OrLi...12..245L.doi:10.1007/BF00926894.
- ^Loerting, T.; et al. (). „On the Surprising Kinetic Stability of Carbonic Acid”.Angew. Chem. Int. Ed.39(5): 891–895.doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E.PMID10760883.
- ^Haldane J. ().„The action of carbonic oxide on man”.Journal of Physiology.18(5–6): 430–462.doi:10.1113/jphysiol.1895.sp000578.PMC1514663
 .PMID16992272.
.PMID16992272.
- ^Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (). „The clinical toxicology of carbon monoxide”.Toxicology.187(1): 25–38.doi:10.1016/S0300-483X(03)00005-2.PMID12679050.
- ^„Compounds of carbon: carbon suboxide”.Accesat în.
- ^Bayes, K. (). „Photolysis of Carbon Suboxide”.Journal of the American Chemical Society.83(17): 3712–3713.doi:10.1021/ja01478a033.
- ^Anderson D. J.; Rosenfeld, R. N. (). „Photodissociation of Carbon Suboxide”.Journal of Chemical Physics.94(12): 7852–7867.Bibcode:1991JChPh..94.7857A.doi:10.1063/1.460121.
- ^Sabin, J. R.; Kim, H. (). „A theoretical study of the structure and properties of carbon trioxide”.Chemical Physics Letters.11(5): 593–597.Bibcode:1971CPL....11..593S.doi:10.1016/0009-2614(71)87010-0.
- ^Moll N. G.; Clutter D. R.; Thompson W. E. (). „Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2”.Journal of Chemical Physics.45(12): 4469–4481.Bibcode:1966JChPh..45.4469M.doi:10.1063/1.1727526.
- ^abFatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. ().„Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)”(PDF).Journal of Research of the National Bureau of Standards Section A.67A:153–162.doi:10.6028/jres.067A.015.
- ^Pauling, L. ().The Nature of the Chemical Bond(ed. 3rd). Ithaca, NY: Cornell University Press. p. 93.ISBN0-8014-0333-2.
- ^Greenwood and Earnshaw, pp. 297–301
- ^Scherbaum, Franz; et al. (). „"Aurophilicity "as a consequence of Relativistic Effects: The Hexakis(triphenylphosphaneaurio)methane Dication [(Ph3PAu)6C]2+”.Angew. Chem. Int. Ed. Engl.27(11): 1544–1546.doi:10.1002/anie.198815441.
- ^abHoover, Rachel ().„Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That”.NASA.Arhivat dinoriginalla.Accesat în.
- ^Lauretta, D.S.; McSween, H.Y. ().Meteorites and the Early Solar System II.Space science series. University of Arizona Press. p. 199.ISBN978-0-8165-2562-1.Accesat în.
- ^Mark, Kathleen ().Meteorite Craters.University of Arizona Press.ISBN0-8165-0902-6.
- ^„Online Database Tracks Organic Nano-Particles Across the Universe”.Sci Tech Daily..Accesat în.
- ^William F McDonoughThe composition of the EarthinEarthquake Thermodynamics and Phase Transformation in the Earth's Interior..ISBN978-0126851854.
- ^Fred Pearce().„Fire in the hole: After fracking comes coal”.New Scientist:36–41.
- ^"Wonderfuel: Welcome to the age of unconventional gas"by Helen Knight,New Scientist,12 June 2010, pp. 44–7.
- ^Ocean methane stocks 'overstated',BBC, 17 Feb. 2004.
- ^"Ice on fire: The next fossil fuel"byFred Pearce,New Scientist,27 June 2009, pp. 30–33.
- ^Calcule realizate pe fișierul global.1751_2008.csv în[1]publicat deCarbon Dioxide Information Analysis Center.
- ^Rachel Gross ().„Deep, and dank mysterious”.New Scientist:40–43.
- ^Stefanenko, R. ().Coal Mining Technology: Theory and Practice.Society for Mining Metallurgy.ISBN0-89520-404-5.
- ^Kasting, James ().„The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning”.Consequences: the Nature and Implication of Environmental Change.4(1).
- ^„Carbon-14 formation”.Accesat în.
- ^Nichols, Charles R.„Voltatile Products from Carbonaceous Asteroids”(PDF).UAPress.Arizona.edu.Arhivat dinoriginal(PDF)la.Accesat în.
- ^Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; et al. (). „The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System”.Science.290(5490): 291–296.Bibcode:2000Sci...290..291F.doi:10.1126/science.290.5490.291.PMID11030643.
- ^Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (). „The global terrestrial carbon cycle”.Water, Air, & Soil Pollution.70:19–37.doi:10.1007/BF01104986.
- ^Nenițescu,Chimie Generală,p. 794
- ^John Farndon,Enciclopedia ilustrată a rocilor și mineralelor,trad. Ungureanu Adina, Editura Aquila, Oradea, 2008, pag. 144-145,ISBN 978-973-714-414-0
- ^„Graphite: Graphite mineral information and data.”,Https://www.mindat.org,accesat înLegătură externa în
|newspaper=(ajutor) - ^abcUSGS Minerals Yearbook: Graphite, 2009and Graphite: Mineral Commodity Summaries 2011
- ^Harlow, G. E. ().The nature of diamonds.Cambridge University Press. p. 223.ISBN0-521-62935-7.
- ^N.L. Glinka:Chimie generală,ediția a II-a (traducere după ediția a VIII-a rusă), Editura Tehnică, București, 1958; despre carbon și cărbuni: pag. 359-362
- ^„Uses of Carbon”,Usesof.net,accesat în
- ^„Activated carbon from lignocellulosics precursors: A review of the synthesis methods, characterization techniques and applications”.Renewable and Sustainable Energy Reviews.82:1393–1414..
- ^„Biochar-based adsorbents for carbon dioxide capture: A critical review”.Renewable and Sustainable Energy Reviews..
- ^„Surface modification of activated carbon for adsorption of SO2 and NOX: A review of existing and emerging technologies”.Renewable and Sustainable Energy Reviews.94:1067–1085..
- ^„Application of carbonized ion exchange resin beads as catalyst support for gas phase hydrogenation processes”.Reaction Kinetics, Mechanisms and Catalysis:1–10..
- ^„Fine-tuning the catalytic activity by applying nitrogen-doped carbon nanotubes as catalyst supports for the hydrogenation of olefins”..
- ^Ptaszyńska, Karolina; Malaika, Anna; Kapska, Magdalena; Kozłowski, Mieczysław (),SO3H-functionalized carbon fibers for the catalytic transformation of glycerol to glycerol tert-butyl ethers(în engleză),13(1), Scientific Reports,doi:10.1038/s41598-023-27432-7,ISSN2045-2322
- ^Pangotra, Dhananjai; Csepei, Lénárd-István; Roth, Arne; Ponce de León, Carlos; Sieber, Volker; Vieira, Luciana (),Anodic production of hydrogen peroxide using commercial carbon materials(în engleză),303,Applied Catalysis B: Environmental,doi:10.1016/j.apcatb.2021.120848,ISSN0926-3373
- ^Pangotra, Dhananjai; Csepei, Lénárd-István; Roth, Arne; Sieber, Volker; Vieira, Luciana (),Anodic generation of hydrogen peroxide in continuous flow(în engleză),24(20), Green Chemistry,doi:10.1039/D2GC02575B
- ^„Electrochemical synthesis of hydrogen peroxide from water and oxygen”.Nature Reviews Chemistry.3:442–458..
- ^Chavan, Bhagyesh; Nagose, Swati; Rose, Elvina; Joshi, Amit (),„Surfactant screening techniques for effective dispersion of carbon black pigment”,Coloration Technology(în engleză), pp. cote.12667,doi:10.1111/cote.12667,ISSN1472-3581,accesat în
- ^Kalantzis, Demetrios; Daskaloudis, Ioannis; Lacoere, Tim; Stasinakis, Athanasios S.; Lekkas, Demetris F.; De Vrieze, Jo; Fountoulakis, Michail S. (),Granular activated carbon stimulates biogas production in pilot-scale anaerobic digester treating agro-industrial wastewater(în engleză),376,Bioresource Technology,doi:10.1016/j.biortech.2023.128908,ISSN0960-8524
- ^SreeramaReddy, T. V.; Sornakumar, T.; VenkataramaReddy, M.; Venkatram, R. (),Machinability of C45 steel with deep cryogenic treated tungsten carbide cutting tool inserts(în engleză),27(1), International Journal of Refractory Metals and Hard Materials,doi:10.1016/j.ijrmhm.2008.04.007,ISSN0263-4368
- ^Dorfer, Leopold; Moser, M.; Spindler, K.; Bahr, F.; Egarter-Vigl, E.; Dohr, G. (). „5200-year old acupuncture in Central Europe?”.Science.282(5387): 242–243.Bibcode:1998Sci...282..239D.doi:10.1126/science.282.5387.239f.PMID9841386.
- ^Donaldson, K.; Stone, V.; Clouter, A.; Renwick, L.; MacNee, W. ().„Ultrafine particles”.Occupational and Environmental Medicine.58(3): 211–216.doi:10.1136/oem.58.3.211.PMC1740105
 .PMID11171936.
.PMID11171936.
- ^Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To YoungScienceDaily (17 aug. 2009)
- ^„Press Release – Titanic Disaster: New Theory Fingers Coal Fire”.www.geosociety.org.Arhivat dinoriginalla.Accesat în.
- ^McSherry, Patrick.„Coal bunker Fire”.www.spanamwar.com.Accesat în.
Bibliografie[modificare|modificare sursă]
- Greenwood, Norman N.; Earnshaw, Alan ().Chemistry of the Elements(ed. 2nd). Oxford: Butterworth-Heinemann.ISBN0080379419.
- Costin D. NenițescuChimie generală(ed. 1). București, Editura Didactică și Pedagogică.
Legături externe[modificare|modificare sursă]
| Puteți găsi mai multe informații despreCarbonprin căutarea în proiectele similare ale Wikipediei, grupate sub denumirea generică de„proiecte surori”: | |
| Definiții și traduceriîn Wikționar | |
| Imagini și mediala Commons | |
| Manualela Wikimanuale | |
| Resurse de studiula Wikiversitate | |
- CarbonulArhivatîn,laWayback Machine.de la sistemul-periodic.go.ro
- Incredibila poveste a carbonuluiArhivatîn,laWayback Machine., 3 august 2008, Diac. Dr. Adrian Sorin Mihalache,Ziarul Lumina
- CarbonpeIn Our TimelaBBC.(ascultă acum)
- Carbonde laThe Periodic Table of Videos(Universitatea din Nottingham, engleză)
- Carbon de la Britannica(engleză)
- Pagina despre carbon de la asu.edu
- Electrochemical uses of carbon[nefuncțională](engleză)
- Carbon—Super Stuff. Animation with sound and interactive 3D-models.Arhivatîn,laWayback Machine.
