Formaldehidă
| Metanal | |
 | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Formaldehidă formalină formol aldehidă metilică oxid de metilenă |
| Identificare | |
| Număr CAS | [50-00-0] |
| ChEMBL | CHEMBL1255 |
| PubChemCID | 712 |
| Informații generale | |
| Formulă chimică | CH2O |
| Aspect | gaz incolor |
| Masă molară | 30,03 g/mol |
| Proprietăți | |
| Densitate | 1 kg/m3 |
| Starea de agregare | gaz |
| Punct de topire | -117 °C |
| Punct de fierbere | -19.3 °C |
| Solubilitate | în apă: > 100 g/100 ml (la 20 °C); înetanol,acetonă:> 100 g/100 ml; solvenți organici încloroform |
| Presiune de vapori | 3890 mmHg la 25 °C |
| NFPA 704 | |
| Sunt folosite unitățileSIși condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modificădate/text | |
Formaldehida(cu denumireaIUPACmetanal,aldehidă metilicăsaualdehidă formică,soluția apoasă de formaldehidă 37% fiind cunoscută și sub numele deformol) este cea mai simplăaldehidă,și este ungazincolor cu miros înțepător.Formula chimicăeste H2CO sau CH2O. Formaldehida a fost pentru prima oară sintetizată de chimistul rusAleksandr Butlerovîn1859dar a fost identificată abia în1867,de cătreAugust Wilhelm von Hofmann.[1][2]
Formaldehida rezultă dinardereamaterialelor conținătoare decarbon. Poate fi găsită în focuri forestiere, în eșapamentulautomobilelorși în fum dețigară. Înatmosferaterestră, formaldehida este produsă de acțiunea luminiisolareși a oxigenului asuprametanuluiși a altorhidrocarburi.Cantități mici de formaldehidă sunt produse de metabolismul multororganisme,inclusiv de cel alomului.Totuși, aceasta este metabolizată laacid formicși nu se acumulează în organism.[3]
Formaldehida este una dintre cele mai vechi substanțe chimice folosite în industrie pentru obținerea rășinilor, folosită apoi în fabricarea plăcilor de lemn.[4]
De asemenea, formaldehida este o substanța uzuală în fabricarea echipamentelor sportive, a medicamentelor, a alimentelor, a încălțămintei, a componentelor pentru autovehicule, a hârtiei, a produselor textile, etc.[4]Se estimează că în anul 1996, capacitatea de producție de formaldehidă era de 8,7 milioane de tone pe an.[5]
GermaniașiItaliasunt țările cu cea mai mare producție anuală de formaldehidă dinUniunea Europeană(UE), asigurând aproximativ 10% din cantitatea produsă anual în lume.[4]De asemenea,Europa de Vestare un consum de 30% din consumul global de formaldehidă.[4]
Obținere
[modificare|modificare sursă]Laborator
[modificare|modificare sursă]Formaldehida a fost sintetizată pentru prima dată în anul 1859 de către chimistul rusAleksandr Butlerov(1828–86).[1]Acesta a denumit compusul „dioximetilen” (dioxid de metilen) datorită determinării eronate a formulei empirice (C4H4O4). A fost ulterior identificată de cătreAugust Wilhelm von Hofmann,care a anunțat obținerea sa prin trecerea vaporilor demetanolîn aer peste un fir deplatinăîncălzit.[2]Abia în anul 1869, Hofmann a determinat formula empirică corectă a formaldehidei.[6][7]Metoda lui Hofmann este încă cea utilizată în industrie, însă a suferit modificări.
O altă metodă aplicabilă la nivel de laborator este reacția deoxidareametanoluluisau aiodurii de metil.[8]
Industrie
[modificare|modificare sursă]Formaldehida este obținută la nivel industrial în urma reacției de oxidarecataliticăametanolului.Cei mai comuni catalizatori suntargintulmetalicsau un amestec deoxizi de fierșimolibdensauvanadiu.De obicei, metanolul și oxigenul sunt reacționați la aproximativ 250–400 °C în prezența oxidului de fier și oxidului de molibden/vanadiu, când se obține formaldehida:[5]
Procesul catalizat de argint necesită temperaturi mai ridicate, de aproximativ 650 °C. Pe lângă reacția prezentată mai sus, formaldehida se mai obține în acest caz și datorită următorului proces dedehidrogenare:
Formaldehida s-ar putea obține și prin oxidareametanului,însă la nivel industrial această metodă nu ar fi foarte practică, deoarece metanul se oxidează mult mai greu decât metanolul.[5]
Proprietăți chimice
[modificare|modificare sursă]Formaldehida este un compus de bază în sinteza organică, fiind un precursor pentru mulți compuși chimici importanți. Prezintă caracterul specificaldehidelor,dar este și mai reactivă.
Auto-condensare și hidratare
[modificare|modificare sursă]Formaldehida, spre deosebire de majoritatea aldehidelor, seoligomerizeazăspontan. Se obțin trimeri, mai exact1,3,5-trioxanul,și polimeri, mai exactparaformaldehida.Au fost izolați mulți oligomeri ciclici. Formaldehida se poate șihidrataformând undiolgeminal,metandiolul,care se condensează formând HO(CH2O)nH.

Oxidare
[modificare|modificare sursă]Formaldehida se oxidează laacid formic,care adesea poate să impurifice recipientele.
Hidroximetilare și clorometilare
[modificare|modificare sursă]Formaldehida este un agentelectrofilbun, reacționând cunucleofiliprecumtioli,aminesau chiaramide,fără necesitatea utilizării de catalizator. Se obțin derivați hidroximetilici care pot fi utilizați în alte reacții. De exemplu, cu aminele se obțin hexahidrotriazine, iar cuhidrogen sulfuratse obținetritian.[9]
În mod analog reacționează și cu apa, dând un produs de hidratare:

În prezența acizilor șiarenelor,formaldehida suferă o reacție desubstituție electrofilă aromatică,cu obținerea unor derivați hidroximetilați:
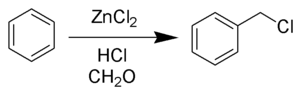
Dacă e utilizeazăacid clorhidric,se obține un derivat de clorometil, conform reacției declorometilare Blanc:
Se pot utiliza șifenoli;dacă sunt substituiți în poziția 4, se obțincalixarene.[10]Se obțin șifenoplaste,precum sunt novolacul șibachelita.
Alte reacții
[modificare|modificare sursă]- Reacția Cannizzarose face cu catalizatori bazici, și produceacid formicșimetanol:

Referințe
[modificare|modificare sursă]- ^abButlerow, A ().Ueber einige Derivate des Jodmethylens[Despre unii derivați ai iodurii de metilen].Annalen der Chemie und Pharmacie.111.pp. 242–252.
- ^abVezi: A. W. Hofmann (14 octombrie 1867)"Zur Kenntnis des Methylaldehyds"([Contribuții] la cunoștințele legate de metilaldehidă),Monatsbericht der Königlich Preussischen Akademie der Wissenschaften zu Berlin,vol. 8, pag. 665–669. Retipărit în:
- A.W. Hofmann, (1868)"Zur Kenntnis des Methylaldehyds",Annalen der Chemie und Pharmacie', vol. 145, no. 3, pag. 357–361.
- A.W. Hofmann (1868)"Zur Kenntnis des Methylaldehyds",Journal für praktische Chemie,vol. 103, no. 1, pag. 246–250.
- ^„Formaldehyde Is Biodegradable, Quickly Broken Down in the Air By Sunlight or By Bacteria in Soil or Water”(Press release). Formaldehyde Panel of the American Chemistry Council..Arhivat dinoriginalla.Accesat în.
- ^abcdKronospan investeste 10 mil. de euro in platforma proprie,2 mai 2007, wall-street.ro, accesat la 23 februarie 2010
- ^abcReuss, Günther; Disteldorf, Walter; Gamer, Armin Otto; Hilt, Albrecht (), „Formaldehyde”,Ullmann's Encyclopedia of Industrial Chemistry,Weinheim: Wiley-VCH,doi:10.1002/14356007.a11_619
- ^Vezi: A.W. Hofmann (5 aprilie 1869)"Beiträge zur Kenntnis des Methylaldehyds",Monatsbericht der Königlich Preussischen Akademie der Wissenschaften zu Berlin,vol.?, pag. 362–372. Retipărit în:
- Hofmann, A.W. ().„Beiträge zur Kenntnis des Methylaldehyds”.Journal für Praktische Chemie.107(1): 414–424.doi:10.1002/prac.18691070161.
- A.W. Hofmann (1869) "Beiträge zur Kenntnis des Methylaldehyds,"Berichte der Deutschen Chemischen Gesellschaft,vol. 2, pag. 152–159.
- ^Read, J. ().Text-Book of Organic Chemistry.London: G Bell & Sons.
- ^Hooker, Jacob M.; Schönberger, Matthias; Schieferstein, Hanno; Fowler, Joanna S. ().„A Simple, Rapid Method for the Preparation of [11C]Formaldehyde”.Angewandte Chemie International Edition.47(32): 5989–5992.doi:10.1002/anie.200800991.PMC2522306
 .PMID18604787.
.PMID18604787.
- ^Bost, R. W.; Constable, E. W. (),„sym-Trithiane”,Org. Synth.,16:81;Collective Volume,2,p. 610
- ^Gutsche, C. D.;Iqbal, M. (),„p-tert-Butylcalix[4]arene”,Org. Synth.;Collective Volume,8,p. 75




