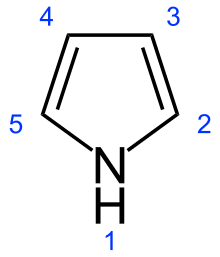
Pirol
| Pirol | |
 | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 109-97-7 |
| ChEMBL | CHEMBL16225 |
| PubChemCID | 8027 |
| Formulă chimică | C₄H₅N[1] |
| Masă molară | 67 u.a.m.[2] |
| Proprietăți | |
| Densitate | 1 g/cm³[3] |
| Punct de topire | −23 °C[3] |
| Punct de fierbere | 130 °C[3] |
| Solubilitate | 47 de gram per kilogrami[4] |
| Presiune de vapori | 1 kilopascal[5][6] |
| Indice de refracție(nD) | 1,5085[3] |
| Viscozitate | dinamică 2 millipascal secondi[7] |
| Sunt folosite unitățileSIși condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modificădate/text | |
Piroluleste uncompus heterociclicaromaticformat dintr-un nucleu cu cinci membri, cuformula chimicăC4H4NH.[8]Este un lichid incolor, volatil, care se înnegrește în contactul cu aerul. Derivații acestuia se numescpiroli,un exemplu fiindN-metilpirolul, C4H4NCH3.
Sinteza
[modificare|modificare sursă]Este produs industrial prin tratareafuranuluicuamoniacîn prezența catalizatorilor acizi solizi, caSiO2șiAl2O3.[9]

Laborator
[modificare|modificare sursă]Metoda Paal-Knorr
[modificare|modificare sursă]
Mult mai bine se pare că reacționează esterii β cetonici cu α nitrozo-cetone.(1)
Metoda Hantzsch
[modificare|modificare sursă]
Are la bază reacția dintre cloroacetonă cu ester acetil acetic și tratarea intermediarului cuamoniac.
Proprietăți fizico-chimice
[modificare|modificare sursă]Lichid incolor cu miros caracteristic. Oreacțiede identificarea a sa este aceea a unei bucățele de lemn tratate cu acid sulfuric și introdusă în atmosferă de vapori de pirol; datorităligninei,lemnul se va colora în verde.
Caracterul aromatic
[modificare|modificare sursă]Caracterul aromatic (aromaticitatea) al pirolului este dat de electronii neparticipanți din orbitalii p cu electronii π ai dublelor legături. Confirmarea caracterului aromatic a pirolului este bazicitatea sa extrem de slabă pKb=0 și aciditatea sa mare pKa= 15, dar și reactivitatea sa crescută față de reactivii nucleofili, reactivitatea fiind în ordinea: pirol >> furan > tiofen > benzen. Sub influența acizilor tari, are loc desfacerea conjugării aromatice, formîndu-se legături duble de tipdienă;datorită acestui fapt polimerizarea are loc prin sinteză dien.
Comportarea chimică
[modificare|modificare sursă]Este o bază extrem de slabă, iar majoritatea reacțiilor chimice sunt extrem de asemănătoare cu fenolii:
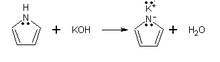
- KOH (hidroxidul de potasiu), formează pirolat de potasiu

- Halogenii au o reacție energică, (se lucrează în soluții diluate de eter sau alcool), formînd compuși tetrahalogenați, sau pentahalogenați de tipul pentacloropirolului.
- Cu reactivul Grignard (CH3MgBr) formînd halogenuri de piriliu
- Nitrarea nu se efectuează în soluții puternic acide(are loc polimerizarea)
- Formilarea are loc cu HCN, HCl/ZnCl2,în mediu de DMF (dimetilformamidă)
Compuși ai pirolului cu nuclee condensate
[modificare|modificare sursă]- Benzopirolulsauindolulcu derivații săi:
- Triptofan(acidul α-amino β-indolil (3)propionic
- Serotonina(5 hidroxi-triptamina)
- Oxindol(2 hidroxi indol) șiindoxilul(3 hidroxi indol)
Compuși naturali cu nuclee pirolice
[modificare|modificare sursă]Bibliografie
[modificare|modificare sursă]- Chimie organică vol II C.D.Nenițescu Ed Tehnică 1958
- http://www.namensreaktionen.de/pyrrol-synthese-hantzsch.html
- http://www.cem.msu.edu/~reusch/VirtualText/heterocy.htm#top2Arhivatîn,laWayback Machine.
Referințe
[modificare|modificare sursă]- ^ab„Pirol”,PYRROLE(în engleză),PubChem,accesat în
- ^„Pirol”,PYRROLE(în engleză),PubChem,accesat în
- ^abcdCRC Handbook of Chemistry and Physics (97th edition)[*],p. 3-478Verificați valoarea
|titlelink=(ajutor) - ^CRC Handbook of Chemistry and Physics (97th edition)[*],p. 5-162Verificați valoarea
|titlelink=(ajutor) - ^CRC Handbook of Chemistry and Physics (97th edition)[*],p. 15-19Verificați valoarea
|titlelink=(ajutor) - ^CRC Handbook of Chemistry and Physics (97th edition)[*],p. 16-29Verificați valoarea
|titlelink=(ajutor) - ^CRC Handbook of Chemistry and Physics (97th edition)[*],p. 6-246Verificați valoarea
|titlelink=(ajutor) - ^Loudon, Marc G. (). „Chemistry of Naphthalene and the Aromatic Heterocycles”.Organic Chemistry(ed. 4th). New York: Oxford University Press. pp. 1135–1136.ISBN0-19-511999-1.
- ^Eroare la citare: Etichetă
<ref>invalidă; niciun text nu a fost furnizat pentru referințele numiteUllmann
