Acid fosforic
| Acid fosforic | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Acid orto-fosforic |
| Identificare | |
| Număr CAS | 7664-38-2 |
| ChEMBL | CHEMBL1187 |
| PubChemCID | 22486802 1004, 22486802 |
| Informații generale | |
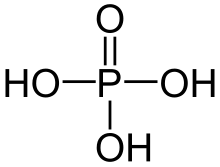
| Formulă chimică | H3PO4 |
| Aspect | solid incolor și insipid |
| Masă molară | 98,00 g/mol |
| Proprietăți | |
| Densitate | 1,834 g/cm3(18 °C) |
| Punct de topire | 42,35 °C |
| Punct de fierbere | 213 °C |
| Solubilitate | solubilitate bună în apă și alcool |
| Presiune de vapori | 0 mm Hg[2] |
| Sunt folosite unitățileSIși condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modificădate/text | |
Acidul fosforicsub forma deacid orto-fosforiceste cel mai frecvent acid întâlnit alfosforului.Forma anhidră a acidului estehigroscopică,fiind un acid mediu cu trei hidroxili liberi, în contact cu acizi mai slabi produce deprotonarea acestora (import de protoni)
- Protonarea legăturiiBprin acidulAH,care este deprotonat.
Prin condensarea acidului se poate forma acidul bifosforic, meta- sau polifosforic.
Obținere[modificare|modificare sursă]
Acid fosforic se poate obține din fosfați, în mod frecvent dinapatitCa5(PO4)3(F, OH, Cl)prin reacție cu acizi mai puternici (acid sulfuricsauacid azotic). Produsele secundare care iau naștere suntgipsCaSO4și acid hexafluorosilicicH2SiF6.
Prin arderea fosforului se obținepentaoxid de fosforP4O10iar prinreacția de hidrolizăse obține acid fosforic.
+ 6→ 4
Proprietăți[modificare|modificare sursă]
Acidul fosforic este un acid cu tărie medie[3],cu trei serii de săruri[4],donor de protoni, cu valorile următoare pentru logaritmul constantelor de ionizare: pKa1= 2,161; pKa2= 7,207 și pKa3= 12,325
Acidul fosforic produce deplasarea acizilor azotic și sulfuric din azotați și sulfați deși e mai slab ca ei dar mai puțin volatil[5].
Avertisment[modificare|modificare sursă]
Acidul fosforic este o soluție caustică, iar în cazul în care acesta intră în contact cu ochii, aceștia trebuie clătiți cu multă apă și e nevoie să se consulte un medic.
Utilizare[modificare|modificare sursă]
Acidul fosforic este folosit la obținerea fosfaților utilizați ca îngrășăminte chimice, sau ca detergenți, ca substanțe pentru îndepărtarea ruginii. În stomatologie se utilizează ca ciment din fosfat dezinc.În concentrații mari acidul este caustic, dar diluat în concentrații reduse este folosit în industria alimentară drept conservant (E 338) sau ca regulator al acidității în băuturile de tip cola.
Rolul biologic[modificare|modificare sursă]
Acidul în biologie joacă un rol important în metabolism ca participant la metabolismul energetic, veziATP(acidul adenozintrifosforic) sauGTP(guanozintrifosfat), făcând parte din acizii nucleici[6]ADNșiARN,numeroasecoenzimeși compuși zaharofosfatici participanți la metabolismul glucidic cum ar fi esterii glucozei, fructozei, etc[7].
Note[modificare|modificare sursă]
Bibliografie[modificare|modificare sursă]
- Constantin D. Albu,Maria Brezeanu,Mică enciclopedie de chimie,Editura Enciclopedică Română, 1974, p. 18-19
- Raluca Ripan,I. Ceteanu,Manual de lucrări practice de chimie anorganică - vol I Metaloizi,Editura de stat didactică și pedagogică,București,1961,p. 357
- Linus Pauling,Chimie generală,Editura Științifică, București, 1972 (traducere din limba engleză)
| |||||||||||||










