Atom
| Atom | |
 Ilustrație a atomului deheliu,reprezentândnucleul atomic(roz) și distribuțianorului electronic(negru). Nucleul (dreapta-sus) de heliu-4 prezintă în realitate simetrie sferică și se aseamănă cu norul electronic, dar aceasta nu se întâmplă și pentru nuclee mai complicate. Bara neagră reprezintă unangstrom(10-10m sau 100 pm). | |
| Clasificare | |
|---|---|
| Cea mai mică diviziune recunoscută a unuielement chimic | |
| Proprietăți | |
| Masa | de la1.67×10−27la4.52×10−25kg |
| Sarcina electrică | zero (neutru) sau diferită de zero pentruioni |
| Diametru | de la 62 pm (He) la 520 pm (Cs) |
| Componente | Electroniși unnucleucompact format dinprotonișineutroni |
Unatomeste cea mai mică unitate constitutivă amaterieicomune care are proprietățile unuielement chimic.[1]Oricesolid,lichid,gazșiplasmăeste compus din atomi neutri sauionizați.Atomii sunt foarte mici; dimensiuni tipice sunt în jur de 100 pm (a zecea miliardime dintr-un metru).[2]Atomii nu au limite bine definite și există diferite moduri de a defini dimensiunea, care dau fiecare valori diferite, dar apropiate ca valoare.
Conformipotezei De Broglie,atomii sunt suficient de mici încât încercarea de a le prezice comportamentul folosind fizica clasică — de exemplu, ca și cum ar fi niște bile de biliard — dă predicții vizibil incorecte din cauzaefectelor cuantice.Prin dezvoltarea fizicii, modelele atomice au încorporat principii cuantice pentru a explica și prezice mai bine acest comportament.
Fiecare atom este format dintr-unnucleuși din unul sau mai mulțielectronilegați de nucleu. Nucleul este format din unul sau mai mulțiprotoniși, de obicei, dintr-un număr similar deneutroni.Protonii și neutronii se numescnucleoni.Peste 99,94% din masa unui atom este concentrată în nucleu. Protonii ausarcină electricăpozitivă, electronii au sarcină electrică negativă, iar neutronii nu au sarcină electrică. Dacă numărul de protoni este egal cu cel de electroni, atunci atomul este neutru din punct de vedere electric. Dacă un atom are mai mulți sau mai puțini electroni decât protoni, atunci acesta are o sarcină totală negativă, respectiv pozitivă, și se numeșteion.
Electronii unui atom sunt atrași de protonii din nucleul atomic de aceastăforță electromagnetică.Protonii și neutronii din nucleu sunt atrași unul de celălalt printr-o altă forță,forța nucleară,care de obicei este mai puternică decât forța electromagnetică de respingere ce acționează între protonii încărcați pozitiv. În anumite circumstanțe, forța electromagnetică de respingere poate deveni mai puternică decât forța nucleară, și nucleonii pot fi astfel scoși din nucleu, lăsând în urmă un element diferit:dezintegrarea nuclearărezultă întransmutație nucleară.
Numărul de protoni din nucleu defineșteelementul chimiccăruia îi aparține atomul: de exemplu, toți atomii decupruconțin 29 de protoni. Numărul de neutroni defineșteizotopulelementului.[3]Numărul de electroni influențează proprietățilemagneticeale unui atom. Atomii se pot atașa de unul sau mai mulți alți atomi prinlegături chimicepentru a formacompuși chimici,cum ar fimoleculele.Capacitatea atomilor de a se asocia și disocia este responsabilă pentru cele mai multe dintre modificările fizice observate în natură, și este subiectul disciplineichimie.
Istoria teoriei atomice[modificare|modificare sursă]
Atomii în filosofie[modificare|modificare sursă]
Ideea că materia este alcătuită din unități discrete este o idee foarte veche, care apare în multe culturi antice, cum ar fi Grecia și India. Cuvântul „atom” a fost inventat de vechii filosofi greci. Cu toate acestea, aceste idei își aveau fundamentul mai mult în raționamentele filozofice și teologice, decât în dovezi și experimente. Ca urmare, vederile lor asupra felului cum arată și cum se comportă atomii erau incorecte. Ele nu puteau nici să convingă pe toată lumea, astfel încât atomismul era doar una dintr-o serie de ipoteze concurente cu privire la natura materiei. Abia în secolul al XIX-lea, ideea a fost îmbrățișată și rafinată de către oamenii de știință, atunci când știința emergentă a chimiei a produs descoperiri pe care numai conceptul de atomi le putea explica.
Primele teorii bazate pe dovezi[modificare|modificare sursă]

La începutul anilor 1800,John Daltona folosit conceptul de atomi pentru a explica de ceelementelereacționează întotdeauna în raporturi de numere întregi mici (legea proporțiilor multiple). De exemplu, există două tipuri deoxid de staniu(d):unul este 88,1% staniu și 11,9% oxigen, iar celălalt este 78,7% staniu și 21,3% oxigen (oxid de staniu (II)și, respectiv,dioxid de staniu(d)). Acest lucru înseamnă că 100 g de staniu se vor combina fie cu 13,5 g, fie cu 27 g de oxigen. 13,5 și 27 sunt în raport de 1:2, un raport de numere întregi mici. Acest model comun în chimie i-a sugerat lui Dalton că elementele care reacționează în număr întregmultiplude unități discrete — cu alte cuvinte, atomi. În cazul oxizilor staniului, un atom de staniu se va combina cu unul sau doi atomi de oxigen.[4]
Dalton credea și că teoria atomică ar putea explica de ce apa absoarbe gaze diferite în proporții diferite. De exemplu, el a constatat că apa absoarbedioxidul de carbonmult mai bine decât absoarbeazotul.[5]Ipoteza lui Dalton se datora diferențelor de masă și configurație între particulele gazelor respective și moleculele de dioxid de carbon (CO2) sunt mai grele și mai mari decât moleculele de azot (N2).
Mișcarea browniană[modificare|modificare sursă]
În 1827,botanistulRobert Browna folosit un microscop pentru a privi granule de praf plutind în apă și a descoperit că ele se mișcau haotic, fenomen care a devenit cunoscut sub numele de „mișcare browniană”.Acest lucru a fost considerat a fi cauzat de faptul că moleculele de apă lovesc granulele. În 1905,Albert Einsteina dovedit realitatea acestor molecule și mișcării lor prin producerea primei analize defizică statisticăamișcării browniene.[6][7][8]Fizicianul francezJean Perrins-a folosit de munca lui Einstein pentru a determina experimental masa și dimensiunile atomilor, confirmând astfel în mod concludentteoria atomică a lui Dalton.[9]
Descoperirea electronului[modificare|modificare sursă]

Sus:Rezultatele așteptate: particulele alfa care trec prin modelul cozonacului cu stafide al atomului cu deviere neglijabilă.
Jos:Rezultatele observate: o mică parte din particulele au fost deviate de sarcina pozitivă concentrată în nucleu.
FizicianulJ. J. Thomsona măsurat masa razelor catodice, arătând că ele sunt formate din particule, dar că acestea sunt de circa 1800 de ori mai ușoare decât cel mai ușor atom, cel dehidrogen.Prin urmare, ei nu erau atomi, ci o nouă particulă, prima particulăsubatomicăce a fost descoperită, și pe care el a numit-o inițial „corpuscul”,și mai târziuelectron,după particulele postulate de cătreJohnstone Stoney(d)în 1874. El a arătat și că ele sunt identice cu particulele emanate de materialelefotoelectriceși de cele radioactive.[10]S-a recunoscut rapid că acestea sunt chiar particulele care transportăcurenții electriciîn firele de metal, și care poartă sarcina electrică negativă în atomi. Thomson a primit în 1906Premiul Nobel în Fizicăpentru acest lucru. Astfel, el a răsturnat credința că atomii sunt particulele finale, indivizibile, de materie.[11]Thomson a și postulat, incorect, că masa redusă a electronilor încărcați negativ este distribuită prin tot atomul printr-o mare uniformă de sarcini pozitive. Acest lucru a devenit cunoscut camodelul „cozonacului cu stafide”.
Descoperirea nucleului[modificare|modificare sursă]
În 1909,Hans GeigerșiErnest Marsden(d),sub conducerea luiErnest Rutherford,au bombardat o folie metalică cuparticule alfapentru a observa cum se împrăștie ele. Ei se așteptau ca toate particulele alfa să treacă direct prin folie, cu minime devieri, deoarece modelul lui Thomson spunea că sarcina în cadrul atomului este atât de difuză încât câmpurile lor electrice nu ar putea afecta prea mult particulele alfa. Cu toate acestea, Geiger și Marsden au constatat că unele particule alfa sunt deviate la unghiuri mai mari de 90°, ceea ce în mod normal ar fi trebuit să fie imposibil potrivit modelului Thomson. Pentru a explica acest lucru, Rutherford a propus că sarcina pozitivă a atomului este concentrată într-un nucleu mic aflat în centrul atomului.[12]
Descoperirea izotopilor[modificare|modificare sursă]
În timp ce experimenta cu produseledezintegrării radioactive,în 1913radiochimistulFrederick Soddya descoperit ceea ce părea să fie mai mult decât un singur tip de atom pe fiecare poziție în tabelul periodic.[13]Termenulizotopa fost inventat de cătreMargaret Toddca nume potrivit pentru diferiți atomi care aparțin aceluiași element. J. J. Thomson a creat o tehnică de separare a tipurilor de atom prin munca sa de gaze ionizate, care ulterior a condus la descoperireaizotopilor stabili(d).[14]
Modelul Bohr[modificare|modificare sursă]

În 1913, fizicianulNiels Bohra propus un model în care electronii unui atom sunt presupuși a orbita în jurul nucleului, dar că pot face acest lucru numai într-o mulțime finită de orbite, și ar putea sări între aceste orbite numai în salturi discrete de energie corespunzătoare absorbției sau radiației unui foton.[15]Această cuantificare a fost folosită pentru a explica de ce orbitele electronilor sunt stabile (având în vedere că, în mod normal, sarcinile accelerate, inclusiv prin mișcare circulară, pierd energie cinetică care emisă sub formă de radiații electromagnetice, veziradiația de sincrotron) și de ce elemente absorb și emit radiații electromagnetice în spectre discrete.[16]
Mai târziu în același an,Henry Moseleya furnizat noi dovezi experimentale în favoarea teoriei luiNiels Bohr.Aceste rezultate au rafinat modelul luiErnest Rutherfordși modelul luiAntonius van den Broek(d),care avansa ideea că atomul conține înnucleuun număr desarcini nucleare(d)pozitive egal cu numărul (atomic) din tabelul periodic. Până la aceste experimente,numărul atomicnu era cunoscut drept cantitate fizică și experimentală. Faptul că este egal cu sarcina atomică rămâne modelul atomic acceptat astăzi.[17]
Legăturile chimice explicate[modificare|modificare sursă]
Legăturile chimicedintre atomi erau acum explicate, deGilbert Newton Lewisîn 1916, ca interacțiuni între electronii care îi compun.[18]Cum se cunoștea în mare măsură căproprietățile chimiceale elementelor se repetă în conformitate cu olege periodică(d),[19]în 1919, chimistul americanIrving Langmuira sugerat că acest lucru ar putea fi explicat prin faptul că electronii dintr-un atom sunt legați sau grupați într-un fel. Se credea că grupurile de electroni ocupă o mulțime deînvelișuri electroniceîn jurul nucleului.[20]
Evoluțiile ulterioare în fizica cuantică[modificare|modificare sursă]
Experimentul Stern–Gerlachdin 1922 a furnizat dovezi suplimentare ale naturii cuantice a atomului. Atunci când un fascicul de atomi de argint a fost trecut printr-un câmp magnetic de formă specială, fasciculul a fost divizat în funcție de direcția momentului cinetic al atomului, denumitspin.Cum această direcție este aleatoare, era de așteptat ca raza să se răspândească într-o linie. În schimb, fasciculul a fost împărțit în două părți, în funcție de orientarea spinului atomic, în sus sau în jos.[21]
În 1924,Louis de Brogliea avansat ipoteza că toate particulele se comportă până la un punct ca niște unde. În 1926,Erwin Schrödingera folosit această idee pentru a dezvolta un model matematic al atomului, care descria electronii caforme de undă(d)tridimensionale, mai degrabă decât ca particule punctiforme. O consecință a folosirii formelor de undă pentru a descrie particulele a fost că este matematic imposibil să se obțină valori precise atât pentrupozițiacât și pentruimpulsulunei particule la un moment dat în timp; acest lucru a devenit cunoscut caprincipiul incertitudinii,și a fost formulat deWerner Heisenbergîn 1926. În acest concept, pentru o anumită precizie în măsurarea unei poziții se poate obține o gamă largă de valori probabile pentru impuls, și vice-versa.[22] Acest model a fost în măsură să explice observațiile comportamentului atomic pe care modelele anterioare nu le puteau explica, cum ar fi anumite șabloane structurale șispectraleale unor atomi mai mari decât hidrogenul. Astfel, s-a renunțat la modelul planetar al atomului în favoarea unuia care descria zoneorbitale atomiceîn jurul nucleului unde un anumit electron este cel mai probabil să fie observat.[23][24]
Descoperirea neutronului[modificare|modificare sursă]
Dezvoltareaspectrometriei de masăa permis măsurarea cu precizie sporită a masei atomilor. Dispozitivul folosește un magnet pentru a îndoi traiectoria unui fascicul de ioni, și cantitatea de deformare este determinată de raportul între masa unui atom și sarcina sa. ChimistulFrancis William Astona folosit acest instrument pentru a arăta că izotopii au mase diferite.Masa atomicăa acestor izotopi variază cu multipli întregi ai unei valori, denumităregula numerelor întregi(d).[25]Explicația pentru acești izotopi diferiți aștepta descoperireaneutronului,o particulă fără sarcină, cu o masă similară cu aprotonului,de către fizicianulJames Chadwickîn 1932. Izotopii au fost atunci explicați ca elemente cu același număr de protoni, dar număr diferit de neutroni în nucleu.[26]
Fisiune, fizica energiilor înalte și materia condensată[modificare|modificare sursă]
În 1938, chimistul GermanOtto Hahn,un student al lui Rutherford, a direcționat neutronii asupra unor atomi de uraniu pentru a obțineelemente transuranice.Experimentele lui chimice au demonstrat, în schimb, producerea debariu.[27]Un an mai târziu,Lise Meitnerși nepotul eiOtto Robert Frischau confirmat că rezultatul lui Hahn a fost de fapt primafisiune nuclearăexperimentală.[28][29]În 1944, Hahn a primitpremiul Nobelpentru Chimie. În ciuda eforturilor lui Hahn, contribuțiile lui Meitner și Frisch nu au fost recunoscute.[30]
În 1950, dezvoltarea unoracceleratoare de particuleșidetectoare de particuleîmbunătățite au permis oamenilor de știință să studieze efectele atomilor în mișcare la energii înalte.[31]Neutronii și protonii s-au dovedit a fihadroni,adică compuși din particule mai mici numitequarkuri.A fost dezvoltatmodelul standard al fizicii particulelor,care până acum a explicat cu succes proprietățile nucleului în ceea ce privește aceste particule sub-atomice și forțele care guvernează interacțiunile lor.[32]
Particulele subatomice[modificare|modificare sursă]
Deși cuvântulatomdenumea inițial o particulă care nu poate fi împărțită în particule mai mici, în utilizarea științifică modernă atomul este compus din diferiteparticule subatomice.Particulele constituente ale unui atom suntelectronii,protoniișineutronii;toate trei suntfermioni.Ca excepție, atomul dehidrogen-1nu are neutroni, iarionul hidronnu are electroni.
Electronul este de departe cel mai puțin masiv din aceste particule, la9.11×10−31kg,cusarcină electricănegativă și cu dimensiune care este prea mică pentru a fi măsurată folosind tehnicile disponibile.[33]Este cea mai ușoară particulă cu masă de repaus pozitivă măsurată. În condiții normale, electronii sunt legați de nucleul încărcat pozitiv prin atracția creată între sarcinile electrice de semn opus. Dacă un atom are mai mulți sau mai puțini electroni decât numărul său atomic, atunci el devine încărcat negativ sau, respectiv, pozitiv în ansamblu; un atom încărcat electric se numesteion.Electronii au fost cunoscuți încă de la sfârșitul secolului al XIX-lea, mai ales datorită luiJ. J. Thomson.
Protonii au o sarcină pozitivă și o masă de 1836 de ori mai mare ca a electronului, la1.6726×10−27kg.Numărul de protoni dintr-un atom se numeștenumăr atomic.Ernest Rutherford(1919) a observat că azotul, sub bombardament de particule alfa, radiază ceea ce părea a fi nuclee de hidrogen. În 1920, el acceptase faptul că nucleul de hidrogen este o particulă distinctă în interiorul atomului, și l-a numitproton.
Neutronii nu au sarcină electrică și au o masă liberă de 1839 de ori mai mare ca masa electronului,[34]sau1.6749×10−27kg,fiind cea mai grea dintre cele trei particule constituente, dar el poate fi redus prinenergia de legătură nucleară(d).Neutronii și protonii (cunoscuți colectiv sub numele denucleoni) au dimensiuni comparabile—de ordinul a2.5×10−15m—deși „suprafața” acestor particule nu este definită clar.[35]Neutronul a fost descoperit în 1932 de către fizicianul englezJames Chadwick.
ÎnModelul Standardal fizicii, electronii sunt cu adevărat particule elementare, fără structură internă. Cu toate acestea, atât protonii cât și neutronii sunt particule compozite alcatuite dinparticule elementarenumitequarkuri.Există două tipuri de quarkuri în atomi, fiecare având o sarcină electrică fracționară. Protonii sunt compuși din douăquarkuri up(d)(fiecare cu sarcina +⅔) și unquark down(d)(cu o sarcină de −⅓. Neutronii constau dintr-un quark up și două quarkuri down. Această distincție explică diferența de masă și de sarcină electrică între cele două particule.[36][37]
Quarkurile sunt ținute împreună deinteracțiunea tare(sau forța nucleară tare), care este mediată degluoni.Protonii și neutronii, la rândul lor, sunt ținuți unul lângă altul în nucleu deforța nucleară,care este un reziduu al unei forțe tari cu proprietăți oarecum diferite în raport cu raza de acțiune. Gluonul este un membru al familiei bosonilor gauge, particule elementare care mediază forțe fizice.[36][37]
Nucleul[modificare|modificare sursă]
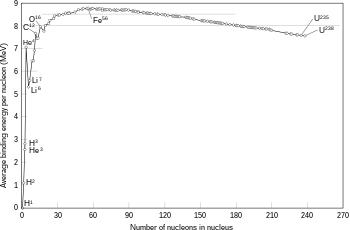
Toți protonii și neutronii legați din atom formează un micnucleu atomic,și sunt denumiți colectivnucleoni.Raza nucleului este aproximativ egală cu 1.073√Afm,undeAeste numărul total de nucleoni.[38]Acesta este mult mai mic decât raza atomului, care este de ordinul a 105fm. Nucleonii sunt legați împreună de un potențial atractiv cu rază mică de acțiune numitforță tare reziduală.La distanțe mai mici de 2,5 fm această forță este mult mai puternică decâtforța electrostaticăcare provoacă respingerea reciprocă a protonilor încărcați pozitiv.[39]
Atomii aceluiașielementau același număr de protoni, numitnumăr atomic.Într-un singur element, numărul de neutroni poate varia, determinândizotopiiacelui element. Numărul total de protoni și neutroni determinănuclidul.Numărul de neutroni relativ la cel de protoni determină stabilitatea nucleului, anumiți izotopi pretându-se ladezintegrare radioactivă.[40]
Protonul, electronul, neutronul sunt clasificați cafermioni.Fermionii se supunprincipiului de excluziune al lui Pauli,care interzice fermioniloridentici,cum ar fi mai mulți protoni, să ocupe aceeași stare cuantică în același timp. Astfel, fiecare proton din nucleu trebuie să ocupe o stare cuantică diferită de toți ceilalți protoni, și același lucru este valabil și pentru neutronii din nucleu și pentru toți electronii din norul de electroni. Cu toate acestea, un proton și un neutron au voie să ocupe aceeași stare cuantică.[41]
Pentru atomii cu un număr atomic scăzut, un nucleu care are mai mulți neutroni decât protoni tinde să scadă la o stare de energie mai mică prin dezintegrare radioactivă, astfel încâtraportul neutroni–protoni(d)să se apropie de unu. Cu toate acestea, pe măsură ce numărul atomic crește, este necesară o proporție mai mare de neutroni pentru compensarea respingerii reciproce dintre protoni. Astfel, nu există nuclee stabile cu număr egal de protoni și neutroni de la numărul atomicZ= 20 (calciu) în sus și, pe măsură ceZcrește, raportul neutroni–protoni al izotopilor stabili crește și el.[41]Izotopul stabil cu cel mai mare raport protoni–neutroni raport esteplumb-208(d)(aproximativ 1,5).
Numărul protonilor și neutronilor în nucleul atomic poate fi modificat, deși acest lucru poate necesita energii foarte înalte din cauza forței tari.Fuziunea nuclearăapare atunci când mai multe particule atomice se unesc pentru a forma un nucleu mai greu, cum ar fi prin ciocnirea la mare energie a două nuclee. De exemplu, în centrul Soarelui protonii necesită energii de 3-10 keV, pentru a depăși respingerea—bariera Coulomb—și a fuziona într-un singur nucleu.[42]Fisiunea nuclearăeste procesul invers, provocarea divizării unui nucleu în două nuclee mai mici—de obicei, prin dezintegrare radioactivă. Nucleul poate fi modificat și prin bombardament cu particule subatomice sau fotoni de mare energie. Dacă aceasta modifică numărul de protoni din nucleu, atomul se transformă într-un alt element chimic.[43][44]
Dacă în urma unei reacții de fuziune masa nucleului este mai mică decât suma maselor particulelor separate, atunci diferența dintre aceste două valori pot fi emise sub forma unui tip de energie utilizabilă (cum ar fi orază gamma,sau energia cinetică a uneiparticule beta), așa cum descrie formula luiAlbert Einsteinaechivalenței masă–energieE=mc2,undemeste pierderea de masă șicesteviteza luminii.Acest deficit face parte dinenergia de legătură(d)a noului nucleu, și este pierderea nerecuperabilă de energie care provoacă particulele sudate una de alta să rămână împreună într-o stare care necesită această energie pentru a se separa.[45]
Fuziunea a două nuclee care creează nuclee mai mari cu numere atomice mai mici decâtfierulșinichelul—un număr total de nucleoni de aproximativ 60—este de obicei unproces exotermcare eliberează mai multă energie decât este necesară pentru a le aduce împreună.[46]Acest proces de eliberare de energie este cel care face ca fuziunea nucleară dinstelesă fie o reacție auto-susținută. Pentru nuclee mai grele, energia de legătură pernucleondin nucleu începe să scadă. Aceasta înseamnă că procesele de fuziune producătoare de nuclee cu numere atomice mai mari decât aproximativ 26 șimase atomicemai mari decât 60 este unproces endoterm.Aceste nuclee mai grele nu pot suferi o reacție de fuziune producătoare de energie care să poată susțineechilibrul hidrostatical unei stele.[41]
Norul de electroni[modificare|modificare sursă]

Electronii dintr-un atom sunt atrași de protonii din nucleu prinforța electromagnetică.Această forță leagă electronii într-o groapă de potențialelectrostaticce înconjoară nucleul mai mic, ceea ce înseamnă că o sursă externă de energie este necesară pentru ca electronul să scape. Cu cât este mai aproape un electron de nucleu, cu atât mai mare forța de atracție. Prin urmare, electronii legați în apropiere de centrul gropii de potențial necesită mai multă energie pentru a scăpa decât cei mai îndepărtați.
Electronii, ca și alte particule, au proprietăți atât departiculă cât și de undă.Norul electronic este o regiune în interiorul gropii de potențial, unde fiecare electron formează un fel deundă staționarătridimensională—o formă de undă care nu se mișcă în raport cu nucleul. Acest comportament este definit de unorbital atomic,o funcție matematică care caracterizează probabilitatea ca un electron să pară a fi într-un anumit loc, atunci când poziția sa este măsurată.[47]Doar o mulțime discretă (saucuantificată) de orbitali există în jurul nucleului, întrucât alte modele posibile de undă se degradează rapid într-o formă mai stabilă.[48]Orbitalii pot avea una sau mai multe structuri de inel sau de nod, și diferă unele de altele în dimensiune, formă și orientare.[49]

Fiecare orbital atomic corespunde unui anumitnivel de energieal electronului. Electronul își poate schimba starea la un nivel superior de energie prin absorbția unuifotoncu energie suficientă pentru a-l trece într-o nouă stare cuantică. De asemenea, prin intermediulemisiei spontane,un electron dintr-o stare mai mare de energie poate scădea la o stare de energie mai mică, în timp ce radiază energia în exces sub forma unui foton. Aceste valori caracteristice ale energiei, definite prin diferențele de energie ale stărilor cuantice, sunt responsabile pentruliniile spectrale atomice.[48]
Cantitatea de energie necesară pentru a elimina sau adăuga un electron—energia de legătură a electronului—este cu mult mai mică decâtenergia de legătură a nucleonilor(d).De exemplu, este nevoie de doar 13.6 eV pentru a scoate un electron dinstarea de bază(d)dintr-un atom de hidrogen,[50]comparativ cu 2.23milioane deeV pentru divizarea unui nucleu dedeuteriu.[51]Atomii sunt neutri din punct de vedereelectricdacă au un număr egal de protoni și electroni. Atomii care au un deficit sau un surplus de electroni se numescioni.Electronii care sunt aflați mai departe de nucleu pot fi transferați la alți atomi din apropiere sau puși în comun între atomi. Prin acest mecanism, atomii sunt în măsură să formezelegăturiîn cadrulmoleculelorși în alte tipuri decompuși chimici,cum ar fi rețelele decristaleioniceșicovalente.[52]
Proprietăți[modificare|modificare sursă]
Proprietăți nucleare[modificare|modificare sursă]
Prin definiție, orice doi atomi cu același număr deprotoniîn nucleele lor aparțin aceluiașielement chimic.Atomii cu același număr de protoni, dar număr diferit deneutronisunt izotopi diferiți ai aceluiași element. De exemplu, atomii de hidrogen admit exact un proton, dar există izotopi fără neutroni (hidrogen-1(d),de departe, cea mai comună formă,[53]numit și protiu), un neutron (deuteriu), doi neutroni (tritiu) și mai mult de doi neutroni. Elementele cunoscute formează un set de numere atomice, de la elementul cu un singur proton,hidrogenul,până la elementul cu 118 protoniununocțiu.[54]Toți izotopii cunoscuți ai elementelor cu numărul atomic mai mare de 82 sunt radioactivi.[55][56]
Circa 339 nuclizi apar în mod natural pePământ,[57]din care 254 (aproximativ 75%) nu au fost observați a se degrada, și sunt menționați ca „izotopi stabili(d)”.Cu toate acestea, doar 90 din acești nuclizi sunt stabili la toate degradările, chiar și teoretic. Alți 164 (ajungând la un total de 254) nu au fost observați a se degrada, chiar dacă în teorie este posibil din punct de vedere energetic. Aceștia sunt oficial clasificați ca fiind „stabili”. Alți 34 de nuclizi radioactivi au timp de înjumătățire mai mare de 80 de milioane de ani și au viață suficient de lungă încât să fi fost prezenți la naștereasistemului solar.Această colecție de 288 de nuclizi este cunoscută sub numele denuclizi primordiali.În sfârșit, sunt cunoscuți încă 51 de nuclizi cu viață scurtă care pot apărea în mod natural, ca produse ale descompunerii nuclizilor primordiali (cum ar firadiuldinuraniu), sau altfel ca produse ale proceselor energetice naturale de pe Pământ, cum ar fi bombardamentul cu raze cosmice (de exemplu, carbonul-14).[58][a]
Pentru 80 de elemente chimice, există cel puțin unizotop stabil(d).Ca o regulă, există doar câțiva izotopi stabili pentru fiecare dintre aceste elemente, valoarea medie fiind de 3,2 izotopi per element. Douăzeci și șase de elemente au numai un singur izotop stabil, în timp ce cel mai mare număr de izotopi observat pentru orice element este de zece, pentru elementulstaniu.Elementele43,61,și toate elementele cu numere de la83în sus nu au izotopi stabili.[59][necesită pagina]
Stabilitatea izotopilor este afectată de raportul dintre protoni și neutroni, și de prezența unor „numere magice” de neutroni sau protoni, care reprezintă învelișuri cuantice închise și pline. Aceste învelișuri cuantice corespund unui set de niveluri de energie în cadrulmodelului cu învelișuri(d)al nucleului; învelișuri pline, cum ar fi învelișul plin de 50 de protoni pentru staniu, conferă stabilitate neobișnuită nuclidului. Din cele 254 de nuclee stabile cunoscute, doar patru au atât un număr impar de protonișiun număr impar de neutroni:hidrogen-2(deuteriu),litiu-6(d),bor-10șiazot-14(d).De asemenea, doar patru nuclizi naturali, radioactivi, par–par au un timp de înjumătățire de peste un miliard de ani:potasiu-40(d),vanadiu-50(d),lantan-138(d)șitantal-180m(d).Majoritatea nucleelor impar–impar sunt foarte instabile în raport cudezintegrarea beta,deoarece produsele de descompunere sunt par–par, și, prin urmare, mai puternic legate, din cauzaefectelor împerecherilor nucleare(d).[59][necesită pagina]
Masa[modificare|modificare sursă]
Majoritatea masei unui atom provine de la protoni și neutroni. Numărul total al acestor particule (numite „nucleoni” ) într-un anumit atom se numeștenumărul de masă.Este un număr întreg pozitiv și adimensional (în loc de a avea dimensiunea de masă), pentru că exprimă un număr. Un exemplu de utilizare a unui numărul de masă este „carbon-12,” care are 12 nucleoni (șase protoni și șase neutroni).
Masa unui atom în repaus(d)este de multe ori exprimată folosindunitatea unificată atomică de masă(u), numită și dalton (Da). Această unitate este definită ca o a douăsprezecea parte din masa liberă a unui atom neutru decarbon-12(d),care este de aproximativ1.66×10−27kg.[60]Hidrogen-1(cel mai ușor izotop de hidrogen, care este și nuclidul cu cea mai mică masă) are 1.007825 u.[61]Valoarea acestui număr se numeștemasă atomică.Un anumit atom are o masă atomică aproximativ egală (cu aproximație de 1%) cu numărul de masă înmulțit cu unitatea atomică de masă (de exemplu masa azotului-14 este de aproximativ 14 u). Cu toate acestea, acest număr nu va fi exact un număr întreg, cu excepția carbonului-12 (vezi mai jos).[62]Cel mai greuatom stabileste plumb-208,[55]cu o masă de207.9766521u.[63]
Deoarece chiar și cei mai masivi atomi sunt mult prea ușori pentru a lucra cu ei în mod direct, chimiștii folosesc în schimb unitateamol.Un mol de atomi de orice element are întotdeauna același număr de atomi (circa6.022×1023). Acest număr a fost ales astfel încât, dacă un element are o masă atomică de 1 u, un mol de atomi de acest element are o masă de aproape un gram. Pentru definireaunității atomice de masă,fiecare atom de carbon-12 are o masă atomică de exact 12 u, și deci un mol de atomi de carbon-12 cântărește exact 0,012 kg.[60]
Forma și mărimea[modificare|modificare sursă]
Atomilor le lipsește o limită exterioară bine definită, astfel încât dimensiunile lor sunt de obicei descrise în termeni derază atomică.Aceasta este o măsură a distanței pe care se întinde norul electronic de la nucleu.[2]Acest lucru presupune însă că atomul ar prezenta o formă sferică, ceea ce este adevărat doar pentru atomi în vid sau în spațiul liber. Raze atomice se pot calcula din distanțele între două nuclee atunci când doi atomi sunt uniți într-olegătură chimică.Raza variază în funcție de locația unui atom în structura atomică, tipul de legătură chimică, numărul atomilor vecini (numărul de coordonare) și proprietateamecanică cuanticănumităspin.[64]Întabelul periodical elementelor, dimensiunea atomilor tinde să crească atunci când ne deplasăm în jos pe coloane, dar să scadă atunci când ne deplasăm pe rânduri (de la stânga la dreapta).[65]Ca urmare, cel mai mic atom este cel de heliu, cu o rază de 32pm,în timp ce unul dintre cele mai mari este cel decesiu,cu 225 pm.[66]
Atunci când este supus unor forțe externe, cum ar ficâmpurile electrice,forma unui atom se poate abate de lasimetria sferică.Deformarea depinde de mărimea câmpului și de tipul de orbital al electronilor exteriori, așa cum arată unele considerații deteoria grupurilor.Abateri asferice ar putea fi provocate de exemplu încristale,unde câmpuri electrice mari pot apărea în puncte dejoasă simetriea rețelei. S-a demonstrat că pot apărea deformărielipsoidalesemnificative la ionii de sulf[67]și ai altorcalcogeni[68]în compușii de tipulpiritei.
Dimensiunile atomice sunt de mii de ori mai mici decât lungimile de undă aleluminii(400-700nm), astfel încât aceștia nu pot fi văzuți folosind unmicroscop optic.Atomi individuali pot fi totuși observați folosind unmicroscop de scanare cu efect tunel.Pentru a înțelege cât de mic este un atom, ne putem gândi că un fir de păr uman tipic are aproximativ 1 milion de atomi de carbon lățime.[69]O singură picătură de apă conține aproximativ 2triliarde(d)(2×1021) de atomi de oxigen, și de două ori mai mulți atomi de hidrogen..[70]Un singurdiamantde un carat, cu o masă de2×10−4kgconține aproximativ 10 triliarde (1022) de atomi decarbon.[b]Dacă un măr ar fi mărit la dimensiunea Pământului, atunci atomii din măr ar fi aproximativ de dimensiunea mărului original.[71]
Dezintegrare radioactivă[modificare|modificare sursă]

Fiecare element are unul sau mai mulți izotopi cu nuclee instabile care sunt supuse dezintegrării radioactive, făcând nucleul să emită particule sau radiații electromagnetice. Radioactivitatea poate apărea atunci când raza unui nucleu este mare în comparație cu raza de acțiune a forței tari, care acționează numai pe distanțe de ordinul a 1 fm.[72]
Cele mai frecvente forme de dezintegrare radioactivă sunt:[73][74]
- Dezintegrarea alfa:acest proces este cauzat atunci când nucleul emite o particulă alfa, adică un nucleu de heliu, constând din doi protoni și doi neutroni. Rezultatul emisiei este un element nou, cu unnumăr atomicmai mic.
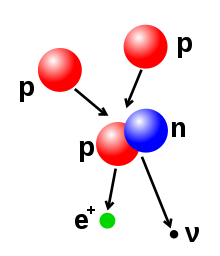
- Dezintegrarea beta(șicapturarea de electroni(d)): aceste procese sunt reglementate deforța slabă,și rezultă din transformarea unui neutron într-un proton, sau a unui proton într-un neutron. Tranziția neutron-proton este însoțită de emisia unui electron și a unuiantineutrino,în timp ce o tranziție proton-neutron (cu excepția capturării de electroni) provoacă emisia unuipozitronși a unuineutrino.Emisiile de electroni sau pozitroni sunt numite particule beta. Dezintegrarea beta fie crește, fie scade numărul atomic al nucleului cu unu. Capturarea de electroni este mult mai comună decât emisia de pozitroni, pentru că necesită mai puțină energie. În acest tip de degradare, nucleul absoarbe un electron mai degrabă decât să emită un pozitron. În acest proces, se emite însă un neutrino este, și un proton se transformă în neutron.
- Dezintegrare gamma:acest proces rezultă dintr-o schimbare în nivelul de energie al nucleului la o stare de energie inferioară, care se soldează cu emisie de radiații electromagnetice. Starea excitată a unui nucleu care produce emisie gamma apare de obicei în urma emisiei unei particule Alpha sau beta. Astfel, dezintegrarea gama urmează de obicei după dezintegrarea alfa sau beta.
Alte tipuri mai rare dedezintegrare radioactivăsunt ejecția de neutroni sau protoni sau de grupuri denucleonidin nucleu, sau mai multeparticule beta.O emisie gamma analogă care permite ca nucleele excitate să piardă energie într-un mod diferit, esteconversia internă(d)— un proces care produce electroni cu viteză mare care nu sunt radiații beta, urmați de producerea de fotoni cu energie înaltă, care nu sunt radiații gamma. Câteva nuclee mari pot exploda în două sau mai multe fragmente încărcate electric de diferite mase, plus câțiva neutroni, într-o degradare numităfisiune nuclearăspontană.
Fiecareizotop radioactivare o perioadă de timp ce caracterizează descompunerea—timpul de înjumătățire—care este determinat de cantitatea de timp necesară pentru ca o jumătate dintr-un eșantion să se dezintegreze. Acesta este un proces descădere exponențială(d)care scade în mod constant proporția de izotop rămasă cu 50% la fiecare timp de înjumătățire. Prin urmare, după ce se scurge de două ori timpul de înjumătățire, va mai rămâne 25% din izotopul prezent, și așa mai departe.[72]
Momentul magnetic[modificare|modificare sursă]
Particulele elementare posedă o proprietate mecanică cuantică intrinsecă numităspin.Acest lucru este analog cumomentul cinetical unui obiect care se rotește în jurulcentrului de masă,deși, strict vorbind, aceste particule sunt considerate a fi punctiforme și nu mai poate fi vorba despre o rotație a lor. Spinul este măsurat în unități deconstantă Planckredusă (ħ), electronii, protonii și neutronii toate având spin ½ ħ, sau „spin-½”. Într-un atom, electronii în mișcare în jurulnucleuluiposedă unmoment cineticorbital în plus față de spin, în timp ce nucleul în sine posedă moment cinetic datorită spinului nuclear.[75]
Câmpul magneticprodus de un atom—momentul său magnetic—este determinat de aceste diferite forme de moment cinetic, la fel cum un obiect încărcat electric produce de regulă un câmp magnetic. Cu toate acestea, cea mai importantă contribuție vine de la spinul electronilor. Datorită naturii electronilor de a respectaprincipiul de excluziune al lui Pauli,conform căruia doi electroni nu se pot găsi în aceeașistare cuantică,electronii legați fac pereche, fiecare membru al perechii într-un spin cu direcția în sus și celălalt cu spinul în jos. Astfel, aceste rotiri se anulează reciproc, reducând total momentul de dipol magnetic la zero în unii atomi cu număr par de electroni.[76]
În elementeleferomagnetice,cum ar fi fierul, cobaltul și nichelul, un număr impar de electroni conduce la existența unui electron nepereche și la prezența unui moment magnetic net. Orbitalii atomilor vecini se suprapun și se atinge o stare de energie mai joasă atunci când spinii electronilor nepereche sunt aliniați unul cu celălalt, proces spontan cunoscut sub numele deinteracțiune de schimb(d).Când momentele magnetice ale atomilor materialelor feromagnetice sunt aliniate, materialul poate produce un câmp măsurabil la scară macroscopică.Materialele paramagneticeau atomi cu momentele magnetice întreptate în direcții aleatoare atunci când nu este prezent niciun câmp magnetic, care se aliniază în prezența unui câmp.[76][77]
Nucleul unui atom nu va avea niciun spin atunci când are atât număr par de neutroni cât și de protoni, dar în alte cazuri cu numere impare, nucleul poate avea spin. În mod normal, nucleele cu spin sunt aliniate în direcții aleatoare, din cauzaechilibrului termic(d).Cu toate acestea, pentru anumite elemente (cum ar fixenon-129) este posibil să sepolarizeze(d)o proporție semnificativă din stările de spin nuclear, astfel încât acestea să fie aliniate în aceeași direcție—o condiție numităhiperpolarizare(d).Aceasta are importante aplicații înimagistica prin rezonanță magnetică.[78][79]
Nivelul de energie[modificare|modificare sursă]

Energia potențialăa unui electron într-un atom estenegativă,dependența ei față de poziție ajungând la un minim (valoare absolutămaximă) în interiorul nucleului, și dispărând atunci când distanța de la nucleutinde la infinit,aproximativinvers proporționalcu distanța. În modelul cuantic-mecanic, un electron legat poate ocupa doar o mulțime destăricentrat pe nucleu, și fiecare stare corespunde unui anumitnivel de energie;veziecuația lui Schrödinger independentă de timppentru o explicație teoretică. Un nivel de energie poate fi măsurat princantitatea de energie necesară pentru a dezlegaelectronul din atom, și este, de obicei, dată în unități deelectronvolți(eV). Cel mai mic nivel de energie al unui electron legat se numește stare fundamentală, saustare staționară,în timp ce o tranziție a unui electron la un nivel superior se soldează cu o stare excitată.[80]Energia electronilor crește atunci cândncrește, deoarece distanța (medie) față de nucleu crește. Dependența energiei de ℓ este cauzată nu depotențialul electrostatical nucleului, ci prin interacțiunea între electroni.
Pentru ca un electron sătreacă de la o stare la alta(d),de exemplu de la starea fundamentală la primul nivel excitat (ionizare), acesta trebuie să absoarbă sau să emită unfotonla o energie egală cu diferența de energie potențială între aceste niveluri, conform modelului luiNiels Bohr,care poate fi calculată cu precizie prinecuația lui Schrödinger. Electronii trec între orbitali într-o manieră similară particulelor. De exemplu, dacă un singur foton ar lovi electronii, numai un singur electron și-ar schimba starea ca răspuns la foton; a se vedeaproprietățile electronului.
Energia emisă de un foton este proporțională cufrecvențasa, astfel încât aceste niveluri de energie specifice apar ca benzi distincte în cadrulspectrului electromagnetic.[81]Fiecare element are un spectru caracteristic care depinde de sarcina nucleară, subînvelișurile ocupate de electroni, interacțiunile electromagnetice dintre electroni și de alți factori.[82]

Atunci când unspectru continuu de energieeste trecut printr-un gaz sau printr-oplasmă,unii dintre fotoni sunt absorbiți de atomi, făcându-i pe electroni să-și schimbe nivelul de energie. Acești electroni excitați care rămân legați de atom emit spontan această energie sub forma unui foton, care se îndreaptă într-o direcție oarecare, și astfel coboară înapoi la un nivel inferior de energie. Astfel, atomii se comportă ca un filtru care formează o serie debenzi de absorbție(d)întunecate în producția de energie. (Un observator care vizualizează atomii dintr-o perspectivă care nu include spectrul continuu în fundal vede, în schimb, o serie delinii de emisieproduse de fotonii emiși de către atomi.) Măsurătorilespectroscopiceale intensității și lățimii liniilor spectrale atomice permit identificarea compoziției și proprietăților fizice ale unei substanțe.[83]
Examinarea atentă a liniilor spectrale relevă că unele prezintă o divizare astructurii fine(d).Acest lucru se întâmplă din cauzainteracțiunii spin–orbită(d),care este o interacțiune între spin și mișcarea electronului cel mai exterior.[84]Când un atom se află într-un câmp magnetic exterior, liniile spectrale devin împărțite în trei sau mai multe componente, fenomen numitefect Zeeman.Acest lucru este cauzat de interacțiunea câmpului magnetic cu momentul magnetic al atomului și al electronilor săi. Unii atomi pot avea mai multeconfigurații de electronicu același nivel de energie, care apar astfel ca o singură linie spectrală. Interacțiunea câmpului magnetic cu atom deplasează aceste configurații de electroni la niveluri de energie ușor diferite, de unde rezultă mai multe linii spectrale.[85]Prezența unuicâmp electricextern poate provoca un nivel comparabil de divizare și deplasare a liniilor spectrale prin modificarea nivelurilor de energie ale electronilor, un fenomen numitefect Stark(d).[86]
Dacă un electron legat este într-o stare excitată, un foton care interacționează cu el și are energie corespunzătoare poate provocao emisie stimulatăa unui foton cu nivelul de energie potrivit. Pentru ca acest lucru să apară, electronul trebuie să coboare la o stare de energie mai mică, astfel încât diferența de energie să fie aceeași cu energia de fotonului cu care interacționează. Fotonii emiși și fotonii care interacționează pornesc apoi în paralel și în fază; adică, modelele de undă ale celor doi fotoni sunt sincronizate. Această proprietate fizică este folosită pentru a facelasere,care pot emite fascicule coerente de lumină a căror energie este într-o bandă de frecvență îngustă.[87]
Valența și comportamentul legăturilor[modificare|modificare sursă]
Valența este puterea de combinare a unui element. Aceasta este egală cu numărul de atomi de hidrogen cu care atomul s-ar putea combina sau pe care i-ar putea dizloca în formarea de compuși.[88]Învelișul exterior de electroni al unui atom în starea sa necombinată este cunoscut sub denumirea destrat de valență,iar electronii de la acel nivel se numescelectroni de valență.Numărul de electroni de valență determină comportamentul atomului înlegăturăcu alți atomi. Atomii au tendința de areacționa chimicunii cu alții într-un mod care le-ar umple (sau le-ar goli) stratul de valență.[89]De exemplu, transferul unui singur electron între atomi este o aproximare utilă pentru legăturile care se formează între atomi care au un singur electron mai mult decât stratul exterior complet, și un altul căruia îi lipsește un electron pentru a-și completa ultimul strat, astfel cum apare în compusulclorură de sodiuși în alte săruri ionice. Cu toate acestea, multe elemente prezintă valențe multiple, sau tendința de a pune în comun diferite numere de electroni în cadrul diferiților compuși. Astfel,legăturile chimicedintre aceste elemente iau multe forme de punere în comun de electroni, care sunt mai mult decât simple transferuri de electroni. Exemplele includ elementul carbon șicompușii organici.[90]
Elementele chimicesunt adesea afișate într-untabel periodiccare pune în evidență proprietăți chimice recurente. Elementele cu același număr de electroni de valență formează un grup care este aliniat pe aceeași coloană a tabelului. (Rândurile orizontale corespund cu umplerea unui anume nivel cuantic de electroni.) Elementele din extremitatea dreaptă au stratul exterior complet ocupat cu electroni, ceea ce le face să fie inerte din punct de vedere chimic. Ele se numescgaze nobile.[91][92]
Stări de agregare[modificare|modificare sursă]

Cantitățile de atomi se găsesc în diferite stări ale materiei care depind de condițiile fizice, cum ar fitemperaturașipresiunea.Variind aceste condiții, materialele pot trece între stărilesolidă,lichidă,gazoasăși de plasmă.[93]În cadrul unei stări, un material poate exista înforme alotropicediferite. Un exemplu în acest sens îl constituie carbonul solid, care poate exista și amorf, cagrafit,și cristalizat, cadiamant.[94]Și gazele pot avea forme alotropice multiple, precumdioxigenul(d)șiozonul.
La temperaturi apropiate dezero absolut,atomii pot forma uncondensat Bose–Einstein,punct în care efectele mecanicii cuantice, care sunt de obicei observate numai la scară atomică, devin evidente la scară macroscopică.[95][96]Această colecție suprarăcită de atomi se comportă ca un singur superatom, care poate permite verificări fundamentale ale comportamentelor din mecanica cuantică.[97]
Identificarea[modificare|modificare sursă]

Microscop cu scanare cu efect tuneleste un dispozitiv pentru vizualizarea suprafețelor la nivel atomic. El utilizează fenomenul detunelare cuantică,care permite particulelor să treacă printr-o barieră care în mod normal ar fi de netrecut. Electronii tunelează prin vid între doi electrozi metalici planari, pe fiecare dintre care se află un atomadsorbit,furnizând o densitate de curent de tunelare care poate fi măsurată. Scanarea unui atom când trece pe lângă celălalt (eșantion) permite trasarea deplasării primului în raport cu separarea laterală pentru un curent constant. Calculul arată măsura în care sunt vizibile imaginile obținute cu microscopul cu efect tunel. Se confirmă faptul că pentru polarizare redusă, microscopul prezintă dimensiunile mediate spațial ale orbitalilor electronici prin niveluri de energie strâns apropiate—nivelul Fermi(d)densitatea locală de stări(d).[98][99]
Un atom poate fiionizatprin eliminarea unuia dintre electronii săi.Sarcina electricădetermină curbarea traiectoriei unui atom atunci când trece printr-uncâmp magnetic.Raza cu care traiectoria unui ion este transformată de către câmpul magnetic este determinată de masa atomului.Spectrometrul de masăfolosește acest principiu pentru a măsuraraportul masă-sarcină electrică(d)al ionilor. Dacă eșantionul conține mai mulți izotopi, spectrometrul de masă poate determina proporția fiecărui izotop în eșantion prin măsurarea intensității diferitelor fascicule de ioni. Printre tehnicile de vaporizare a atomilor se numărăspectroscopia emisiilor atomice cu plasmă cuplată inductiv(d)și despectrometria de masă cu plasmă cuplată inductiv(d),ambele utilizând plasmă pentru a vaporiza eșantioanele pentru analiză.[100]
O metodă selectivă spațial estespectroscopia pierderilor de energie electronică(d),care măsoară pierderea de energie a unuifascicul de electroniîntr-unmicroscop electronic cu transmisie(d)atunci când interacționează cu o parte dintr-un eșantion.Tomograful cu sondă atomică(d)are o rezoluție sub-nanometrică în 3-D și poate identifica din punct de vedere chimic atomi individuali folosind spectrometria timpului-de-zbor.[101]
Spectrelestărilor excitate(d)pot fi utilizate pentru a analiza compoziția atomică a unorsteleîndepărtate. Anumitelungimi de undăale luminii cuprinse în lumina observată de la stele pot fi separate și legate de tranzițiile cuantizate în atomii liberi de gaz. Aceste culori pot fi reproduse folosind olampă cu descărcare în gaz(d)care conține același element.[102]Heliula fost descoperit în acest fel în spectrul Soarelui cu 23 de ani înainte de a fi identificat pe Pământ.[103]
Originea și starea actuală[modificare|modificare sursă]
Atomii formează aproximativ 4% din totalul densității de energie dinUniversul observabil,cu o densitate medie de aproximativ 0,25 atomi/m3.[104]Într-o galaxie, cum ar fiCalea Lactee,atomii au o concentrație mult mai mare, densitatea de materie dinmediul interstelar(ISM) variind de la 105la 109atomi/m3.[105]Soarele este considerat a fi în interiorulBulei Locale,o regiune de gaze puternic ionizate, deci densitatea în regiunea Soarelui este de numai aproximativ 103atomi/m3.[106]Stelele se formează din nori denși în mediul interstelar, și procesele evolutive ale stelelor au ca urmare îmbogățirea constantă a acestui mediu cu elemente mult mai masive decât hidrogenul și heliul. Până la 95% din atomii din Calea Lactee sunt concentrați în interiorul stelelor, iar masa totală a atomilor formează aproximativ 10% din masa galaxiei.[107](restul de masă este omaterie întunecatănecunoscută.)[108]
Formarea[modificare|modificare sursă]
Se crede că electronii existau în Univers din primele etape aleBig Bangului.Nucleele atomice se formează în reacțiile denucleosinteză.În aproximativ trei minutenucleosinteza Big Banguluia produs mare parte dinheliul,litiul,șideuteriuldin Univers, și, probabil, o parte dinberiliușibor.[109][110][111]
Omniprezența și stabilitatea atomilor se bazează peenergia lor de legătură(d),ceea ce înseamnă că un atom are o energie mai mică decât un sistem format din nucleu și electroni nelegați. Undetemperaturaeste mult mai mare decâtpotențialul de ionizare,materia există sub formă deplasmă—un gaz de ioni încărcați pozitiv (posibil chiar nuclee goale) și electroni. Atunci când temperatura scade sub potențialul de ionizare, atomii devin favorabilidin punct de vedere statistic.Atomii (completați cu electroni legați) au ajuns să domineparticulele încărcatede la 380.000 de ani după Big Bang—o epocă numitărecombinare(d),atunci când Universul în expansiune s-a răcit suficient pentru a permite electronilor să se atașeze de nuclee.[112]
De la Big Bang, care nu a produs nicicarbon,nicielemente mai grele,nucleele atomice au fost combinate însteleprin procesul defuziune nuclearăpentru a produce mai multheliu,și (prin intermediulprocesului triplu alfa) secvența de elemente de la carbon până lafier.[113]
Izotopii, cum ar fi litiu-6, precum și unii izotopi de beriliu și bor sunt generați în spațiu prinspalația razelor cosmice(d).[114]Acest lucru se întâmplă atunci când un proton cu energie mare lovește un nucleu atomic, provocând extragerea unui număr mare de nucleoni.
Elementele mai grele decât fierul s-au produs însupernoveprinprocesul R(d)și înstelele gigante din ramura asimptoticăprinprocesul S,care implică capturarea de neutroni de către nucleele atomice.[115]Elemente cum ar fiplumbuls-au format în mare parte prin dezintegrarea radioactivă a elementelor mai grele.[116]
Pământul[modificare|modificare sursă]
Cei mai mulți dintre atomii care alcătuiescPământulși pe locuitorii săi au fost prezenți, în forma lor actuală, înnebuloasacare s-a contractat dintr-unnor molecularpentru a formaSistemul Solar.Restul sunt rezultatul dezintegrării radioactive, și proporția lor relativă poate fi folosită pentru a determinavârsta Pământuluiprindatare radiometrică(d).[117][118]Majoritateaheliuluidin scoarța Pământului (aproximativ 99% din heliul din sondele de gaze, așa cum arată abundența mai scăzută deheliu-3(d)) este un produs aldezintegrării alfa.[119]
Există pe Pământ câteva urme de atomi care nu au fost prezenți de la început (adică „neprimordiali” ), și care nici nu sunt rezultatul dezintegrărilor radioactive.Carbon-14este generat continuu de razele cosmice în atmosferă.[120]Unii atomi de pe Pământ au fost generați artificial, fie în mod deliberat, fie ca produse ale reactoarelor sau exploziilor nucleare.[121][122]Dintreelementele transuranice—cele cu numere atomice mai mari decât 92—numaiplutoniulșineptuniulapar în mod natural pe Pământ.[123][124]Elementele transuranice au durate de viață radioactivă mai scurte decât vârsta actuală a Pământului[125]și, astfel, cantitățile identificabile din aceste elemente s-au descompus demult, cu excepția unor urme deplutoniu-244(d)depuse probabil de praful cosmic.[126]Zăcămintele naturale de plutoniu și neptuniu sunt produse princapturare de neutroni(d)în minereul de uraniu.[127]
Pământul conține aproximativ1.33×1050atomi.[128]Deși există un număr mic de atomi independenți aigazelor nobile,cum ar fiargon,neon,heliu,99% dinatmosferăeste legată sub formă de molecule, inclusivdioxid de carbonșimolecule diatomicedeoxigenșiazot.La suprafața Pământului, o majoritate covârșitoare a atomilor se combină pentru a forma diferiți compuși, inclusivapa,sarea,silicațiișioxizii.Atomii se pot combina pentru a crea și materiale care nu sunt alcătuite din molecule discrete, inclusivcristalelichide și solide saumetale.[129][130]Această materie atomică formează aranjamente în rețea cărora le lipsește tipul de ordine întreruptă la scară mică asociat materiei moleculare.[131]
Forme rare și teoretice[modificare|modificare sursă]
Elemente supergrele[modificare|modificare sursă]
În timp ce izotopii cu numere atomice mai mari decâtplumbul(82) sunt cunoscuți a fi radioactivi, a fost propusă o „insulă de stabilitate(d)”pentru unele elemente cu numere atomice mai mari de 103. Acesteelemente supergrelepot avea un nucleu relativ stabil în raport cu dezintegrarea radioactivă.[132]Cel mai probabil candidat pentru un atom supergreu stabil,unbihexium,are 126 de protoni și 184 de neutroni.[133]
Materie exotică[modificare|modificare sursă]
Fiecare particulă de materie are o particulă corespondentă deantimateriecu sarcină electrică opusă. Astfel,pozitroniisuntantielectroni,încărcați pozitiv, iarantiprotoniisunt echivalentul unorprotonicu sarcină negativă. Atunci când materia și antimateria se întâlnesc, ele se anihilează reciproc. Din acest motiv și din cauza unui dezechilibru între numărul de particule de materie și cele de antimaterie, acestea din urmă sunt rare în univers. Primele cauze ale acestui dezechilibru nu sunt încă pe deplin înțelese, deși teoriilebariogenezei(d)pot oferi o explicație. Ca urmare, nu a fost descoperită în natură antimaterie.[134][135]Cu toate acestea, în 1996 echivalentul din antimaterie al atomului de hidrogen (antihidrogen) a fost sintetizat la laboratorulCERNdinGeneva.[136][137]
Alți atomi exotici au fost creați prin înlocuirea unuia din protoni, neutroni sau electroni cu alte particule cu aceeași sarcină electrică. De exemplu, un electron poate fi înlocuit cu unmiuonmult mai masiv, formând unatom miuonic(d).Aceste tipuri de atomi pot fi folosite pentru a testa previziuni fundamentale ale fizicii.[138][139][140]
Note de completare[modificare|modificare sursă]
- ^Pentru cele mai recente actualizări veziGrafic Interactiv de Nuclizi (Brookhaven National Laboratory)Arhivatîn,laWayback Machine..
- ^Un carat este la 200 de miligrame.Prin definiție,carbon-12 are 0,012 kg pe mol.Constanta lui Avogadrodefinește6×1023atomi pe mol.
Note bibliografice[modificare|modificare sursă]
- ^„Atom”.Compendium of Chemical Terminology (IUPAC Gold Book)(d)(ed. 2nd). IUPAC.Accesat în.
- ^abGhosh, D. C.; Biswas, R. (). „Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii”.Int. J. Mol. Sci.3:87–113.doi:10.3390/i3020087.
- ^Leigh, G. J., ed. ().International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry,Nomenclature of Organic Chemistry(d)– Recommendations 1990.Oxford: Blackwell Scientific Publications. p. 35.ISBN0-08-022369-9.
An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.
- ^Andrew G. van Melsen ().From Atomos to Atom.Mineola, N.Y.: Dover Publications.ISBN0-486-49584-1.
- ^Dalton, John ().„On the Absorption of Gases by Water and Other Liquids”.Accesat în.,înMemoirs of the Literary and Philosophical Society of Manchester
- ^Einstein, Albert ().„Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen”(PDF).Annalen der Physik(în German).322(8): 549–560.Bibcode:1905AnP...322..549E.doi:10.1002/andp.19053220806.Arhivat dinoriginal(PDF)la.Accesat în.
- ^Mazo, Robert M. ().Brownian Motion: Fluctuations, Dynamics, and Applications.Oxford University Press. pp. 1–7.ISBN0-19-851567-7.OCLC48753074.
- ^Lee, Y.K.; Hoon, K. ().„Brownian Motion”.Imperial College London.Arhivatdin originalul de la.Accesat în.
- ^Patterson, G. (). „Jean Perrin and the triumph of the atomic doctrine”.Endeavour(d).31(2): 50–53.doi:10.1016/j.endeavour.2007.05.003.PMID17602746.
- ^Thomson, J. J. (august 1901).„On bodies smaller than atoms”.The Popular Science Monthly.Bonnier Corp.: 323–335.Accesat în.
- ^„J.J. Thomson”.Fundația Nobel..Accesat în.
- ^Rutherford, E. ().„The Scattering of α and β Particles by Matter and the Structure of the Atom”(PDF).Philosophical Magazine(d).21(125): 669–88.doi:10.1080/14786440508637080.
- ^„Frederick Soddy, The Nobel Prize in Chemistry 1921”.Fundația Nobel.Accesat în.
- ^Thomson, Joseph John ().„Rays of positive electricity”.Proceedings of the Royal Society.A.89(607): 1–20.Bibcode:1913RSPSA..89....1T.doi:10.1098/rspa.1913.0057.
- ^Stern, David P. ().„The Atomic Nucleus and Bohr's Early Model of the Atom”.NASA/Goddard Space Flight Center.Arhivat dinoriginalla.Accesat în.
- ^Bohr, Niels ().„Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture”.Fundația Nobel.Accesat în.
- ^Pais, Abraham ().Inward Bound: Of Matter and Forces in the Physical World.New York: Oxford University Press. pp. 228–230.ISBN0-19-851971-0.
- ^Lewis, Gilbert N. (). „The Atom and the Molecule”.Journal of the American Chemical Society(d).38(4): 762–786.doi:10.1021/ja02261a002.
- ^Scerri, Eric R. ().The periodic table: its story and its significance.Oxford University Press US. pp. 205–226.ISBN0-19-530573-6.
- ^Langmuir, Irving (). „The Arrangement of Electrons in Atoms and Molecules”.Journal of the American Chemical Society(d).41(6): 868–934.doi:10.1021/ja02227a002.
- ^Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (). „On the theory of the Stern-Gerlach apparatus”.Foundations of Physics(d).17(6): 575–583.Bibcode:1987FoPh...17..575S.doi:10.1007/BF01882788.
- ^What is the Heisenberg Uncertainty Principle? - Chad Orzel TED-ED talk
- ^Brown, Kevin ().„The Hydrogen Atom”.MathPages.Accesat în.
- ^Harrison, David M. ().„The Development of Quantum Mechanics”.Universitatea din Toronto.Arhivatdin originalul de la.Accesat în.
- ^Aston, Francis W. (). „The constitution of atmospheric neon”.Philosophical Magazine(d).39(6): 449–55.doi:10.1080/14786440408636058.
- ^Chadwick, James ().„Nobel Lecture: The Neutron and Its Properties”.Fundația Nobel.Accesat în.
- ^„Otto Hahn, Lise Meitner and Fritz Strassmann”.Chemical Achievers: The Human Face of the Chemical Sciences.Chemical Heritage Foundation.Arhivatdin originalul de la.Accesat în.
- ^Meitner, Lise; Frisch, Otto Robert (). „Disintegration of uranium by neutrons: a new type of nuclear reaction”.Nature.143(3615): 239–240.Bibcode:1939Natur.143..239M.doi:10.1038/143239a0.
- ^Schroeder, M.„Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages”(în German). Arhivat dinoriginalla.Accesat în.
- ^Crawford, E.; Sime, Ruth Lewin; Walker, Mark ().„A Nobel tale of postwar injustice”.Physics Today.50(9): 26–32.Bibcode:1997PhT....50i..26C.doi:10.1063/1.881933.
- ^Kullander, Sven ().„Accelerators and Nobel Laureates”.Fundația Nobel.Accesat în.
- ^„The Nobel Prize in Physics 1990”.Fundația Nobel..Accesat în.
- ^Demtröder, Wolfgang ().Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics(ed. 1st). Springer. pp. 39–42.ISBN3-540-20631-0.OCLC181435713.
- ^Woan, Graham ().The Cambridge Handbook of Physics.Cambridge University Press. p. 8.ISBN0-521-57507-9.OCLC224032426.
- ^MacGregor, Malcolm H. ().The Enigmatic Electron.Oxford University Press. pp. 33–37.ISBN0-19-521833-7.OCLC223372888.
- ^abParticle Data Group ().„The Particle Adventure”.Lawrence Berkeley Laboratory.Arhivatdin originalul de la.Accesat în.
- ^abSchombert, James ().„Elementary Particles”.University of Oregon. Arhivat dinoriginalla.Accesat în.
- ^Jevremovic, Tatjana ().Nuclear Principles in Engineering.Springer. p. 63.ISBN0-387-23284-2.OCLC228384008.
- ^Pfeffer, Jeremy I.; Nir, Shlomo ().Modern Physics: An Introductory Text.Imperial College Press. pp. 330–336.ISBN1-86094-250-4.OCLC45900880.
- ^Wenner, Jennifer M. ().„How Does Radioactive Decay Work?”.Carleton College.Accesat în.
- ^abcRaymond, David ().„Nuclear Binding Energies”.New Mexico Tech. Arhivat dinoriginalla.Accesat în.
- ^Mihos, Chris ().„Overcoming the Coulomb Barrier”.Case Western Reserve University.Accesat în.
- ^Staff ().„ABC's of Nuclear Science”.Lawrence Berkeley National Laboratory.Arhivatdin originalul de la.Accesat în.
- ^Makhijani, Arjun; Saleska, Scott ().„Basics of Nuclear Physics and Fission”.Institute for Energy and Environmental Research.Arhivatdin originalul de la.Accesat în.
- ^Shultis, J. Kenneth; Faw, Richard E. ().Fundamentals of Nuclear Science and Engineering.CRC Press. pp. 10–17.ISBN0-8247-0834-2.OCLC123346507.
- ^Fewell, M. P. (). „The atomic nuclide with the highest mean binding energy”.American Journal of Physics(d).63(7): 653–658.Bibcode:1995AmJPh..63..653F.doi:10.1119/1.17828.
- ^Mulliken, Robert S. (). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”.Science.157(3784): 13–24.Bibcode:1967Sci...157...13M.doi:10.1126/science.157.3784.13.PMID5338306.
- ^abBrucat, Philip J. ().„The Quantum Atom”.University of Florida.Arhivatdin originalul de la.Accesat în.
- ^Manthey, David ().„Atomic Orbitals”.Orbital Central.Arhivatdin originalul de la.Accesat în.
- ^Herter, Terry ().„Lecture 8: The Hydrogen Atom”.Cornell University. Arhivat dinoriginalla.Accesat în.
- ^Bell, R. E.; Elliott, L. G. (). „Gamma-Rays from the Reaction H1(n,γ)D2and the Binding Energy of the Deuteron”.Physical Review.79(2): 282–285.Bibcode:1950PhRv...79..282B.doi:10.1103/PhysRev.79.282.
- ^Smirnov, Boris M. ().Physics of Atoms and Ions.Springer. pp. 249–272.ISBN0-387-95550-X.
- ^Matis, Howard S. ().„The Isotopes of Hydrogen”.Guide to the Nuclear Wall Chart.Lawrence Berkeley National Lab.Arhivatdin originalul de la.Accesat în.
- ^Weiss, Rick ().„Scientists Announce Creation of Atomic Element, the Heaviest Yet”.Washington Post.Accesat în.
- ^abSills, Alan D. ().Earth Science the Easy Way.Barron's Educational Series. pp. 131–134.ISBN0-7641-2146-4.OCLC51543743.
- ^Dumé, Belle ().„Bismuth breaks half-life record for Alpha decay”.Physics World.Arhivatdin originalul de la.Accesat în.
- ^Lindsay, Don ().„Radioactives Missing From The Earth”.Don Lindsay Archive.Arhivatdin originalul de la.Accesat în.
- ^Tuli, Jagdish K. (aprilie 2005).„Nuclear Wallet Cards”.National Nuclear Data Center, Brookhaven National Laboratory.Accesat în.
- ^abCRC Handbook (2002).
- ^abMills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo ().Quantities, Units and Symbols in Physical Chemistry(PDF)(ed. 2nd). Oxford:Uniunea Internațională de Chimie Pură și Aplicată,Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 71.ISBN0-632-03583-8.OCLC27011505.
- ^Chieh, Chung ().„Nuclide Stability”.University of Waterloo. Arhivat dinoriginalla.Accesat în.
- ^„Atomic Weights and Isotopic Compositions for All Elements”.National Institute of Standards and Technology.Arhivatdin originalul de la.Accesat în.
- ^Audi, G.; Wapstra, A.H.; Thibault, C. ().„The Ame2003 atomic mass evaluation (II)”(PDF).Nuclear Physics (revistă).729(1): 337–676.Bibcode:2003NuPhA.729..337A.doi:10.1016/j.nuclphysa.2003.11.003.Arhivat dinoriginal(PDF)la.Accesat în.
- ^Shannon, R. D. (). „Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides”.Acta Crystallographica(d).32(5): 751–767.Bibcode:1976AcCrA..32..751S.doi:10.1107/S0567739476001551.
- ^Dong, Judy ().„Diameter of an Atom”.The Physics Factbook.Arhivatdin originalul de la.Accesat în.
- ^Zumdahl, Steven S. ().Introductory Chemistry: A Foundation(ed. 5th). Houghton Mifflin.ISBN0-618-34342-3.OCLC173081482.Arhivatdin originalul de la.Accesat în.
- ^Birkholz, M.; Rudert, R. ().„Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions]”(PDF).phys. stat. sol. b.245:1858–1864.Bibcode:2008PSSBR.245.1858B.doi:10.1002/pssb.200879532.
- ^Birkholz, M. ().„Modeling the Shape of Ions in Pyrite-Type Crystals”.Crystals.4:390–403.doi:10.3390/cryst4030390.
- ^Staff ().„Small Miracles: Harnessing nanotechnology”.Oregon State University.Accesat în.—describes the width of a human hair as105nmand 10 carbon atoms as spanning 1 nm.
- ^Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha ().Prentice Hall Science Explorer: Chemical Building Blocks.Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. p. 32.ISBN0-13-054091-9.OCLC47925884.
There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.
- ^Feynman, Richard().Six Easy Pieces.The Penguin Group. p. 5.ISBN978-0-14-027666-4.OCLC40499574.
- ^ab„Radioactivity”.Splung.Arhivatdin originalul de la.Accesat în.
- ^L'Annunziata, Michael F. ().Handbook of Radioactivity Analysis.Academic Press. pp. 3–56.ISBN0-12-436603-1.OCLC16212955.
- ^Firestone, Richard B. ().„Radioactive Decay Modes”.Berkeley Laboratory. Arhivat dinoriginalla.Accesat în.
- ^Hornak, J. P. ().„Chapter 3: Spin Physics”.The Basics of NMR.Rochester Institute of Technology.Arhivatdin originalul de la.Accesat în.
- ^abSchroeder, Paul A. ().„Magnetic Properties”.University of Georgia. Arhivat dinoriginalla.Accesat în.
- ^Goebel, Greg ().„[4.3] Magnetic Properties of the Atom”.Elementary Quantum Physics.In The Public Domain website.Accesat în.
- ^Yarris, Lynn ().„Talking Pictures”.Berkeley Lab Research Review.Arhivatdin originalul de la.Accesat în.
- ^Liang, Z.-P.; Haacke, E. M. (). Webster, J. G., ed.Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging.vol. 2. John Wiley & Sons. pp. 412–426.ISBN0-471-13946-7.
- ^Zeghbroeck, Bart J. Van ().„Energy levels”.Shippensburg University. Arhivat dinoriginalla.Accesat în.
- ^Fowles, Grant R. ().Introduction to Modern Optics.Courier Dover Publications. pp. 227–233.ISBN0-486-65957-7.OCLC18834711.
- ^Martin, W. C.; Wiese, W. L. (mai 2007).„Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas”.National Institute of Standards and Technology.Arhivatdin originalul de la.Accesat în.
- ^„Atomic Emission Spectra — Origin of Spectral Lines”.Avogadro Web Site. Arhivat dinoriginalla.Accesat în.
- ^Fitzpatrick, Richard ().„Fine structure”.University of Texas at Austin.Accesat în.
- ^Weiss, Michael ().„The Zeeman Effect”.University of California-Riverside.Arhivatdin originalul de la.Accesat în.
- ^Beyer, H. F.; Shevelko, V. P. ().Introduction to the Physics of Highly Charged Ions.CRC Press. pp. 232–236.ISBN0-7503-0481-2.OCLC47150433.
- ^Watkins, Thayer.„Coherence in Stimulated Emission”.San José State University.Arhivatdin originalul de la.Accesat în.
- ^oxford dictionary – valency
- ^Reusch, William ().„Virtual Textbook of Organic Chemistry”.Michigan State University. Arhivat dinoriginalla.Accesat în.
- ^„Covalent bonding – Single bonds”.chemguide..
- ^Husted, Robert; et al. ().„Periodic Table of the Elements”.Los Alamos National Laboratory.Arhivatdin originalul de la.Accesat în.
- ^Baum, Rudy ().„It's Elemental: The Periodic Table”.Chemical & Engineering News.Accesat în.
- ^Goodstein, David L. ().States of Matter.Courier Dover Publications. pp. 436–438.ISBN0-13-843557-X.
- ^Brazhkin, Vadim V. (). „Metastable phases, phase transformations, and phase diagrams in physics and chemistry”.Physics-Uspekhi.49(7): 719–24.Bibcode:2006PhyU...49..719B.doi:10.1070/PU2006v049n07ABEH006013.
- ^Myers, Richard ().The Basics of Chemistry.Greenwood Press. p. 85.ISBN0-313-31664-3.OCLC50164580.
- ^Staff ().„Bose-Einstein Condensate: A New Form of Matter”.National Institute of Standards and Technology.Arhivatdin originalul de la.Accesat în.
- ^Colton, Imogen; Fyffe, Jeanette ().„Super Atoms from Bose-Einstein Condensation”.The University of Melbourne. Arhivat dinoriginalla.Accesat în.
- ^Jacox, Marilyn; Gadzuk, J. William (noiembrie 1997).„Scanning Tunneling Microscope”.National Institute of Standards and Technology.Arhivatdin originalul de la.Accesat în.
- ^„The Nobel Prize in Physics 1986”.The Nobel Foundation.Accesat în.—in particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ^Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (). „Sector field mass spectrometers in ICP-MS”.Spectrochimica Acta Part B: Atomic Spectroscopy.53(13): 1739–63.Bibcode:1998AcSpe..53.1739J.doi:10.1016/S0584-8547(98)00222-5.
- ^Müller, Erwin W.;Panitz, John A.;McLane, S. Brooks(). „The Atom-Probe Field Ion Microscope”.Review of Scientific Instruments(d).39(1): 83–86.Bibcode:1968RScI...39...83M.doi:10.1063/1.1683116.
- ^Lochner, Jim; Gibb, Meredith; Newman, Phil ().„What Do Spectra Tell Us?”.NASA/Goddard Space Flight Center.Arhivatdin originalul de la.Accesat în.
- ^Winter, Mark ().„Helium”.WebElements.Arhivatdin originalul de la.Accesat în.
- ^Hinshaw, Gary ().„What is the Universe Made Of?”.NASA/WMAP.Arhivatdin originalul de la.Accesat în.
- ^Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan ().Radiochemistry and Nuclear Chemistry.Elsevier. p. 441.ISBN0-7506-7463-6.OCLC162592180.
- ^Davidsen, Arthur F. (). „Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission”.Science.259(5093): 327–34.Bibcode:1993Sci...259..327D.doi:10.1126/science.259.5093.327.PMID17832344.
- ^Lequeux, James ().The Interstellar Medium.Springer. p. 4.ISBN3-540-21326-0.OCLC133157789.
- ^Smith, Nigel ().„The search for dark matter”.Physics World.Arhivatdin originalul de la.Accesat în.
- ^Croswell, Ken ().„Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium”.New Scientist(1794): 42.Arhivatdin originalul de la.Accesat în.
- ^Copi, Craig J.; Schramm, DN; Turner, MS (). „Big-Bang Nucleosynthesis and the Baryon Density of the Universe”.Science.267(5195): 192–99.arXiv:astro-ph/9407006
 .Bibcode:1995Sci...267..192C.doi:10.1126/science.7809624.PMID7809624.
.Bibcode:1995Sci...267..192C.doi:10.1126/science.7809624.PMID7809624.
- ^Hinshaw, Gary ().„Tests of the Big Bang: The Light Elements”.NASA/WMAP.Arhivatdin originalul de la.Accesat în.
- ^Abbott, Brian ().„Microwave (WMAP) All-Sky Survey”.Hayden Planetarium. Arhivat dinoriginalla.Accesat în.
- ^Hoyle, F. (). „The synthesis of the elements from hydrogen”.Monthly Notices of the Royal Astronomical Society(d).106:343–83.Bibcode:1946MNRAS.106..343H.doi:10.1093/mnras/106.5.343.
- ^Knauth, D. C.; Knauth, D. C.; Lambert, David L.; Crane, P. (). „Newly synthesized lithium in the interstellar medium”.Nature.405(6787): 656–58.doi:10.1038/35015028.PMID10864316.
- ^Mashnik, Stepan G. (). „On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes”.arXiv:astro-ph/0008382
 [astro-ph].
[astro-ph].
- ^Kansas Geological Survey ().„Age of the Earth”.University of Kansas. Arhivat dinoriginalla.Accesat în.
- ^Manuel 2001,pp. 407–430, 511–519.
- ^Dalrymple, G. Brent ().„The age of the Earth in the twentieth century: a problem (mostly) solved”.Geological Society, London, Special Publications.190(1): 205–21.Bibcode:2001GSLSP.190..205D.doi:10.1144/GSL.SP.2001.190.01.14.Accesat în.
- ^Anderson, Don L.;Foulger, G. R.; Meibom, Anders ().„Helium: Fundamental models”.MantlePlumes.org.Arhivatdin originalul de la.Accesat în.
- ^Pennicott, Katie ().„Carbon clock could show the wrong time”.PhysicsWeb.Arhivatdin originalul de la.Accesat în.
- ^Yarris, Lynn ().„New Superheavy Elements 118 and 116 Discovered at Berkeley Lab”.Berkeley Lab.Arhivatdin originalul de la.Accesat în.
- ^Diamond, H; et al. (). „Heavy Isotope Abundances in Mike Thermonuclear Device”.Physical Review.119(6): 2000–04.Bibcode:1960PhRv..119.2000D.doi:10.1103/PhysRev.119.2000.
- ^Poston Sr.; John W. ().„Do transuranic elements such as plutonium ever occur naturally?”.Scientific American.
- ^Keller, C. (). „Natural occurrence of lanthanides, actinides, and superheavy elements”.Chemiker Zeitung.97(10): 522–30.OSTI4353086.
- ^Zaider, Marco; Rossi, Harald H. ().Radiation Science for Physicians and Public Health Workers.Springer. p. 17.ISBN0-306-46403-9.OCLC44110319.
- ^Manuel 2001,pp. 407–430,511–519.
- ^„Oklo Fossil Reactors”.Curtin University of Technology.Arhivatdin originalul de la.Accesat în.
- ^Weisenberger, Drew.„How many atoms are there in the world?”.Jefferson Lab.Accesat în.
- ^Pidwirny, Michael.„Fundamentals of Physical Geography”.University of British Columbia Okanagan.Arhivatdin originalul de la.Accesat în.
- ^Anderson, Don L. ().„The inner inner core of Earth”.Proceedings of the National Academy of Sciences.99(22): 13966–68.Bibcode:2002PNAS...9913966A.doi:10.1073/pnas.232565899.PMC137819
 .PMID12391308.
.PMID12391308.
- ^Pauling, Linus ().The Nature of the Chemical Bond.Cornell University Press. pp. 5–10.ISBN0-8014-0333-2.OCLC17518275.
- ^Anonymous ().„Second postcard from the island of stability”.CERN Courier.Arhivatdin originalul de la.Accesat în.
- ^Jacoby, Mitch (). „As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine”.Chemical & Engineering News(d).84(10): 19.doi:10.1021/cen-v084n010.p019a.
- ^Koppes, Steve ().„Fermilab Physicists Find New Matter-Antimatter Asymmetry”.University of Chicago.Accesat în.
- ^Cromie, William J. ().„A lifetime of trillionths of a second: Scientists explore antimatter”.Harvard University Gazette.Accesat în.
- ^Hijmans, Tom W. (). „Particle physics: Cold antihydrogen”.Nature.419(6906): 439–40.Bibcode:2002Natur.419..439H.doi:10.1038/419439a.PMID12368837.
- ^Staff ().„Researchers 'look inside' antimatter”.BBC News.Accesat în.
- ^Barrett, Roger ().„The Strange World of the Exotic Atom”.New Scientist(1728): 77–115.Arhivatdin originalul de la.Accesat în.
- ^Indelicato, Paul (). „Exotic Atoms”.Physica Scripta(d).T112(1): 20–26.arXiv:physics/0409058
 .Bibcode:2004PhST..112...20I.doi:10.1238/Physica.Topical.112a00020.
.Bibcode:2004PhST..112...20I.doi:10.1238/Physica.Topical.112a00020.
- ^Ripin, Barrett H. (iulie 1998).„Recent Experiments on Exotic Atoms”.American Physical Society. Arhivat dinoriginalla.Accesat în.
Bibliografie[modificare|modificare sursă]
- Manuel, Oliver ().Origin of Elements in the Solar System: Implications of Post-1957 Observations.Springer.ISBN0-306-46562-0.OCLC228374906.
Lectură suplimentară[modificare|modificare sursă]
- Dalton, J.().A New System of Chemical Philosophy, Part 1.London and Manchester: S. Russell.
- Gangopadhyaya, Mrinalkanti ().Indian Atomism: History and Sources.Atlantic Highlands, New Jersey: Humanities Press.ISBN0-391-02177-X.OCLC10916778.
- Harrison, Edward Robert ().Masks of the Universe: Changing Ideas on the Nature of the Cosmos.Cambridge University Press.ISBN0-521-77351-2.OCLC50441595.
- Iannone, A. Pablo ().Dictionary of World Philosophy.Routledge.ISBN0-415-17995-5.OCLC44541769.
- King, Richard ().Indian philosophy: an introduction to Hindu and Buddhist thought.Edinburgh University Press.ISBN0-7486-0954-7.
- Levere, Trevor, H. ().Transforming Matter – A History of Chemistry for Alchemy to the Buckyball.The Johns Hopkins University Press.ISBN0-8018-6610-3.
- Liddell, Henry George; Scott, Robert.„A Greek-English Lexicon”.Perseus Digital Library.
- Liddell, Henry George; Scott, Robert.„ἄτομος”.A Greek-English Lexicon.Perseus Digital Library.Accesat în.
- McEvilley, Thomas ().The shape of ancient thought: comparative studies in Greek and Indian philosophies.Allworth Press.ISBN1-58115-203-5.
- Moran, Bruce T. ().Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution.Harvard University Press.ISBN0-674-01495-2.
- Ponomarev, Leonid Ivanovich ().The Quantum Dice.CRC Press.ISBN0-7503-0251-8.OCLC26853108.
- Roscoe, Henry Enfield().John Dalton and the Rise of Modern Chemistry.Century science series. New York: Macmillan.Accesat în.
- Siegfried, Robert ().From Elements to Atoms: A History of Chemical Composition.DIANE.ISBN0-87169-924-9.OCLC186607849.
- Teresi, Dick ().Lost Discoveries: The Ancient Roots of Modern Science.Simon & Schuster. pp. 213–214.ISBN0-7432-4379-X.
- Various (). Lide, David R., ed.Handbook of Chemistry & Physics(ed. 88th). CRC.ISBN0-8493-0486-5.OCLC179976746.Arhivatdin originalul de la.Accesat în.
- Wurtz, Charles Adolphe ().The Atomic Theory.New York: D. Appleton and company.ISBN0-559-43636-X.
Legături externe[modificare|modificare sursă]
- "Quantum Mechanics and the Structure of Atoms"peYouTubefizica reale lecție începe la 2:20 în film.
- Freudenrich, Craig C.„How Atoms Work”.How Stuff Works. Arhivat dinoriginalla.Accesat în.Mai multe valori specificate pentru
|nume=și|last=(ajutor) - „The Atom”.Free High School Science Texts: Physics.Wikibooks.Accesat în.Mai multe valori specificate pentru
|lucrare=și|work=(ajutor) - Anonymous ().„The atom”.Science aid+.Accesat în.—un ghid pentru atom pentru adolescenti.
- Anonymous ().„Atoms and Atomic Structure”.BBC. Arhivat dinoriginalla.Accesat în.
- Various ().„Physics 2000, Table of Contents”.University of Colorado. Arhivat dinoriginalla.Accesat în.
- Various ().„What does an atom look like?”.University of Karlsruhe. Arhivat dinoriginalla.Accesat în.
