Grafit
| Grafit | |
|---|---|
| Kategorija | Mineral |
| Hemijska formula | C |
| Identifikacija | |
| Kristalna sistema | heksagonalna |
| Cepljivost | savršena u jednom pravcu |
| Tvrdina po Mosu | 1—2 |
| Sjajnost | metalična |
| Boja ogreba | crni |
| Relativna gustina | (2,09—2,23) g/cm3 |
Grafitjeminerali jedna je od tri stabilnealotropske modifikacijeugljenika(poreddijamantaifulerena), među kojima je najčešća i najstabilnija upravo grafit. Sive jeboje.[1]
Grafit najčešće posedujeheksagonalnurešetku,a veoma retko se pojavljuje uromboedričnoj.Atomiu slojevima vezani su jakimkovalentnim vezama,ali su sami slojevi povezani slabimVan der Valsovim vezama,što im omogućava da klize jedan preko drugog, tako da se grafit otire. Grafit je jedininemetalkoji dobro provodielektričnu strujuitoplotu.[2][3]
Upotrebljava se za podmazivanje, uelektrolizi(kao inertnaelektroda), za kontakte u električnimmotorimai sl.
Najvećirudnicigrafita u svetu nalaze se uKini(2005.godine proizvodnja je bila 1.650.000tona). Ostali veliki proizvođači grafita suIndija,Brazil,Severna KorejaiKanada.
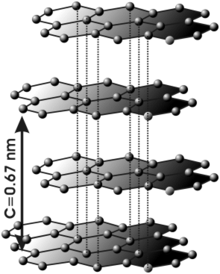
Kod grafita je svakiatomugljika povezan sa tri susjedna ugljikova atoma. To znači da ugljik u grafitu pravi sp2-hibridizaciju.Kod dijamanta je u pitanju sp3-hibridizacija (tetraedarska struktura). Nastali sp2-hibridi leže u jednoj ravni pod uglom 120°i zbog toga grafit ima lisnatu strukturu, međusobno uvezanu slabimVan der Waalsovim silama.
- ↑Housecroft C. E., Sharpe A. G. (2008).Inorganic Chemistry(3rd izd.). Prentice Hall.ISBN978-0-13-175553-6.
- ↑Lide David R., ur. (2006).CRC Handbook of Chemistry and Physics(87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑Susan Budavari, ur. (2001).The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals(13th izd.). Merck Publishing.ISBN0-911910-13-1.
| Periodni sistem elemenata | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
