Vodik
| Vodik | ||
|---|---|---|
|
| ||
| Osnovna svojstva | ||
| Kemijski element,Simbol,Atomski broj | Vodik, H, 1 | |
| Kemijska skupina | nemetali | |
| Grupa, perioda,Blok | 1,1,s | |
| Izgled | bezbojniplin | |
| Gustoća1 | 0,08988 kg/m3 | |
| Tvrdoća | - | |
| Specifični toplinski kapacitet(cpili cV)2 |
(25 °C) (H2) 28.836 J mol–1K–1 | |
| Talište | −259,14 °C | |
| Vrelište3 | −252,87 °C | |
| Toplina taljenja | (H2) 0,117 kJ mol-1 | |
| Toplina isparivanja | (H2) 0,904 kJ mol-1 | |
|
1pristandardnom tlaku i temperaturi | ||
| Atomska svojstva | ||
| Atomska masa | 1,00794(7) | |
| Elektronska konfiguracija | [1] 1s1 | |
Vodikjekemijski elementkoji uperiodnom sustavu elemenatanosi simbolH,atomski(redni) broj mu je 1, aatomska masamu iznosi 1,00794(7). Vodiknema određen položaj u periodnom sustavu. Ima jedan valentnielektronkaoalkalijski metali,a od njih se razlikuje mnogo većom energijomionizacije.Za stabilnu elektronsku konfiguraciju nedostaje mu jedanelektron.Vodik bi se mogao smatratihalogenim elementom,ali od njih ima manjuelektronegativnosti afinitet prema elektronu, pa se zbog toga proučava zasebno. Čini 75% masesvemira,te je ishodišna tvar iz koje sunuklearnom fuzijomnastali ostali elementi.Zvijezdeuglavnom nizuse uglavnom sastoje od vodika, u oblikuplazme.Elementarni vodik naZemljije u vrlo malim količinama.[1]
Elementarni vodik sastoji se odobičnog vodika (procija)(>99,98%), dok ostatak (gotovo 0,02%) čini teški vodik (deuterij) s tragovima superteškog vodika (tricija). Vodik stvara kemijske veze sa najviše elemenata, posebno uorganskim tvarima.Pri standardnom tlaku i temperaturi,vodik je plin bez boje, mirisa i okusa, 14,4 puta lakši odzraka.Neotrovan je. Slabo jetopljivu polarnim, a bolje u nepolarnim otapalima.
Industrijski se najviše dobija izzemnog plina,a rjeđeelektrolizomvode.Najviše se koristi u proizvodnjifosilnih goriva(hidrokrakiranje – povećanje kvalitete goriva) i za dobivanjeamonijaka,u proizvodnji umjetnih goriva. Umetalurgijinije baš poželjan, jer mnogemetalečini lomljivim i krtim, pa stvara poteškoće u izgradnji cjevovoda i metalnih spremnika.[2][3]
Iako ga nije prvi proizveo (prvi ga je proizveoParacelsusu 16. st. reakcijom metala i jake kisline), vodik (lat.Hydrogenium) je definiraoBritanacHenry Cavendish1766.[4]i nazvao ga "zapaljivim zrakom". Cavendish ga je dobio reakcijomcinkaiklorovodične kiseline.Definirao je o kojem se plinu radi i dokazao da reakcijom vodika i kisika nastajevoda.Zbog toga svojstvaAntoine Lavoisierga1783.nazivahydrogène,odgrčkog"onaj koji stvara vodu" (grč. ὕδωρ = voda, γενής = stvaratelj). Hrvatski naziv uveo jeBogoslav Šulek.
Tekući vodik je dobio prvi put 1898. James Dewar, a godinu kasnije je stvorio i kruti vodik.Deuterijje dobio 1931.Harold Urey,a godinu kasnije je stvorili itešku vodu.1934.Ernest Rutherfordi njegov tim su proizvelitricij.[5]

Prvibalon na vrući zrakje otkrio 1783. Jacques Charles.Ferdinand von Zeppelinje napravio letjelicu na vodik, koja je imala prvi let 1900., a kasnije je nazvanacepelin.
Nikal– vodikovebaterijesu se prvi puta koristile 1977, a kasnije ih je koristilaMeđunarodna svemirska postaja,svemirske letjelice2001 Mars OdysseyiMars Global Surveyor,tesvemirski teleskop Hubble,kome je prvo pakovanje baterija trajalo 19 godina.[6]

Zbog svoje jednostavneatomskestrukture, koja se sastoji od jednogprotonaielektrona,atom vodika sa svojimvodikovim spektralnim linijamasvjetlosti (emisija i apsorpcija –Balmerova serija,Lymanova serijaitd.), je imao središnju ulogu u razvojuteorije atomske strukture.Osim toga, atom vodika i odgovarajući kationi H2+su imali važnu ulogu u razumijevanju prirodekemijskih veza,čija se teorija razvila 1920-tih.[7]
Prije razvojakvantne mehanike,Maxwellje uočio daspecifični toplinski kapacitetmolekule H2ima neobjašnjivo odstupanje na niskim temperaturama, gdje se H2počinje više ponašati kao jednoatomni plin. Prema kvantnoj teoriji, ta pojava se dešava zbog prostora energetskih nivoa, koji su naširoko raspoređeni kod H2zbog male mase. Taj veliki prostor energetskih nivoa onemogućuje ravnomjernu raspodjelu toplinske energije kod vodika na niskim temperaturama.[8]
Pristandardnom tlaku i temperaturi,vodik jeplinbez boje, mirisa i okusa, 14.4 puta lakši od zraka. Neotrovan je. Slabo je topljiv u polarnim, a bolje u nepolarnim otapalima.
Ohlađen na temperaturu vrelišta, kondenzira se u bezbojnutekućinukoja je najlakša od svih tekućina. Daljnjim odvođenjem topline skrućuje se u prozirnukrutinuheksagonske kristalne strukture.
Zapaljen na zraku pri 560 °C, izgara gotovo nevidljivim plamenom u vodu:
2 H2(g)+ O2(g)→ 2 H2O(l)= 286 kJ mol-1
Na sobnoj temperaturi nije previše reaktivan, no pri višim temperaturama ulazi u niz reakcija. Otapa se u mnogim metalima, kao što jeplatina. Pri sobnoj temperaturi bezkatalizatora,reagira samo sfluoromivanadijemu prahu. Razlog slaboj reaktivnosti molekularnog vodika pri sobnoj temperaturi jaka je jednostrukakovalentna vezau molekuli. Ta veza je najjača od svih jednostrukih kovalentnih veza između dvaju istovrsnih atoma. Pri povišenoj temperaturi spaja se i s kisikom iz mnogihoksida,te tako djeluje kao redukcijsko sredstvo.
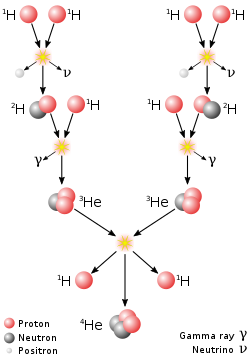
Elementarni vodik na Zemlji je vrlo rasprostranjen, ali u malim količinama. Nazočan je uatmosferi,zemnom plinu,vulkanskim plinovima, itd. Zbog toga što ga gravitacija teško može zadržati, vodik u gornjim dijelovima atmosfere izlazi u svemir.
U obliku spojeva, ima ga u ogromnim količinama, ponajviše u oblikuvode,koja prekriva gotovo dvije trećine Zemljine površine. Sastavni je dio mnogihorganskih spojeva,kiselinaiotopina.Po broju atoma, treći je, odmah nakon kisika i silicija, a po masenom udjelu je na desetom mjestu.
Čini 75% masesvemira,te je ishodišna tvar iz koje sunuklearnom fuzijomnastali ostali elementi. Po broju atoma, vodika ima 90% u svemiru. Ima ga u ogromnim količinama uzvijezdamaiplinovitim divovima,a izgleda da ga ima u još neotkrivenojtamnoj tvariitamnoj energiji.Molekularni oblaci sa H2su povezani sa rođenjem zvijezda. Vodik ima odlućujuću ulogu u stvaranju snage i toplinske energije unuklearnoj fuziji,koja se odvija u jezgrama zvijezda, krozniz proton – protoniniz ugljik – dušik – kisik.[9][10]
U svemiru vodik se uglavnom nalazi u atomskom stanju ili kaoplazma,čija su svojstva sasvim drukčija od molekularnog vodika H2.Kao plazma, vodikovi elektroni i protoni nisu povezani zajedno, i stvaraju veoma jakuelektričnu vodljivosti veliku emisijutopline(stvaraelektromagnetsko zračenje,uključujući svjetlost saSuncai ostalihzvijezda). Na nabijene čestice vodika snažno utječumagnetskaielektrična polja.Na primjer,Sunčev vjetardjeluje na Zemljinumagnetosferu,stvarajućipolarnu svjetlosti Birkelandovu struju.[11]
Pod normalnim uvjetima na Zemlji, vodik se uglavnom nalazi kao plinovita molekula H2.Ustvari, vodikov plin je vrlo rijedak u atmosferi, svega 0,000055%, zato što je molekula vodika puno lakša od zraka, zbog čega lakše bježi izatmosfere.Ipak, na Zemljinoj površini, vodik je treći najrašireniji element, uglavnom u obliku molekulavodeiugljikohidrata.Nekealgeibakterijestvaraju plin vodik.[12]
Najčešće se dobiva onako kako ga je prvi put dobio Cavendish, tj. reakcijom cinka i klorovodične kiseline, umjesto koje se često rabi i razrijeđenasumporna kiselina:
Zn(s)+ 2 H+→ Zn2++ H2(g)
Za razvijanje plinova u laboratoriju najpogodniji jeKippov aparat,jer se reakcija u njemu može prekinuti i na taj način proizvesti samo potrebne količine plina.
Može se dobiti i reakcijom vode s čvrstimhidridima,kao što jekalcijev hidrid:
2 H2O + CaH2(s)→ 2 H2(g)+ Ca2++ 2 OH-
te reakcijom metala negativnog redukcijskog potencijala služinama,ako ti metali stvaraju hidrokso-komplekse:
2 Al(s)+ 6 H2O + 2 OH-→ 2 Al(OH)4-+ 3 H2(g)
Ovisno o cijeni električne energije i energenata, vodik se dobiva na nekoliko načina.
U zemljama s jeftinom električnom energijom, dobiva se elektrolizom vode, zalužene alkalijskim hidroksidom zbog povećanja vodljivosti:
- 2 H2O → 2 H2(g)+ O2(g)
Vodik se dobiva i kao nusprodukt kod dobivanjaklorametodomkloralkalne elektrolize.
Jedna od najraširenijih i najjeftinijih metoda jest piroliza ugljikovodika, primjericeetana:
C2H2(g)→ C2H4(g)+ H2(g)
Kada je lako dostupanmetan,koristi se njegova reakcija s vodenom parom na 1100 °C:
CH4(g)+ H2O ⇄ CO(g)+ 3 H2(g)= 214.4 kJ mol-1
Kada je lako dostupan i jeftin ugljen, koristi se redukcija vodene pare:
C(s)+ H2O ⇄ CO(g)+ H(g)= 131.25 kJ mol-1

Dobivena smjesa zove sevodeni plin.
Ugljikov(II) oksidod vodika se odvaja reakcijom s dodatnom vodenom parom, pri čemu nastaje dodatna količina vodika:
CO(g)+ H2O(g)→ H2(g)+ CO2(g)
Nastaliugljikov(IV) oksiduklanja se iz smjese apsorpcijom u lužini ili ispiranjem vodom pod tlakom. Lako se uklanja i hlađenjem tekućim zrakom. Tragovi neizreagiranogugljikovog(II) oksidauklanjaju se prevođenjem plina preko zagrijanognatrijevog hidroksidapri čemu nastajenatrijev metanoat.
Postoji više od 200 termokemijskih procesa, koji se mogu iskoristiti za razdvajanje vode. Oko 10-tak procesa se istražuje i ispituje za dobivanje vodika ikisikaizvode,te grijanjem bez upotrebeelektrične struje,a ti su procesi na primjer: ciklusželjeznogoksida, cikluscerij(IV) oksid - cerij (III) oksid, cikluscink– cink oksid, ciklussumpor–jod,ciklusbakar–klori ciklus hibridnisumpor.Veliki broj labaratorija u Francuskoj, Njemačkoj, Grčkoj, Japanu i SAD razvijaju termokemijske procese uz korištenje Sunčeve energije i vode.[13][14]

Bez prisustva kisika,željezoi legiraničelikpolakooksidirajuuz pomoćprotonaiz vode, koji se pretvaraju u plinoviti vodik H2.Anaerobna korozija stvara prvo željezni hidroksid (zelena korozija) i ta se kemijska reakcija može opisati kao:
- Fe + 2 H2O → Fe(OH)2+ H2
U drugom koraku, bez prisustva kisika, željezni hidroksid može oksidirati uz pomoć protona iz vode i stvoritimagnetiti plinoviti vodik. Taj se proces naziva Shikorrova reakcija:
- 3 Fe(OH)2→ Fe3O4+ 2 H2O + H2
Dobro kristalizirani magnetit (Fe3O4) je termodinamički puno stabilniji od željeznog hidroksida. Taj se proces obično dešava za vrijeme anaerobne korozije željeza i čelika, upodzemnim vodamakoje nemaju kisika, i u reduciranimtluu kojem ima dosta vlage.
Bez prisustva kisika, u dubokim geološkim slojevima, koji su daleko od Zemljine atmosfere, plinoviti vodik se stvara za vrijeme procesaserpentacije,što je anaerobna oksidacija protona vode (H+) i željeznog (Fe2+)silikata,koji je prisutan u kristalima fajalita (Fe2SiO4– krajnji članolivina). Ta reakcija vodi do stvaranjamagnetita(Fe3O4),kvarca(SiO2) i vodika (H2), na slijedeći način: 3 Fe2SiO4+ 2 H2O → 2 Fe3O4+ 3 SiO2+ 3 H2
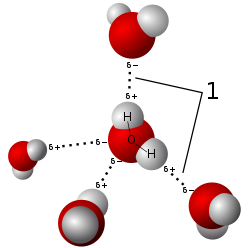
Spojevi vodika mogu se podijeliti na spojeve u kojima je nazočan u negativnom (-1) i pozitivnom stupnju oksidacije (+1). Prvi se nazivajuhidridima,i zauzimaju manjinu vodikovih spojeva, dok su drugi puno zastupljeniji i važniji. Sastavni je dio živog svijeta, u kojem igra jednu od temeljnih uloga. Poznati spojevi su vodikov peroksid i vodikov praskavac.
Na sobnoj temperaturi nije previše reaktivan, no pri višim temperaturama ulazi u niz reakcija. Poznati su milijunuugljikovodika,koji su područje proučavanja organske kemije. Vodik stvara spojeve i sa elementima koji imaju veću elektronegativnost, kao što suhalogeni elementi(F, Cl, Br, I). Kada se spaja safluorom,kisikomilidušikom,vodik se može vezati u jakoj nekovalentnoj vezi, koja se zovevodikova veza,koja je kritična u stabilnosti mnogih bioloških molekula. Vodik se veže i sa manje elektronegativnim elementima, kao što sumetaliipolumetali.
Hidridisu spojevi raznih kemijskih elemenata s vodikom. S-blok čine elementi prve i druge skupine periodnog sustava elemenata. P-blok čine elementi 13. - 17. skupine periodnog sustava elemenata. To su najvažniji hidridi, često korišteni u praksi. Dijele se na kisele, bazne, amfoterne i neutralne. Kiseli hidridi su oni hidridi koji u reakciji s vodom daju kiseline. Bazni hidridi su oni hidridi koji u reakciji s vodom daju baze. Amfoterni hidridi, ovisno o reakciji, mogu se ponašati i kao kiseline i kao baze. Neutralni hidridi uopće ne reagiraju s vodom

Elementarni vodik sastoji se odobičnog vodika (procija)(>99,98%), dok ostatak (gotovo 0,02%) činiteški vodik (deuterij)s tragovimasuperteškog vodika (tricija).
- 1H iliprocijje daleko najčešći izotop vodika, kojeg ima više od 99,98%. Ima jedanprotoni jedanelektron.Za razliku od svih ostalih izotopa, nemaneutron.
- 2H ilideuterij,ima jedan proton i jedan neutron u jezgri, te jedan elektron. U biti, vjeruje se da sav deuterij u svemiru potječe još od vremenaVelikog praskai da još traje. Deuterij nije radioaktivan, i ne prestavlja značajnu opasnost za zdravlje. On se koristi i kod nuklearne magnetno rezonantnespektroskopije,za označavanje neradioaktivnih tvari u otapalu. Voda koja uključuje atome deuterija se nazivateška voda.Teška voda se koristi unuklearnim reaktorimaza smanjivanje brzine brzihneutrona,kao i za hlađenje nuklearnih reaktora. Deuterij prestavlja moguće gorivo za dobivanjeelektrične energije iz nuklearne fuzije.
- 3H ilitricij,ima jedan proton i dva neutrona u jezgri, te jedan elektron.Tricij je radioaktivan, raspada se uhelij-3 izotop, uz pojavubeta-česticai imavrijeme poluraspadaod 12,32 godine. Toliko je radioaktivan da se koristi zaluminiscentneboje, koje se koriste i kod satova, kod kojih se može vidjeti vrijeme i u mraku. Staklo spriječava da mala količina radioaktivnosti izađe van. U prirodi se tricij može naći u vrlo malim količinama uatmosferi,a nastaje uslijed djelovanjakozmičkih zraka.Tricij može nastati kod testiranjanuklearnog oružja.Tricij prestavlja moguće gorivo za dobivanjeelektrične energije iz nuklearne fuzije.On se koristi kod kemijskih i bioloških pokusa kao radioaktivni označivač.
Vodik je jedini kemijski element čiji se izotopi označuju drugim imenima (procij, deuterij, tricij).Međunarodna unija za čistu i primijenjenu kemijudozvoljava oznake D za deuterij ili T za tricij, ali preporučuje oznake2H and3H. Oznaka P se već koristi zafosfor,tako da se ne može koristiti za procij.
Prilikom ispitivanja vibracijsko-rotacijskog spektra vodika pronađene su promjene u intenzitetu rotacijskih vrpci, koje su protumačene hipotezom o postojanju dva oblika vodika koji se razlikuju po nuklearnim spinovima u molekuli vodika. Ako su spinovi dvaju protona iz molekule antiparalelni, rezultantni spin je nula, te je stanje nedegenerirano. Takav vodik zove se para-vodik. Ako su paralelni, rezultantni spin je 1, a stanje je trostruko degenerirano, što dovodi do orto-vodika. Pri sobnoj temperaturi, elementarni se vodik sastoji od 75% orto-vodika i 25% para-vodika. Orto- i para-vodik razlikuju se po nekim fizikalnim svojstvima, primjerice energiji disocijacije, toplinskom kapacitetu, tlaku para i slično.
Između njih postoji ravnoteža:
o-H2⇄p-H2< 0
koja se hlađenjem pomiče udesno.
Na niskim temperaturama moguće je izolirati gotovo čisti para-vodik, no čisti orto-vodik nije moguće izolirati, jer povećanjem temperature ne dolazi do povećanja njegovog udjela iznad 75%.
Odnos između orto- i para-vodika je vrlo bitna kod spremanja tekućeg vodika u spremnik, jer pretvaranje orto-vodika u para-vodik stvara dodatno toplinu, koja može dovesti do hlapljenja, a time i gubitka tekućeg vodika. Zbog toga treba koristitikatalizatore,kao što ježeljezov (III) oksid,aktivniugljik,platiniziraniazbest,kovine rijetkih zemalja,uranovispojevi,kromovoksid i neki spojevinikla.
Molekularni oblik iona triatomnog vodika ili H3+,je pronađen u međuzvjezdanoj materiji, koji je nastao ionizacijom vodika sakozmičkim zrakama.Također, taj oblik molekule je pronađen u gornjoj atmosferiJupitera.Ona je dosta stabilna u tim okolinama, zbog malih temperatura i gustoće. To je jedan od najraširenijihionau svemiru.
Vodik je vrlo važna industrijska sirovina. Koristi se, između ostalog, za sintezuamonijakaimetanola,za proizvodnju goriva za motorna vozila hidrogenacijom ugljika,nafteikatrana.Koristi se i za zavarivanje i taljenjemetala,za punjenje zračnih balona i zračnih brodova, za redukciju metalnihoksidau metale, hidrogeniranje ulja u masti itd.
Radi se na korištenju vodika kao goriva. Tehnologija je vrlo slabo rasprostranjena.
Prednosti vodika kao goriva su:
- visoka energetska vrijednost
- neograničene količine dostupne u spojevima
- izgaranjem daje kemijski čistu vodu
- cjevovodima se može razvoditi na daljinu
- lakše se skladišti i čuva nego električna energija
Nedostaci koji sprječavaju rašireniju uporabu su:
- visoka cijena i često slaba isplativost izvlačenja vodika iz spojeva
- obilno curenje vodika kroz spremnike i cjevovode, zbog ekstremo malene molekule
- vodik difundiranjem u razne metale narušava njihovu kristalnu rešetku čineći ih krtima
- opasnost za ozonski sloj jer trenutno reducira ozon u vodu
U kemijskom smislu, vodik nije izvor, već spremnik energije, jer nije prirodno nabavljiv u elementarnom obliku. U slučaju uspješne i održive nuklearne fuzije unuklearnoj elektrani,bio bi izvor ogromnih količina energije.
Velike količine H2se koriste u naftnoj i kemijskoj industriji. Najveća primjena je kod poboljšanjafosilnih gorivai u proizvodnjiamonijaka.U petrokemiji H2se koristi u procesima kao što su: hidrokrekiranje, katalitičko reformiranje benzina, izomerizacija i alkilacija. H2se isto koristi u povećanju zasićenja nezasićenih masti i ulja (koristi se za dobivanjemargarina). Također je sirovina za dobivanjeklorovodične kiseline,a koristi se i kaoreducenszamineralne sirovineili rude.[15]
Vodik je izuzetno topiv u mnogimkovinama rijetkih zemaljaiprijelaznim metalima,a topiv je i u nanokristalima i amorfnim metalima.Topljivostu metalima utječe na lokalne deformacije ili nečistoće ukristalnim rešetkama,tako da metali postaju krtiji i lomljiviji, što stvara velike probleme umetalurgiji,u izradi cjevovoda i metalnih rezevoara. Ponekad se to može riješiti ako vodik se pročisti prolaskom kroz diskovepaladija.[16]
Plinoviti vodik H2se koristi za hlađenje rotoraelektričnih generatorauelektranama,zato što ima najveću toplinsku provodljivost od svih plinova. Tekući H2se koristi u ispitivanjusupravodljivostikod vrlo niskih temperatura. Budući da je plinoviti vodik H2skoro 15 puta lakši od zraka, nekad se koristio zabalone na vrući zrak.
U novije vrijeme, plinoviti vodik H2se miješa sadušikom,za dobivanjeformirajućeg plina(oko 5% vodika u dušiku), koji se koristi kod postupka lociranja ili utvrđivanja propuštanja kod raznih cjevovoda u automobilskoj, kemijskoj industriji, elektranama, zrakoplovstvu i telekomunikacijama. Vodik se koristi kao dodatakhrani(E 949) za provjeru konzervirane hrane.[17]
Trojna točkavodika u ravnoteži iznosi 13, 8033 Kelvina.

Vodik nije izvor energije, osim u mogućim elektranama nanuklearnu fuziju,koje bi koristiledeuterijitricij,što je još daleko od komercijalne upotrebe. Vodik koji se dobije iz sunčevih, bioloških ili električnih izvora, treba više energije nego što od njega možemo dobiti izgaranjem, zato on više ima ulogu kaobaterija,za spremanje ili skladištenje energije. Vodik se može dobiti izmetana,ali ti se izvori nazivaju neodrživim izvorima energije.[18]
Gustoća energijepo jedinici obujma, za tekući ili komprimirani vodik, je puno manja od poznatih fosilnih goriva, iako po jedinici mase, gustoća energije je veća. Ipak, o vodiku se dosta raspravlja kao o budućem nosiocu energije. Tako recimo, vezivanjem ugljikovog dioksida iz zraka, može biti povezano sa stvaranjem H2kao fosilnog goriva. Tada bi vodik bio relativno čisti izvor energije, uz malo ispuštanjedušikovih oksida,ali bez stvaranjaugljikovog dioksida.Ipak, ulaganje u infrastrukturu bi bilo znantno.[19]
U proizvodnjipoluvodiča,vodik se koristi za zasićenje slomljenih ( “klimavih” ) veza u amorfnomsilicijui amorfnomugljiku,da bi im se povećala kvaliteta. On je isto mogući dodatak u različitim oksidima, kao: ZnO, SnO2,CdO, MgO, ZrO2,HfO2,La2O3,Y2O3,TiO2,SrTiO3,LaAlO3,SiO2,Al2O3,ZrSiO4,HfSiO4i SrZrO3.[20]
Kao sastojak vode, nalazi se u svakom biološkom organizmu u velikim količinama. Osim u vodi, nalazi se i u gotovo svim organskim spojevima unutar organizma, vezan kovalentno za primjericeugljikilidušik.U vodenim otopinama koje su dio svakog organizma, nazočan je u obliku H3O+iona, te kao takav ima izvanredno važnu, temeljnu ulogu u regulaciji staničnih procesa.
H2se stvara kod nekih vrstavrenja ili fermentacija,a stvaraju ga nekimikroorganizmi,obično uz pomoćkatalizatora,koje sadržeenzimesaželjezomiliniklom,koji se nazivaju hidrogenaze.
Razdvajanje vode u protone, elektrone i kisik, javlja se kod gotovo svih biljaka koje vršefotosintezu.Neki takvi organizmi, kaomodrozelene algesu razvile i drugi korak, po mraku, kojim se stvara plinoviti vodik H2uz pomoć specijalnih hidrogenaza ukloroplastu.Trenutno se rade ispitivanja na genetski modificiranim modrozelenim algama, koje bi stvarale H2,čak i u prisustvu kisika ili takozvanibioreaktori.[21]
Vodik stvara čitav niz opasnosti za čovjekovu sigurnost, pogotovo H2je opasan kao plin praskavac u zraku. Osim toga, tekući vodik je opasan, jer stvara vrlo niske temperature, što može dovesti do smrzotina na prstima.[22]
- ↑Palmer D. (1997).„Hydrogen in the Universe”.NASA.
- ↑„Hydrogen Basics — Production”.Florida Solar Energy Center. 2007.
- ↑Rogers H.C. (1999). „Hydrogen Embrittlement of Metals”.Science.
- ↑Opća i nacionalna enciklopedijau 20 svezaka, sv. 20,ISBN978-953-7224-20-2,str. 281
- ↑Emsley John (2001).Nature's Building Blocks.Oxford University Press.
- ↑„NTS-2 Nickel-Hydrogen Battery Performance 31”.Aiaa.org. 2009. Arhivirano izoriginalana datum 2009-08-10.Pristupljeno 2015-04-22.
- ↑Crepeau Bob (2006). „Niels Bohr: The Atomic Model”.Great Scientific Minds(Great Neck Publishing).
- ↑Berman R., Cooke, A. H.; Hill, R. W. (1956). „Cryogenics”.Annual Review of Physical Chemistry.
- ↑Steve Gagnon (2008).„Hydrogen”.Jefferson Lab.
- ↑Haubold Hans, Mathai, A. M. (2007).Solar Thermonuclear Energy Generation.Columbia University. Arhivirano izoriginalana datum 2006-03-10.Pristupljeno 2015-04-22.
- ↑Storrie-Lombardi Lisa J. (2000). „Surveys for z > 3 Damped Lyman-alpha Absorption Systems: the Evolution of Neutral Gas”.Astrophysical Journal.
- ↑Wolfgang H. Berger (2007).„The Future of Methane”.University of California, San Diego.Pristupljeno 2008.
- ↑[1]Arhivirano2012-10-27 naWayback Machine-u"Development of solar-powered thermochemical production of hydrogen from water" 2005
- ↑Perret Robert (2007).„Development of Solar-Powered Thermochemical Production of Hydrogen from Water”.DOE Hydrogen Program.Arhivirano izoriginalana datum 2012-10-27.Pristupljeno 26 maj 2018.
- ↑„Hydrogen”.Chemistry Operations.Los Alamos National Laboratory. 2003. Arhivirano izoriginalana datum 2010-01-11.Pristupljeno 2008.
- ↑Takeshita Wallace (1974). „Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt”.Inorganic Chemistry.
- ↑Matthias Block (2004).„Hydrogen as Tracer Gas for Leak Detection”.Sensistor Technologies.
- ↑McCarthy John (1995).„Hydrogen”.Stanford University.
- ↑„DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy”.US Department of Energy. 2006. Arhivirano izoriginalana datum 2011-07-19.Pristupljeno 2015-04-22.
- ↑Van de Walle (2007). „Hydrogen multicentre bonds”.Nature Materials.
- ↑Williams Chris (2006).„Pond life: the future of energy”.The Register.
- ↑„Hydrogen Safety”.Humboldt State University. 2010. Arhivirano izoriginalana datum 2011-03-26.Pristupljeno 2015-04-22.
- Chart of the Nuclides(17th izd.). Knolls Atomic Power Laboratory. 2010.ISBN978-0-9843653-0-2.
- Ferreira-Aparicio, P; Benito, M. J.; Sanz, J. L. (2005). „New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers”.Catalysis Reviews47(4): 491–588.DOI:10.1080/01614940500364958.
- Newton, David E. (1994).The Chemical Elements.New York: Franklin Watts.ISBN0-531-12501-7.
- Rigden, John S. (2002).Hydrogen: The Essential Element.Cambridge, Massachusetts: Harvard University Press.ISBN0-531-12501-7.
- Romm, Joseph, J. (2004).The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate.Island Press.ISBN1-55963-703-X.
- Scerri, Eric (2007).The Periodic System, Its Story and Its Significance.New York: Oxford University Press.ISBN0-19-530573-6.
- Vodik (PSE) - Kemijsko-tehnološki fakultet SplitArhivirano2004-08-07 naWayback Machine-u
- Basic Hydrogen Calculations of Quantum MechanicsArhivirano2006-06-12 naWayback Machine-u
- HydrogenatThe Periodic Table of Videos(University of Nottingham)
- High temperature hydrogen phase diagramArhivirano2016-03-04 naWayback Machine-u
- Wavefunction of hydrogen
- Low Energy Linear Accelerator - Monatomic Hydrogen diagramArhivirano2013-11-12 naWayback Machine-u
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Alkalijski metali | Zemnoalkalijski metali | Lantanoidi | Aktinoidi | Prijelazni metali | Slabi metali | Polumetali | Nemetali | Halogeni elementi | Plemeniti plinovi |





