Zakon održanja mase
Zakon održanja mase(ilizakon očuvanja mase) predstavlja eksperimentalno utvrđenu činjenicu da je u hemijskim reakcijamamasareaktanata jednaka masi proizvoda reakcije. S obzirom na to da u nuklearnim reakcijama i pri velikim brzinama (uporedivim sabrzinom svetlosti) dolazi do pretvaranja mase u energiju ili obrnuto, može se smatrati specijalnim slučajemzakona o održanju materije.
Površnim posmatranjem nekih procesa u prirodi (kao što su rast drveta,sagorevanjesveće iliisparavanjevode) može se doći do ubeđenja damaterijamože nastati i nestati. Međutim pažljivim posmartanjem može se utvrditi da ovo nije slučaj. Materija može da promeni svoj oblik,agregatno stanjei sl. ali ne može nastati ni iz čega ili nestati.
Ovaj zakon se ponekada i nazivazakon o neuništivosti materije,koji glasi:Materija se ne može uništiti, niti ni iz čega stvoriti, ona može samo da se menja i da prelazi iz jednog u drugi oblik.
Zakon neuništivostimaterijese izražavajednadžbom kontinuiteta.
Zakon održanja materije, jedan od najstarijih zakona fizike, formulisan je još u antičkoj Grčkoj, ali bez eksperimentalne potvrde.
A. L. Lavoazije(Lavoisier) je1774.u eksperimentu u kome je zagrevaokalajsavazduhomu zatvorenom sudu primetio da je težina celog sistema ista pre i posle hemijske reakcije. Ovaj eksperiment je ukazao na činjenicu da nema pre i posle reakcije nema promene količine materije. Na osnovu svojih pokusa, Lavoazije je formulirao Zakon o održanju mase na sledeći način:
- Nikakve se promjene ne mogu opaziti u ukupnoj masi svih tvari koje sudjeluju u kemijskoj reakciji..
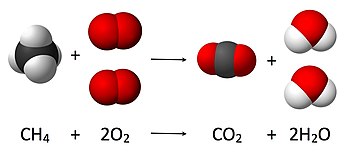
Na primjer, reakcija vodika s kisikom i nastanak vode:
Rezultat:
Kako jeLomonosovformulisao sličnu pravilnost nešto ranije (1748.ili1756), zakon se ponekad zove i Lavoazje-Lomonosovljev zakon.
Ovaj zakon može se definisati:
Ukupna masa supstanci koje ulaze u reakciju jednaka je ukupnoj masi proizvoda reakcije. Ako A i B predstavljaju mase dveju supstanci koje učestvuju u nekoj hemijskoj reakciji pri kojoj nastaju mase C i D drugih dveju (hemijski promenjenih) supstanci,zakon o održanju masese može izraziti kao:
A+B = C+D
H.Landolt(1893) i A.Heydweiller(1901) su izvršilieksperimenteda bi potvrdili tačnost ovogzakona.Hans Landolt(1831.-1910.), švicarski fizički kemičar, vrlo je preciznim mjerenjima potvrdio taj zakon s točnošću1: 107.
J. J.Maleyje 1912. godine upotrebio vagu koja je bila znatno usavršena da bi se otklonio nedostatak gore navedenih eksperimenata. On je uspeo da dokaže da u slučaju reakcije između barijumhlorida i natrijumsulfata, svaka promena u masi mora biti manja od jednog milionitog dela.
PremaEinsteinovojteoriji relativnosti,materija (kao oblik energije) i energija mogu prelaziti jedna u drugu, u međusobnom odnosu koji je definisan poznatomAjnštajnovomjednačinom:
- E = mc2
Drugim rečima, umesto dva fundimentalna zakona: zakona o održanju mase i zakona o držanju energije, postoji samo jedan princip. Međutim, pri bilo kojoj hemijskoj promeni praćenoj promenom temperature, desiće se i odgovarajuća promena mase. Po Ajnštajnovoj formuli, mora se dio ukupne mase (m) reaktanata pretvoriti u energiju (E) kemijske reakcije prema relaciji:E = mc2,gdje jecbrzina svjetlosti(2,997925• 108ms-1). Odatle slijedi da bi točnost vaganja morala biti najmanje1:1010da bi se ustanovio gubitak mase.




