Ензим
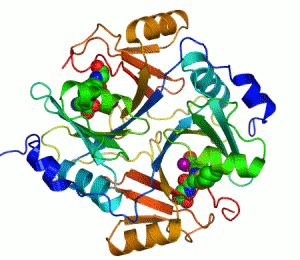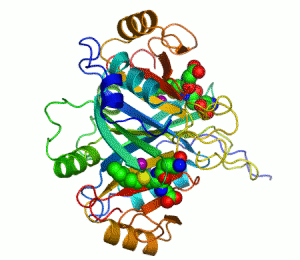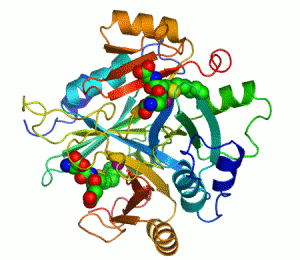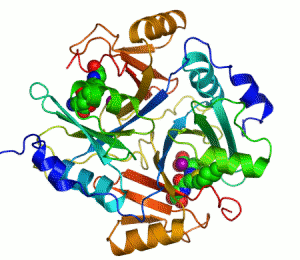

Ензим је биолошки катализатор, тј има моћ да утиче на брзину хемијске реакције.[1][2]
Ензими су неопходни како би живот био могућ, јер многе реакције које се одвијају у ћелијама организма су превише споре и водиле би до другачијих продуката које организму или нису потребни или би му штетили. Квар, генетичке мутације, недовољна или повећене производња, једног јединог ензима може да буде буде главни узрок тешких генетичких поремећаја. На пример, поремећај фенилкетонурија је резултат недостатка ензима фенилаланин хидроксилаза, који катализује први корак у разлагању амино киселине фенилаланина. Ако овај ензим не функционише како треба, и не разложи амино киселину, неограничена производња фенилаланина води до менталне ретардације. Поред фенилкетонурије постоји још читав низ обољења, заједнички названих ензимопатије, чији је узрок мутација гена, а последица недостатак неког ензима.
Као и сви катализатори ензими функционишу тако што снижавају активациону енергију реакције, и на тај начин је убрзавају. Ензими могу да убрзају реакције на нивоу од по неколико милиона пута. Ензим, као сваки катализатор, остаје непромењен реакцијом на коју утиче и то му омогућава да, кад се једна реакција заврши, укључи у другу, потпуно непромењен. Такође ензими не утичу на релативну енергију између реагената и продуката, тако да не утичу на еквилибријум реакције. Међутим, оно што ензим одваја од свих осталих катализатора је њихова специфичност у погледу стереохемије, хемијске селективности и специфичности.
Основна идеја ензима је та да се на ензим повежу молекули реакције на коју ензим делује, створи се комплекс састављен од ензима и молекула који није дугорочан, и из тог комплекса, односно те интеракције, имамо производ те рекације, док ензим остаје потпуно непромењен реакцијом. Ово је приказано графички:
Ензими се такође свакодневно користе у продуктима као што су детерџенти за судове, веш, и разне друге кућне хемикалије.
Данас је познато више од 5.000 ензима. Номенклатура ензима нам помаже при именовању овог великог броја ензима, и по њој ензимима се даје име које се завршава са -за, а префикс је хемијска ступстанца која трансформише, односно на коју ензим утиче. На пример, ензима који има улогу у ДНК репликацији и који врши реакцију полимеризације молекула ДНК се назива ДНК полимераза.
Историја
[уреди | уреди извор]
Термин ензим је пореклом из грчког језика ένζυμο и значи закиселити. Крајем 1700. и почетком 1800, научници су приметили реакције које настају варењем меса помоћу жучних киселина и реакције које прате конверзацију декстрина у шећер.
Проучавањем ферментације шећера у алкохол помоћу квасца, Луј Пастер је дошао до закључка да је ферментација могућа услед постојања фермената у квасцу, за које је мислио да су присутне само у живим организмима.
1897. Ханс и Едуард Бухнер су користили екстракте квасца како би ферментисали шећер без присуства живих ћелија квасца. Они су били заинтересовани у прављење екстраката квасца у медицинске сврхе, и један од начина чувања, је био додавање велике количине шећера у екстракте. На њихово изненађење, открили су да је шећер ферментисан, иако у целој смеси није било присутних живих ћелија квасца. Термин ензим је коришћен тад први пут и описује супстанцу у екстракту квасца који је довео до ферментације шећера.
3-D Структура
[уреди | уреди извор]Дуго се сматрало да су сви ензими по хемијском саставу протеини. Међутим, као што у биохемији често бива, имамо изузетак у виду неколико врста рибонуклеинских киселина (РНК) које се специфично називају рибозими. Сматра се да су РНК вероватно биле и први катализатори у еволуцији живе материје.
Што се протеинских ензима тиче, а они чине велику већину ензима у људском телу, њихова фукнција је као и код других протеина, одређена структуром. Ензим може бити:
- Мономеричан, што значи да садржи само један полипептидни ланац, обично од сто или више амино киселина
- Олигомеричан, односно садржи већи број полипептидних ланаца, који могу бити или идентични или да се разликују, али који функционичу заједно као једна јединица.
Као и сваки протеин, мономер је један дугачак линеаран ланац амино киселина, који се савија и повија на одређени начин и за продукат има тродимензионалну структуру.
Већина ензима су обично већи молекули од оних молекула на које делују, и свега десетак амино киселина ензима дође у директан контакт са молекулом који бива трансформисан. Регион у којем долази до тог директног контакта ензима и молекула се назива Активни регион. Већи број ензима такође има додатне регионе за кофакторе који су потребни при катализацији реакције. Контакти између молекула на који се делује и постојећих кофактора убрзава или успорава активност ензима по потреби.
Специфичност
[уреди | уреди извор]Ензими су углавном веома специфични кад су у питању реакције које употребљавају са молекулима на које делују. Облик, форма, структура, наелектрисање, хидрофилни и хидрофобни карактер ензима као и молекула утичу на ову специфичност.
Хипотеза кључа и браве
[уреди | уреди извор]Најуочљивија карактеристика ензима је њихова специфичност. Емил Фишер је 1890. године констатовао да је ова хипотеза коректна услед специфичности облика ензима и молекула на које они делују. Сваки молекул на који одређени ензим утиче, има тачно одређени облик, помоћу којег се молекуле повеже на тачно одређени ензим. На пример, ако је молекул на који ензим утиче у облику коцке, а сам ензим има регион у облику троугла на који молекул треба да се надовеже, до повезивања неће доћи, јер у том случају ензим није коректан за тај молекул. Ова хипотеза се зато и назива хипотеза кључа и браве, јер је сваки кључ специфичан за сваку браву коју откључава. Овај модел је данас у великој мери напуштен због ригидности с којом посматра ензим и супстрат, као и услед немогућности да се њиме објасне алостеризација и ензимска кооперативност.
Хипотеза Индукованог прилагођавања
[уреди | уреди извор]
1958. Данијел Кошланд је предложио модификацију хипотезе Кључ и брава која је названа хипотеза Индукованог прилагођавања (енг. Индуцед-Фит-Модел). Ензими су веома флексибилне структуре. Аткивни регион ензима може бити модификован како би дошло до интеракције молекула и ензима. Ланци амино киселина се могу преклапати на тај начин који би одговарао ензиму, како би дошло до интеракције, и на тај начин ензим могао да изврши своју каталитичку функцију. У веома ретким случајевима, молекули при уласку у Активни регион могу да се прилагоде ензиму, како би дошло до интеракције ензима и молекула. Аналогија слична овој је на пример када облачимо рукавицу, и како се рукавица прилагођава нашој руци, како би се савршено прилагодила руци.
Кофактори
[уреди | уреди извор]
1. аденозин трифосфат (АТП)
2. пирофосфат
3. пантоичка киселина
4. β-аланин (3 + 4 = пантотенска киселина)
5. цистеамин
Реактивни дио молекуле је тиолна скупина (-СХ) на цистеамину. Управо се зато слободни коензим А означава кратицама ЦоАСХ или ХСЦоА.
Неки ензими су као самосталне јединице саме себи довољне да би биле потпуно активне, тј. нису им потребни додатни фактори да би се та активност постигла. Међутим, неким ензимима су потребни молекули који би помогли при активирању ензима, и ти молекули се зове кофактори. Кофактори могу бити неорганског порекла, као на пример јони метала, или могу да имају органско порекло, и као такви се називају коензими. Ензими којима су потребни кофактори, а тренутно их немају се називају апоензими. Ензим који је повезан са својим кофактором, назива се холоензим, и тај облик представља активни облик ензима. Већина кофактора није ковалентно повезана са ензимима, али има и оних који су ковалентним везама повезани за ензим, и као такви, кофактори се називају простетична група нпр. кофактор хем је повезан ковалентном везом за хемоглобин.
Већина кофактора су или регенерисани или хемијски непромењени током и после реакције у којој учествују. Велики број кофактора су деривати витамина и служе као транспортна тела за транспорт електрона, атома или функционалних група, од ензима ка молекулу. Најчешћи примери су НАД и НАДП, који су транспортна тела за електроне, и Коензим А, који је транспортно тело за ацетилну групу.
Термодинамика
[уреди | уреди извор]
Као са свим катализаторима, све реакције на које утиче ензим, тј. које су катализаторског типа, морају бити спонтанте, односно вредност Гибсове слободне енергије мора бити негативна. Без ензима реакције се крећу у устом правцу као и са ензимом, али много мањом брзином, где долази улога ензима, а то је убрзање брзине реакције. Међутим, некатализиране спонтане реакције могу довести до другачијих продуката од катализираних реакција, тј. од реакција у којима су присутни ензими. Такође ензими могу да утичу на више реакција истровремено, тако да она реакција која је са термодинамичке тачке гледишта боља, тј. има веће шансе да буде реализована, може да повуче са собом ону реакцију која није, и на тај начин обе реакције су реализоване. На пример, цепање једињења које поседује веома велику енергију АТП (Аденозин-три-фосфат) је са термодинамичке тачке гледишта успешна реакција, и она заузврат помаже реакцијиама које нису, а на које истовремено делује исти ензим као и на цепање АТП реакције.
Ензими катализују реакције у оба смера једнако. Ензими никад не мењају еквилибријум реакције, већ само брзину која доводи до стварања тог еквилибријума, тј. равнотеже.
Кинетика
[уреди | уреди извор]Године 1913. Леонор Микелис и Мауд Ментен су представили квантитативну теорију кинетике ензима, која је данас позната под именом Микелис-Ментенина теорија кинетике.[3] Њихов рад је даље усавршио Г. Е. Бригс и Џ. Б. С. Халден, који су разрадили велики број кинетичких једначина које се и данас користе.[4]
Ензими могу да изведу и до неколико милиона рекације у једној секунди. Да би се утврдила максимална брзина реакције, концентрација молекула на који ензим делује се увећава све док се не достигне константна рата производње, односно формације хемијских продуката. Ово је максимална брзина ензима Vмаx. У овом кораку, сви региони ензима су у интеракцији са молекулом, односно великим бројем истих молекула на које ензим делује. Vмаx је једна од кинетичких параметара за који су биохемичари заинтересовани. Такође од интереса је рата, односно стопа реакције, а то је одређено количином молекула на који ензима делује. Овај параметар, концентрација молекула се означава Микелис-Ментен константом Км), и та константа представља концентрацију молекула како би ензим достигао половину своје максималне брзине. Сваки ензим има карактеристичну константу Км за дати, односно одређени молекул.
Ефикасност ензима може бити представљена кцат/Км. Параметар кцат се такође назива производни број, који узима у обзир све кораке реакције, и количник је Vмаx као и крајње свеукупне концентрације ензима. кцат/Км је користан параметар при компарацији, односно упоређивању једног ензима наспрам другог, или једног ензима наспрам свог молекула, јер се узимају оу обзир и афинитет као каталитичка способност. Теоријски максимум за кцат/Км зе назива дифузијски лимит, тј. ограничење реаспрострањености, и оно је између 108 то 109 (M−1 с−1). У овом кораку, тј. у овом моменту, сваки судар, тј. сваки контакт ензима са својим молекулом ће имати за резултат катализу и брзина формирања продуката није ограничена брзином реакције, већ ограничењем распрострањености, тј. дифузијским лимитом. Ензими који достигну кцат/Км вредност се називају каталитички савршеним или кинетички савршеним. Примери таквих ензима су трио-фосфатна изомераза, угљеникова анхидраза, фумараза, ацетилхолинестераза.
Брзина ензимских реакција зависи од услова раствора и концентрације супстрата. Да би се одредила максимална брзина ензиматске реакције, концентрација супстрата се повећава док се не достигне константна брзина формирања продукта. То је приказано кривом засићења. До засићења долази зато што са повећањем концентрације супстрата, све више и више слободног ензима бива конвертовано у ЕС (ензим - супстрат) комплекс. При максималној ензимској брзини реакције (Vмаx), сва активна места ензима су везана за супстрат, и количина ЕС комплекса је једнака тоталној количини ензима.[5]:8.4
Инхибиција
[уреди | уреди извор]Брзине ензимских реакција се могу умањити дејством различитих типова ензимских инхибитора.[6]:73–74
Типови инхибиције
[уреди | уреди извор]- Компетитивни
- Компетитивни инхибитор и супстрат не могу да се истовремено вежу за ензим.[7] Компетитивни инхибитори су често веома слични стварном ензимском субстрату. На пример, лек метотрексат је компетитивни инхибитор ензима дихидрофолатна редуктаза, који катализује редукцију дихидрофолата до тетрахидрофолата. Сличност између структура дихидрофолата и тог лека је приказана на слици. Овај тип инхибиције се може превазићи применом високих концентрација супстрата. У неким случајема, инхибитор се може везати за различито место од места везивања супстрата и тиме извршити алостерни утицај којим се мења облик уобичајеног места везивања.
- Некомпетитивни
- Некомпетитивни инхибитор се везује на различито место од места везивања супстрата. Субстрат се још увек везује са својим уобичајеним афинитетом и стога Км остаје исти. Међутим инхибитор редукује каталитичку ефикасност ензима тако да се Vмаx смањује. У контрасту са компетитивном инхибицијом, некомпетитивна инхибиција се не може превазићи високом концентрацијом супстрата.[6]:76–78
- Антикомпетитивни
- Антикомпетитивни инхибитор се не може везати за слободни ензим, него само за комплекс ензима и супстрата. Из тог разлога овај тип инхибитора је најефективнији при високом концентрацијама супстрата. У пресуству инхибитора, комплекс ензима и супстрата је неактиван.[6]:78 Тхис тyпе оф инхибитион ис раре.[8]
- Мешовити
- Мешовити инхибитори се везују за алостерно место, и везивање супстрата и инхибитора утиче једно на друго. Ензимска функција бива редукована али се не елиминише везивањем инхибитора. Овај тип инхибитора не следи Михаелис-Ментенову једначину.[6]:76–78
- Иреверзибилни
- Иреверзибилни инхибитор перманентно инактивира ензим, обично путем формирања ковалентне везе са протеином. Пеницилин[9] и аспирин[10] су лекови у широкој употреби који делују на такав начин.
Функције инхибитора
[уреди | уреди извор]У многим организмима, инхибитори могу да делују као компонента повратног механизма. Ако ензим производи превелику количину једне супстане у организму, та супстанца може да делује као инхибитор ензима на почетку пута којим се она формира, узрокујући успоравање продукције супстанце, или заустављање процеса кад је супстанца присутна у довољној количини. Ово је облик негативне повратне спреге. Главни метаболички путеви, као што је циклус лимунске киселине, користе овај механизам.[5]:17.2.2
Пошто инхибитори модулирају функцију ензима, они се често користе као лекови. Многи такви лекови су реверзибилни компетитивни инхибитори који структурно подсећају на природни супстрат ензима, попут метотрексата. Други добро познати примери су статини, који се користе за третирање високих нивоа холестерола,[11] и протеазни инхибитори који се користе у третману ретровиралних инфекција, као што је ХИВ.[12] Познати пример иреверзибилног инхибитора који се користи као лек је аспирин, који инхибира ензиме ЦОX-1 и ЦОX-2 који производе инфламационог гласника, простагландина.[10] Инхибитори ензима могу да буду отрови. На пример, отров цијанид је иреверзибилни ензимски инхибитор који се комбинује са бакром и гвожђем у активном месту ензима цитохром ц оксидаза и блокира ћелијско дисање.[13]
Номенклатура ензима
[уреди | уреди извор]Према конвенцији, име ензима се састоји од назива радње коју обавља, и суфикса -аза. На пример, имамо ензим који се зове ДНК полимераза. Из овога можемо да закључимо да ензим врши полимеризацију ДНК молекула, и ензим се завршава са суфиксом -аза. Други пример, имамо ензим Алкохол дехидрогеназа, за којег можемо да закључимо да врши дехидрогенизацију алкохола и ензим се опет завршава са -аза.
Киназе су ензими који учествују у трансферу фосфатних група. У овом случају таквих ензима има јако пуно, што би довело до конфузије јер би се појавило пуно ензима за истом функцијом. У овом случају, поред горе наведених примера давања имена, додају су карактеристике специфичне за дати ензим, као на пример оптимална пХ вредност (пример оваквог ензима је ензим Алкална фосфатаза).
Међународна Унија Биохемије и Молекуларне Биологије је развила номенклатуру по којој се ензими називају. Сваки ензим садржи у имену (латиница ЕС број) ЕЦ број (комисациони број ензима, или на енглеском Ензyме Цоммиссион нумбер)и ред од четири броја. Ради објашњавања сви појмови у давању имена ензима ће у даљем тексту бити писана латиницом по правилу номенклатуре.
Дакле, први (од четири броја) нашироко класификује ензим на основу механизма:
| Група | Катализована реакција | Типична реакција | Пример ензими |
| ЕЦ 1 Оксидоредуктазе |
катализују оксидо-редукционе реакције; врше трансфер водоникових и кисеоникових атома са једног молекула на други | АХ + Б → А + БХ (редукована) А + О → АО (оксидована) |
Дехидрогеназа, Оксидаза |
| ЕЦ 2 Трансферазе |
врше трансфер функционалних група (нпр. трансфер метил групе или фосфатне групе) | АБ + C → А + БЦ | Киназе |
| ЕЦ 3 Хидролазе |
катализују хидролитичне реакције | АБ + Х2О → АОХ + БХ | Липаза, Амилаза, Пептидаза |
| ЕЦ 4 Лиазе |
цепају или кидају различите хемијске везе (изузеци су хидролитичне и оксидативне реакције, јер су ти ензими тих реакције већ поменути у горњим групама). C-C, C-Н, C-О или C-С везе се кидају | РЦОЦООХ → РЦОХ + ЦО2 | |
| ЕЦ 5 Изомеразе |
катализују реакције изомеризације у појединачном молекулу | АБ → БА | Изомераза |
| ЕЦ 6 Лигазе |
спајају молекуле са ковалентним везама: C-О, C-С, C-Н и C-C | X + Y+ АТП → XY + АДП + Пи | ДНК Лигаза |
За комплетну листу ензима по горе наведеној номеклатури, видети следећу страницу [1]
Употреба ензима
[уреди | уреди извор]Ензими су неопходни у свакодневном животу, од функционисање организма до свакодневних кућних послова.
- Ензим Протеаза се добија из бактерија, а користи се у супстанцама као што је детерџент. Ензим помаже у уклањању мрља са тканина и одеће.
- Ензим Амилоглукосидаза се користи при производњи пива, јер се помоћу овог ензима производи ниско калорично пиво.
- Ензим Липаза је нашао употребу у прехрамбеној индустрији и користи се веома пуно при прављењу Буђавог сира.
Референце
[уреди | уреди извор]- ↑ Смитх 1997
- ↑ Грисхам & Гарретт 1999: стр. 426–427
- ↑ Мицхаелис, L; Ментен, M (1913). „Дие Кинетик дер Инвертинwиркунг” [Тхе Кинетицс оф Инвертасе Ацтион] (Герман). Биоцхем. З. 49: 333–369. ДОИ:10.1021/bi201284u.; Мицхаелис, L; Ментен, ML; Јохнсон, КА; Гоодy, РС (2011). „Тхе оригинал Мицхаелис цонстант: транслатион оф тхе 1913 Мицхаелис-Ментен папер”. Биоцхемистрy 50 (39): 8264–9. ДОИ:10.1021/bi201284u. ПМЦ 3381512. ПМИД 21888353.
- ↑ Бриггс, ГЕ; Халдане, ЈБ (1925). „А Ноте он тхе Кинетицс оф Ензyме Ацтион”. Тхе Биоцхемицал Јоурнал 19 (2): 339–339. ПМЦ 1259181. ПМИД 16743508.
- ↑ 5,0 5,1 Стрyер L, Берг ЈМ, Тyмоцзко ЈЛ (2002). Биоцхемистрy (5тх изд.). Сан Францисцо: W.Х. Фрееман. ИСБН 0-7167-4955-6.
- ↑ 6,0 6,1 6,2 6,3 Цорнисх-Боwден А (2004). Фундаменталс оф Ензyме Кинетицс (3 изд.). Лондон: Портланд Пресс. ИСБН 1-85578-158-1.
- ↑ Прице, НЦ (1979). „Wхат ис меант бy 'цомпетитиве инхибитион'?”. Трендс ин Биоцхемицал Сциенцес 4 (11): Н272–Н273. ДОИ:10.1016/0968-0004(79)90205-6.
- ↑ Цорнисх-Боwден, А (Јул 1986). „Wхy ис унцомпетитиве инхибитион со раре? А поссибле еxпланатион, wитх имплицатионс фор тхе десигн оф другс анд пестицидес”. ФЕБС Леттерс 203 (1): 3–6. ДОИ:10.1016/0014-5793(86)81424-7. ПМИД 3720956.
- ↑ Фисхер, ЈФ; Мероуех, СО; Мобасхерy, С (Феб 2005). „Бацтериал ресистанце то бета-лацтам антибиотицс: цомпеллинг оппортунисм, цомпеллинг оппортунитy”. Цхемицал Ревиеwс 105 (2): 395-424. ДОИ:10.1021/cr030102i. ПМИД 15700950.
- ↑ 10,0 10,1 Јохнсон, ДС; Wеерапана, Е; Цраватт, БФ (Јун 2010). „Стратегиес фор дисцоверинг анд дерискинг цовалент, ирреверсибле ензyме инхибиторс”. Футуре Медицинал Цхемистрy 2 (6): 949–64. ДОИ:10.4155/fmc.10.21. ПМИД 20640225.
- ↑ Ендо А (1 Новембер 1992). „Тхе дисцоверy анд девелопмент оф ХМГ-ЦоА редуцтасе инхибиторс” (ПДФ). Ј. Липид Рес. 33 (11): 1569–82. ПМИД 1464741.
- ↑ Wлодаwер, А; Вондрасек, Ј (1998). „Инхибиторс оф ХИВ-1 протеасе: а мајор суццесс оф струцтуре-ассистед друг десигн”. Аннуал Ревиеw оф Биопхyсицс анд Биомолецулар Струцтуре 27: 249-84. ДОИ:10.1146/annurev.biophys.27.1.249. ПМИД 9646869.
- ↑ Yосхикаwа, С; Цаугхеy, WС (Маy 1990). „Инфраред евиденце оф цyаниде биндинг то ирон анд цоппер ситес ин бовине хеарт цyтоцхроме ц оxидасе. Имплицатионс регардинг оxyген редуцтион”. Тхе Јоурнал оф Биологицал Цхемистрy 265 (14): 7945–58. ПМИД 2159465.
Литература
[уреди | уреди извор]- Грисхам, Цхарлес M.; Гарретт, Региналд Х. (1999). Биоцхемистрy. Пхиладелпхиа: Саундерс Цоллеге Пуб. стр. 426-7. ИСБН 0-03-022318-0.
- Смитх, ур. (1997). Оxфорд дицтионарy оф биоцхемистрy анд молецулар биологy. Оxфорд [Оxфордсхире]: Оxфорд Университy Пресс. ИСБН 0-19-854768-4.
- Косхланд D. Тхе Ензyмес, в. I, цх. 7, Ацад. Пресс, Неw Yорк, 1959
- Перутз M. Проц. Роy. Соц., Б (1967) 167, 448,
- Цха, Y., Мурраy, C. Ј. & Клинман, Ј. П. Сциенце (1989) 243, 1325-1330.
- Леонор Мицхаелис, Мауд Ментен, Дие Кинетик дер Инвертинwиркунг, Биоцхем. З. (1913) 49, 333-369.
- Г. Е. Бриггс анд Ј. Б. С. Халдане, А ноте он тхе кинетицс оф ензyме ацтион, Биоцхем. Ј., (1925) 19, 339-339.
- Р.Р. Догонадзе анд V.Г. Левицх. Тхеорy оф Нон-радиативе Елецтрониц Транситионс бетwеен Ионс ин Солутион, Доклади Академии Наук СССР. Сер. Физицхескоy Кхимии, Мосцоw, Вол. 124, 1959, 123-126.
- Р.Р. Догонадзе. Рате оф Елецтрон Трансфер Реацтионс ин Солутионс, Доклади Академии Наук СССР. Сер. Физицхескоy Кхимии, Мосцоw, Вол. 133, 1960, 1368-1371.
- Нисхимура M анд Цханце Б. Биоцхим Биопхyс Ацта. (1963) 66, 1-16.
- V.Г. Левицх, Р.Р. Догонадзе, Е.D. Герман, А.M. Кузнетсов анд Yу.I. Кхаркатс. Тхеорy оф Хомогенеоус Реацтионс Инволвинг Протон Трансфер, Елецтроцхим.Ацта, 15, 1970, 353-367.
- M.V. Волкенсхтеин, Р.Р. Догонадзе, А.К. Мадумаров, З.D. Урусхадзе, Yу.I. Кхаркатс. Тхеорy оф Ензyме Цаталyсис.- Молекулиарнаyа Биологиа, (1972), 431-439 (Ин Руссиан, Енглисх суммарy)
- Берг, Јеремy M; Тyмоцзко, Јохн L; Стрyер, Луберт (2002). Биоцхемистрy (5тх изд.). Неw Yорк, НY: W. Х. Фрееман. ИСБН 0-7167-3051-0., А биоцхемистрy теxтбоок аваилабле фрее онлине тхроугх НЦБИ Бооксхелф.
- Цорнисх-Боwден, Атхел, ур. (1997). Неw Беер ин ан Олд Боттле: Едуард Буцхнер анд тхе Гроwтх оф Биоцхемицал Кноwледге. Университат де Валèнциа. ИСБН 84-370-3328-4. Архивирано из оригинала на датум 2010-12-13. Приступљено 2015-04-28., А хисторy оф еарлy ензyмологy.
- Сузуки Х (2015). Хоw Ензyмес Wорк: Фром Струцтуре то Фунцтион. Боца Ратон, ФЛ: ЦРЦ Пресс. ИСБН 978-981-4463-92-8.
- Цорнисх-Боwден, Атхел (2012). Фундаменталс оф Ензyме Кинетицс (4тх изд.). Wеинхеим: Wилеy-ВЦХ. ИСБН 978-3527330744.
- Јеремy M. Берг, Јохн L. Тyмоцзко, Луберт Стрyер: Биоцхемие. 5. Ауфлаге. Спектрум Академисцхер Верлаг, Хеиделберг – Берлин 2003, ИСБН 3-8274-1303-6.
- Давид Фелл: Ундерстандинг тхе Цонтрол оф Метаболисм. Портланд Пресс Лтд, Лондон 1997, 2003, ИСБН 1-85578-047-X.
- Алфред Сцхелленбергер (Хрсг.): Ензyмкаталyсе. Еинфüхрунг ин дие Цхемие, Биоцхемие унд Тецхнологие дер Ензyме. Густав Фисцхер Верлаг, Јена 1989. ИСБН 3-540-18942-4
- Доналд Воет, Јудитх Г. Воет: Биоцхемистрy. 3. Ауфлаге. Јохн Wилеy & Сонс Инц., Лондон 2004, ИСБН 0-471-39223-5.
- Мариа-Регина Кула: Ензyме ин дер Тецхник, Цхемие ин унсерер Зеит, 14. Јахрг. 1980, Нр. 2, С. 61–70, ИССН 0009-2851
- Бригитте Остератх, Нагарај Рао, Степхан Лüтз, Андреас Лиесе: Тецхнисцхе Анwендунг вон Ензyмен. Цхемие ин унсерер Зеит 41(4), С. 324–333 (2007), ИССН 0009-2851
Спољашње везе
[уреди | уреди извор]- ПДБсум Архивирано 2005-12-19 на Wаyбацк Мацхине-у Датотека познатих 3Д структура ензима
- БРЕНДА, компилација информација и литературе свих понзатих ензима
- Цитохром П450 ензими Архивирано 2004-08-16 на Wаyбацк Мацхине-у





