Izotop
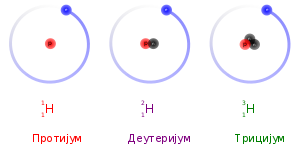

Izotopisuatomihemijskog elementačije jezgro ima istiatomski broj,Z,ali različituatomsku masu,A.Rečizotop,značina istom mestu,i dolazi od činjenice da se izotopi nalaze na istom mestu uperiodnom sistemu elemenata.Izotopni odnosje stalni odnos izotopa u hemijskim elementima u prirodi, i karakteristična veličina za svaku atomsku vrstu.
Atomski brojodgovara brojuprotonau atomu, Stoga izotopi datog elementa sadrže jednak broj protona. Razlika u atomskim masama potiče iz razlike u brojuneutronauatomskom jezgru.U naučnojnomenklaturi,izotopi se označavaju imenima datog elementa iza kog sledi crtica, pa broj nukleona (protona i neutrona) u atomskom jezgru (npr., helijum-3,ugljenik-12,ugljenik-14,gvožđe-57,uranijum-238). U simboličkoj formi, broj nukleona se iskazuje iznadhemijskog simbolasa leve strane (npr.,3He,12C,14C,57Fe,238U).[1]
Izotopi svih elementa obrazuju skupnuklida.Nuklid je definicija za određeno atomsko jezgro i definiše se rednim brojemZi masenim brojemA:AZHh (32He,23892U) Strogo govoreći, pre bi trebalo reći da se element kao na primerfluorsastoji od jednog nuklida nego od jednog izotopa.[2]
U neutralnom atomu, brojelektronaje jednak broju protona. Stoga, izotopi datog elementa takođe imaju i isti broj elektrona i istu elektronsku strukturu. Kako je hemijsko ponašanje atoma u najvećoj meri određeno njegovom elektronskom strukturom, izotopi imaju skoro identične hemijske osobine. Glavni izuzetak je, da, usled većih masa, teži izotopi imaju tendenciju da reaguju nešto sporije od lakših izotopa. Ovaj „efekat mase “, iliizotopski efekatje najizraženiji zaprotijum(1H) ideuterijum(uobičajen naziv za2H), jer deuterijum ima duplo veću masu od protiuma. Kod težih elemenata je relativna razlika u masi mnogo manja, pa je efekat mase obično zanemarljiv.
Mada izotopi imaju skoro identične elektronske i hemijske osobine, njihove nuklearne osobine se dramatično razlikuju. Atomsko jezgro se sastoji iz protona i neutrona koje na okupu držijaka nuklearna sila.Kako su protoni pozitivno naelektrisani, oni se međusobno odbijaju. Neutroni koji su elektroneutralni prave određenu distancu između protona, redukuju elektrostatičko odbijanje i stabilizuju jezgro. Iz ovog razloga su potrebni neutroni da bi se dva ili više protona vezali u jezgro. Kako broj protona raste, potrebni su dodatni neutroni da bi se formiralo stabilno jezgro, na primer, iako je odnos neutron/proton kod3He 1/2, neutron/proton odnos kod238U je >3/2. Ipak, ako je prisutno previše neutrona, jezgro postaje nestabilno.
Kako izotopi datog elementa imaju različit broj neutrona, oni imaju i različit odnos neutron/proton. Ovo utiče na njihovu nuklearnu stabilnost, što rezultuje činjenicom da neki izotopi podležunuklearnom raspadu.Raspad ovihradioaktivnih izotopa(kraće radioizotopa) je važna tema unuklearnoj fizici.Proučavanjem načina na koji se ovaj raspad odigrava, fizičari stiču uvid u svojstva atomskog jezgra.
Obično se u prirodi može naći nekoliko izotopa istog elementa. Najčešće se javljaju stabilni izotopi, mada se mogu naći i značajne količine nestabilnih izotopa sa velikimvremenom poluraspadakao na primer uranijum-238. Male količine radioaktivnih izotopa sa malimvremenom poluraspadasu takođe prisutne u prirodi. Ovi izotopi nastaju kao proizvod raspada većih radioaktivnih jezgara sa dužim životom. Atomska masa elementa uperiodnom sistemu elemenataje prosek prirodne rasprostranjenosti izotopa tog elementa.
Prirodna rasprostranjenost raznih izotopa naZemljije u krajnjoj liniji rezultat količina izotopa formiranih u zvezdama i supernovama, kao i šema raspada radioaktivnih jezgara formiranih u ovim procesima. Zatim, formiranjesunčevog sistemaje takođe značajno uticalo na proporcije različitih izotopa koji se mogu naći na Zemlji, jer su solarni vetrovi odmah po stvaranjuSuncalakše mogli da oduvaju lakša jezgra ka daljim delovima sunčevog sistema. Zbog ovoga se velike gasovite planete nalaze dalje od Sunca.
Većina hemijskih elemenata u prirodi smese su prirodnih izotopa, koji su bilo stabilni biloradioaktivni(nestabilni). Stabilne izotope ima 81 hemijski element. To su redom svi elementi, odvodonika(Z= 1) do uključivobizmuta(Z= 83), uz izuzetaktehnecijuma(Z= 43) iprometijuma(Z= 61). Mnogi elementi imaju više stabilnih izotopa, a to je razlog što njihove relativne atomske mase nisuceli brojevi.Vodonikje, na primer, smeša stabilnih izotopa1H i2H,ugljeniksadrži stabilne izotope12C i13C, kiseonik izotope16O,17O i18O i tako dalje. Najviše stabilnih izotopa, njih 10, imakalaj.Ukupno se u prirodi nalazi oko 270 vrsta stabilnih i oko 70 vrsta radioaktivnihnuklida.
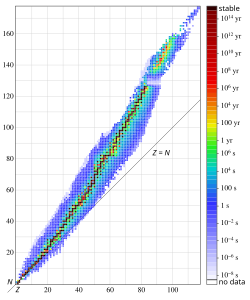
Radioaktivni izotopi, radioizotopi (radionuklidi) pojedinih elemenata, poreklom su prirodni ili veštački. Prirodne radioizotope imaju mnogi elementi koji sadrže i stabilne izotope, a takođe i svi prirodni radioaktivni elementi, to jest oni koji ne sadrže stabilne izotope. To su elementi odpolonijumado uključivoplutonijuma(Z= 84 do 94) te elementprometijum.Nuklearnim reakcijamamogu se proizvesti veštački radioizotopi gotovo svih elemenata, pa je danas poznato oko 2 500 vrsta nuklida, što prirodnih, što veštačkih. Svi se oni mogu svrstati u kartu nuklida, u kojoj je svaki nuklid prikazan kvadratom s različitim, za njega karakterističnim podatcima (izotopna obilnost, vreme poluraspada, vrsta i energija zračenja i tako dalje). Izotopi pojedinih elemenata svrstani su u vodoravnim redovima prema rastućoj masi.
Nestabilni izotopi,odnosnoradioaktivniizotopi iliradionuklidisuatomikoji imamu odnos protona i neutrona veći ili manji od odnosa potrebnog za stabilnost. Nestabilni izotopi teže stabilnosti, a to se postiže radioaktivnim raspadom (radioaktivnost). Posledice radioaktivnog raspada je menjanjemasei/ili hemijskih svojstava radionuklida uz istodobno emitiranjejonizujućeg zračenja.Svi elementi iznadrednog broja82 (olovo) su nestabilni jer odbojnim silama protona više nisu dovoljni neutroni kao ravnoteža. Naime, prevelika je koncentracija protona na jednom mestu.
Jezgraradionuklida se spontano raspada prelazeći pri tome u neko drugo jezgro. Prilikom raspada jezgro radionuklida emituje čestice i/ilielektromagnetne zrakekratketalasne dužine.Emitovane čestice i elektromagnetsni zraci se jednim imenom zovujonizujuće zračenje.To je pojavaradioaktivnosti,a sam proces je transmutacija, tj. spontani prelaz jednog jezgra u drugo, što se naziva radioaktivni raspad.
Nuklidje atomhemijskog elementaza koji je tačno poznat ne samo redni iliatomski brojZ,već i ukupan brojnukleona(protonaineutrona) uatomskom jezgru.Uprirodipostoje samo 92 hemijska elementa i još 12 veštački proizvedenih, a poznato je oko 3 100 različitih nuklida, od kojih je 350 prirodnih i 2 750 veštačkih. Većina nuklida je nestabilna (radioaktivna), oko 2800. Pogodna kombinacija protona i neutrona čini atomsko jezgru stabilnom, čim je drugačije jezgro nastoji da se izbacivanjem nukleona približi stabilnoj konfiguraciji. Energijski nivoi u jezgru se popunjavaju kako bi se dostigla konfiguracije minimalne energije, to jest maksimalne stabilnosti.
Postoji nekoliko primena, koje koriste svojstva različitih izotopa datog elementa. Jedna od najčešćih primena je trejser ili marker u tehnici zvanojizotopsko obeležavanje.Izotopi datog elementa ne mogu se razlikovati međusobno hemijskim metodama. Ipak, mogu se razlikovati korišćenjemfizičkohemijskihmetoda, recimomasene spektrometrije(direktne razlike u masi),infracrvene spekrtoskopije(na osnovu vibracionih frekvencija u molekulu - teži izotopi vibriraju nižim frekvencijama od lakših),nuklearne magnetne rezonancije(na osnovu različitihžiromagnetnih odnosaitd.
Primer korišćenja izotopskog obeležavanja je proučavanjefenola(C6H5OH) u vodi. Nakon dodavanja fenola deuterisanoj vodi (voda koja sadrži D2O osim uobičajenog H2O), istraživači su primetili supstituciju vodonika deuterijumom uhidroksilnoj grupi(C6H5OD), što znači da se fenol lako podvrgava reakcijama razmene vodonika sa vodom. Samo hidroksilna grupa je učestvovala u reakciji, što znači da ostalih 5 vodonikovih atoma ne učestvuju u reakcijama razmene.
Izotopska izmena se takođe može koristiti da se odrede mehanizmi reakcije putemkinetičkog izotopskog efekta(kinetic isotope effect).
Osim izotopskog obeležavanja, nekoliko vrsta spektroskopije koristi jedinstvena nuklearna svojstva posebnih izotopa. Na primer,nuklearno magnetno rezonantna(NMR) spektroskopija se može koristiti samo za izotope sa nuklearnim spinom koji nije nula (nonzero). Izotopi koji se najčešće koriste uNMRspektroskopiji su1H,2D,13C, i31P.Mesbauerova spektroskopija(Mossbauer spectroscopy) se zasniva na detektovanju nuklearnih prelaza određenih izotopa, recimo57Fe.
Izotopski sastav elemenata se razlikuje od planete do planete. Ova činjenica omogućava da se odredi poreklometeorita.Neki meteoriti su klasifikovani kaomesečeviilimarsovi meteoriti.
Radioaktivni izotopitakođe imaju važne primene. Razvojnuklearne energijeinuklearnog oružjazahtevaju znatno veće količine određenih izotopa. Processeparacije izotopapredstavlja značajan tehnološki izazov.
Radioizotopi se takođe često koriste u medicini, biohemiji, i hemiji kao trejseri. Male količine radioizotopa mogu lako da se detektuju zbog karakterističnih emisija raspadajućeg jezgra.
Prirodni radioaktivni raspad14Comogućavaradiougljenično datiranje.Kosmički zracistvaraju izotop14C uatmosferitako što u sudaru sa jezgrima iz vazduha izbijaju slobodne neutrone. Ti neutroni mogu jezgroazota iz molekula azota (N2) da transformišu u izotop ugljenika14C:
- 1n+14N →14C +1p
Ovaj izotop se na kraju ugradi u molekul ugljendioksida i tako dospeva u biljke, a preko njih i u životinje. Izotop14C se, dakle, u prirodi stalno stvara (zbog kosmičkih zraka) i raspada (zbog nestabilnosti) te je njegova koncentracija u živim organizmima konstantna. Međutim, u neživom svetu nema razmene ugljendiosida te koncentracija14C opada sa vremenom. Dakle, merenjem preostale radioaktivnosti14C u biološkom uzorku, može da se utvrdi vreme kada je kruženje ugljenika zaustavljeno (kada je životinja uginula, drvo posečeno, biljka ubrana...).
Zbog stabilnosti i prirodne rasprostranjenosti, izotop12C je izabran kao standard zajedinicu atomske mase,(dvanaestina mase izotopa12C) a onda takođe u definicijimola,uosnovnim jedinicama SI sistema.
- Tabela izotopa (podeljena)- tabela svih poznatih izotopa
- Tabela izotopa (kompletna)
- Lista čestica
- Izotopi su nuklidi koji imaju isti broj protona; uporedi:
- Izotonisu nuklidi koji imaju isti broj neutrona.
- Izobarisu nuklidi kji imaju isti maseni broj to jest zbir protona i neutrona.
- Nuklearni izomerisu različita pobuđena stanja istog tipa jezgra. Promena jednog izomera u drugi je praćena emisijom ili apsorpcijomgama zraka,ili procesominterne konverzije.(ne treba mešati sahemijskim izomerima.)
- ↑IUPAC(Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.),Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005,The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.),Nomenclature of Inorganic Chemistry II. Recommendations 2000,The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.),Nomenclature of Inorganic Chemistry (recommendations 1990),Blackwell Science, 1990; IUPAC,Nomenclature of Inorganic Chemistry, Second EditionArhivirano2016-03-03 naWayback Machine-u,1970; probably in the 1958 first edition as well
- ↑„NuDat 2 Description”.Arhivirano izoriginalana datum 2016-12-23.Pristupljeno 2. 1. 2016.
