Nitrit
Nitritisu jedinjenja koja sadrže NO2-.jon
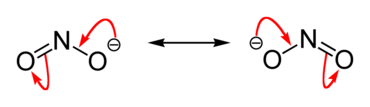
Svi nitriti moraju da sadrže jon NO2-.Ovaj jon ima istu količinu i rasporedelektronakao imolekulozona.Od anjona NO3-koji se javlja u wnitratimarazlikuje se po tome što treća odhibridizovanihorbitala sp2ne gradi vezu sa atomomkiseonika;molekul ima obliktrougla.
U procesu primanja katjonametalailivodonikaod strane jona NO2-za građenje veze koristi se jedan od slobodnih elektronskih parova nekog atoma kiseonika. U slučaju reakcije jona NO2-npr sa atomomugljenikapostoji mogućnost građenja veze preko slobodnog elektronskog para azota.
Neorganski nitriti su supstancijekristalnogoblika. Rastvaraju se uvodi.[1][2]Mogu da pokazuju redukcione osobine npr:
- 2KMnO4+ 5KNO2+ 3H2SO4→ 2MnSO4+ 5KNO3+ K2SO4+ 3H2O
jonske:
- 2MnO4-+ 5NO2-+ 6H+→ 2Mn2++ 5NO3-+ 3H2O,
kao ioksidacione,npr premaugljovodonicimametala.
Nitriti se dobijaju ubacivanjemsmešeazot(II) oksidaiazot(IV) oksidaurastvorehidroksidailikarbonataalkalnih metala, npr.
- 2NaOH + NO + NO2→ 2NaNO2+ H2O
Druga metoda je redukcija rastopljenihnitrataolovom,npr.
- NaNO3+ Pb → NaNO2+ PbO
Neki nitrati (V) se redukuju do nitrita (III) pod uticajem zagrevanja, npr.
- 2KNO3→ 2KNO2+ O2
- ↑Lide David R., ur. (2006).CRC Handbook of Chemistry and Physics(87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑Susan Budavari, ur. (2001).The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals(13th izd.). Merck Publishing.ISBN0-911910-13-1.
- Material Safety Data Sheet, sodium nitriteArhivirano2008-04-10 naWayback Machine-u
- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite ToxicityUS Department of Health and Human Services (public domain)
