Pirol
| Pirol | |||
|---|---|---|---|
 |
 | ||
 |
 | ||
| IUPAC ime |
| ||
| Identifikacija | |||
| CAS registarski broj | 109-97-7 | ||
| PubChem[1][2] | 8027 | ||
| ChemSpider[3] | 7736 | ||
| UNII | 86S1ZD6L2C | ||
| EINECS broj | |||
| UN broj | 1992, 1993 | ||
| ChEBI | 19203 | ||
| ChEMBL[4] | CHEMBL16225 | ||
| RTECS registarski broj toksičnosti | UX9275000 | ||
| Bajlštajn | 1159 | ||
| Gmelin Referenca | 1705 | ||
| Jmol-3D slike | Slika 1 Slika 2 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C4H5N | ||
| Molarna masa | 67.09 g mol−1 | ||
| Gustina | 0.967 g cm-3 | ||
| Tačka topljenja |
−23 °C, 250 K, -9 °F | ||
| Tačka ključanja |
129-131 °C, 402-404 K, 264-268 °F | ||
| Napon pare | 7 mmHg at 23 °C | ||
| Viskoznost | 0.001225 Pa s | ||
| Termohemija | |||
| Standardnaentalpijastvaranja jedinjenja ΔfH |
108.2 kJ mol-1(gas) | ||
| Std entalpija sagorevanjaΔcH |
2242 kJ mol-1 | ||
| Specifični toplotni kapacitet,C | 1.903 J k-1mol k-1 | ||
| Opasnost | |||
| NFPA 704 | |||
| Tačka paljenja | 33.33 °C | ||
| Tačka spontanog paljenja | 550 °C | ||
| Eksplozivni limiti | 3.1-14.8% | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose nastandardno stanje (25 °C, 100 kPa)materijala | |||
| Infobox references | |||
Piroljeheterocikličnoaromatičnoorgansko jedinjenje.To je petočlani prsten saformulomC4H4NH.[5][6]On je bezbojna isparljiva tečnost koja potamni nakon izlaganja vazduhu. Supstituisani derivati se takođe nazivaju pirolima, npr.,N-metilpirol, C4H4NCH3.Porfobilinogen,trisupstituisani pirol, je biosintetički prekurzor mnogih prirodnih proizvoda kao što jehem.[7]
Pirol ima veoma nisku baznost u poređenju sa konvencionalnimaminimai nekim drugim aromatičnim jedinjenjima kao što jepiridin.Ova umanjena baznost je posledica delokalizacijeslobodnog paraelektronaatoma azota u aromatičnom prstenu. Pirol je veoma slaba baza sa pKaHvrednošću od oko −4. Protonacija dovodi do gubitka aromatičnosti, i stoga nije spontana.
Kao i mnogi drugi amini, pirol potamni pri izlaganju vazduhu i svetlosti, i neohodno je da se destiliše neposredno pre upotrebe.[8]
Pirol se industrijski priprema tretmanomfuranasa amonijakom u prisustvu čvrstog kiselogkatalizatora.[9]
Jedan sintetički put pirola jedekarboksilacijaamonijum mukata,amonijumove soligalaktozne kiseline.So se tipično zagreva poddestilacionomuslovima saglicerolomkaorastvaračom.[10]
Mnogi metodi postoje zaorgansku sintezuderivata piola. Klasične „imenovane reakcije “suKnorova sinteza pirola,Hantzschova sinteza pirola,iPal-Knorova sinteza.
Početni materijaliPiloti-Robinsonove sinteze pirolasu 2 ekvivalentaaldehidaihidrazin.[11][12]Proizvod je pirol sa specifičnim supstituentima u pozicijama 3 i 4. Aldehid reaguje sa diaminom da formira intermedijar di-imin(R–C=N−N=C–R), koji sahlorovodoničnom kiselinomzatvara prsten i gubiamonijak.
U jednoj modifikaciji,propionaldehidse tretira prvo sahidrazinom,a onda sabenzoil hloridomna visokim temperaturama i uz pomoćmikrotalasnog ozračivanja:[13]
U drugom stupnju, dolazi do [3,3]sigmatropne reakcijeizmeđu dva intermedijara.
Pirol može da budepolimerizovanupolipirol.
NHproton pirola je umereno kiseo sa pKavrednošću od 16.5. Pirol se možedeprotonovatisa jakimbazamakao što jebutil litijuminatrijum hidrid.Rezultirajući alkalni pirolid jenukleofilan.Treatiranje tekonjugovane basesaelektrofilimakao što jemetil jodiddaje N-metilpirol.
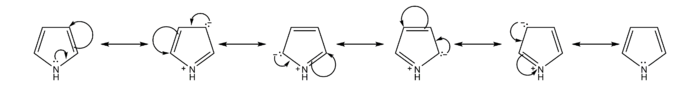
Rezonantni oblici pirola daju uvid u reaktivnost ovog jedinjenja. Poputfuranaitiofena,pirol je reaktivniji od benzena uelektrofilnoj aromatičnoj supstituciji,jer ima sposobnost stabilizacije pozitivno naelektrisanihkarbokatjonskihintermedijara.
Pirol podležeelektrofilnoj aromatičnoj supstitucijipredominantno u 2 i 5 pozicijama. Dve takve reakcije od posebnog značaja za formiranje funkcionalizovanih pirola suManichova reakcijaiVilsmeier-Hakova reakcija,[14]obe od kojih su kompatibilne sa mnoštvom pirolnih supstrata.

Formilacija derivata pirola[14])
- Armarego, Wilfred, L.F.; Chai, Christina, L.L. (2003).Purification of Laboratory Chemicals(5th izd.). Elsevier. str. 346.
- Loudon, Marc G. (2002).„Chemistry of Naphthalene and the Aromatic Heterocycles.”.Organic Chemistry(Fourth izd.). New York: Oxford University Press. str.1135-1136.ISBN978-0-19-511999-2.
- ↑Li Q, Cheng T, Wang Y, Bryant SH (2010).„PubChem as a public resource for drug discovery.”.Drug Discov Today15(23-24): 1052-7.DOI:10.1016/j.drudis.2010.10.003.PMID20970519.
- ↑Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”.Annual Reports in Computational Chemistry4:217-241.DOI:10.1016/S1574-1400(08)00012-1.
- ↑Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010).„Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”.J Cheminform2(1): 3.DOI:10.1186/1758-2946-2-3.PMID20331846.
- ↑Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”.Nucleic Acids Res40(Database issue): D1100-7.DOI:10.1093/nar/gkr777.PMID21948594.
- ↑Loudon, Marc G. (2002).„Chemistry of Naphthalene and the Aromatic Heterocycles.”.Organic Chemistry(Fourth izd.). New York: Oxford University Press. str.1135-1136.ISBN978-0-19-511999-2.
- ↑Katritzky A.R., Pozharskii A.F. (2000).Handbook of Heterocyclic Chemistry.Academic Press.ISBN0080429882.
- ↑David L. Nelson, Michael M. Cox (2005).Principles of Biochemistry(4th izd.). New York: W. H. Freeman.ISBN0-7167-4339-6.
- ↑Armarego, Wilfred, L.F.; Chai, Christina, L.L. (2003).Purification of Laboratory Chemicals(5th izd.). Elsevier. str. 346.
- ↑Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim.DOI:10.1002/14356007.a22_453
- ↑Practical Organic Chemistry, Vogel, 1956, Page 837,Link (12 MB)
- ↑Oskar Piloty (1910). „Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen”.Chem. Ber.43:489.DOI:10.1002/cber.19100430182.
- ↑Robinson, Gertrude Maud; Robinson, Robert (1918). „LIV.—A new synthesis of tetraphenylpyrrole”.J. Chem. Soc.113:639.DOI:10.1039/CT9181300639.
- ↑Benjamin C. Milgram, Katrine Eskildsen, Steven M. Richter, W. Robert Scheidt, and Karl A. Scheidt (2007).„Microwave-Assisted Piloty-Robinson Synthesis of 3,4-Disubstituted Pyrroles”(Note).J. Org. Chem.72(10): 3941-3944.DOI:10.1021/jo070389.PMC1939979.PMID17432915.
- ↑14,014,1Jose R. Garabatos-Perera, Benjamin H. Rotstein, and Alison Thompson (2007). „Comparison of Benzene, Nitrobenzene, and Dinitrobenzene 2-Arylsulfenylpyrroles”.J. Org. Chem.72(19): 7382-7385.DOI:10.1021/jo070493r.PMID17705533.



