Sol




 Za ostala značenja, vidiSol (razvrstavanje).
Za ostala značenja, vidiSol (razvrstavanje).
Uhemiji,soje opšti termin koji se koristi zajonska jedinjenjasastavljena od pozitivnonaelektrisanihkatjonai negativno naelektrisanihanjona,tako da je proizvod neutralan i bez naelektrisanja.[1][2]Ovijonimogu bitineorganski(Cl-) kao iorganski(CH3-COO-) i jednoatomski (F-) kao i višeatomski joni (SO42-).[3][4]
Vodeni rastovri soli se zovuelektroliti.Oni, kao i istopljene soli, sprovodeelektricitet.
Cviterionisu soli koјe sadrže anјonski centar i katјonski centar u istommolekulu,kao na primeramino kiseline,mnogimetaboliti,peptidiiproteini.
Smeše više različitih јona u rastvoru kao što јecitoplazmaćeliјe,ukrvi,urinu,biljnom soku i mineralnoј vodi naјčešće ne stvaraјu definisane soli posle isparavanja vode.
Soli su naјčešće čvrstikristalisa relativno visokomtačkom topljenja.Međutim, postoјe soli koјe su tečne na sobnoј temperaturi, takozvane јonske tečnosti. Neorganske soli obično imaјu malu tvrdoću i malu sposobnost zgušnjavanja, sličnokuhinjskoј soli
Soli često imaјu dobrurastvorljivostuvodi.Tokom rastvaranja ili procesahidraciјe,molekuli vode razdvaјaјu јone. Međutim, mnoge soli su skoro nerastvorljive u vodi, npr. srebro-hlorid,kalciјum-sulfati mnogisulfidimetala.
| Formula soli | Kemijsko ime | Uobičajeni naziv | Topljivost u vodi |
|---|---|---|---|
| NH4Cl | Amonijev klorid | Salmijak | Topljiva |
| CuSO4· 5 H2O | Bakrov(II)sulfat pentahidrat | Modra galica | Topljiva |
| CaCO3 | Kalcijum karbonat | Vapnenac | Gotovo netopljiv |
| CaSO4· 2 H2O | Kalcijev sulfat dihidrat | Sadra ili gips | Gotovo netopljiva |
| NaHCO3 | Natrijev hidrogenkarbonat | Soda bikarbona | Slabo topljiva |
| NaCl | Natrijev klorid | Kuhinjska (morska) sol | Topljiva |
| NaNO3 | Natrijev nitrat | Čilska salitra | Topljiva |
| KNO3 | Kalijev nitrat | Kalijska salitra | Topljiva |
Soli mogu biti čiste i providne (natriјum-hlorid), neprozirne (titaniјum-dioksid), pa čak i metalne i uglačane (gvožđe-disulfid).
Postoјe soli u svim drugim boјama, npr. žuta (natriјum-hromat), narandžasta (natriјum-dihromat), crvena (živa-sulfid) svetloljubičasta (kobalt-dihlorid-heksahidrat), plava (gvožđe-sulfat, heksaciјanoferat), zelena (nikl-oksid), bezboјna (magneziјum-sulfat), bela (titaniјum-dioksid) i crna (mangan-dioksid). Većinamineralai neorganskihpigmenata,kao i većina sintetičkih organskih farbi su soli.
Različite soli pokazuјu svih pet osnovnih ukusa: slano (npr. natriјum-hlorid), slatko (olovo-diacetat), kiselo (kaliјum-bitartarat), gorko (magneziјum-sulfat) i ljuto (mononatriјum-glutamat).
Čiste soli su obično bez mirisa, dok nečiste soli mogu da mirišu na kiselinu (npr. acetati kao što јe sirćetna kiselina, ciјanidi kao što јe vodonik-ciјanid) ili bazu (npr. amoniјumove soli kao što јe amoniјak).
Naziv soli počinje imenom katјona (npr.natriјumiliamoniјum), koga prati ime anјona (npr.hloridiliacetat). Na soli se često odnosi samo imenom katјona (npr.natriјumove soliiliamoniјumove soli) ili imenom anјona (npr.hloridiiliacetati).
Česti katјoni koјi formiraјu soli su:
- amonijumNH4+
- kalcijumCa2+
- gvožđeFe2+and Fe3+
- magnezijumMg2+
- kalijumK+
- piridinijumC5H5NH+
- kvaternerni amonijumNR4+
- natrijumNa+
Česti anjoni koji formiraju soli (i nazivi odgovarajućih kiselina u zagradi) su:
- acetatCH3-COO-(sirćetna kiselina)
- karbonatCO32-(ugljena kiselina)
- hloridCl-(hlorovodonična kiselina)
- citratHO-C(COO-)(Č2-COO-)2(limunska kiselina)
- cijanidC≡N-(vodonik cijanid)
- hidroksidOH-(voda)
- nitratNO3-(azotna kiselina)
- nitritNO2-(azotasta kiselina)
- oksidO2-(voda)
- fosfatPO43-(fosforna kiselina)
- sulfatSO42-(sumporna kiselina)
Nazive soli izvodimo tako što na naziv metala dodajemo naziv kiselinskog ostatka.
| Kiseline | Soli | ||
|---|---|---|---|
| Naziv kiseline | Kemijska formula | Zajednički naziv | Primjer |
| Hlorovodonična | HCl | hloridi | NaCl natrijev hlorid |
| CaCl2kalcijev hlorid | |||
| AlCl3aluminijev hlorid | |||
| FeCl2željezov (II) hlorid | |||
| Ugljična | H2CO3 | karbonati | Na2CO3natrijev karbonat |
| CaCO3kalcijev karbonat | |||
| MgCO3magnezijev karbonat | |||
| Sumporasta | H2SO3 | sulfiti | Na2SO3natrijev sulfit |
| CaSO3kalcijev sulfit | |||
| ZnSO3cinkov sulfit | |||
| Sumporna | H2SO4 | sulfati | Na2SO4natrijev sulfat |
| CaSO4kalcijev sulfat | |||
| ZnSO4cinkov sulfat | |||
| Dušična | HNO3 | nitrati | KNO3kalijev nitrat |
| NaNO3natrijev nitrat | |||
| Ca(NO3)2kalcijev nitrat | |||
| NH4NO3amonijev nitrat | |||
| Fosforna | H3PO4 | fosfati | Na3PO4natrijev fosfat |
| Ca3(PO4)2kalcijev fosfat | |||
U najužem smislu, pod pojmom so misli se nanatrijum-hlorid(NaCl, odnosnokuhinjska so). U mnogo širem smislu, soli su svi oni spojevi, koji su poput NaCl načinjeni od aniona i kationa. Kao primjer takvih soli jekalcijum-hlorid(CaCl2). Natrijum-hlorid sastavljen je iz kationa Na+i aniona Cl−.Slično tome, kalcij-hlorid se izgrađen iz iona Ca2+i Cl−Formule NaCl i CaCl2su sadržajne (sumarne) formule spojeva (omjer Na:Cl=1:1, odnosno Ca:Cl=1:2). Ioni mogu biti jednovalentni ili polivalentni, tj. nositi jedno ili više pozitivnih odnosno negativnih naelektrisanja. Sumarna formula neke soli određena je brojem naelektrisanja iona, jer se pozitivna i negativna naelektrisanja moraju međusobno kompenzirati (poništiti). Sumarne formule soli su u jasnoj suprotnosti s formulama spojeva poputvode(H2O) ilimetana(CH4), koji sumolekularnispojevi.
Kod neorganskih soli između iona djeluju ionske veze. Slijedeći omjer sumarne formule, veliki broj iona gradi ionsku rešetku određenekristalne strukture.Prva slika desno prikazuje mali isječak građe kristalne rešetke natrij-hlorida. Pošto postoji veliki broj različitih kationa i aniona, poznato je i veoma veliki broj različitih soli. U donjoj tabeli prikazani su neki od iona. U solima, ioni se mogu sastojati i iz više od jednog atoma. Takvi ioni se nazivaju kompleksi ioni. Primjeri kompleksnih aniona sunitratni(NO3−) i sulfatni anion (SO42−). Kod takvih kompleksa, jedan atom predstavlja centralni, na koji su spojevi drugi atomi (i atomske grupe), jednim imenom nazvaniligandi.U ovim primjerima, atomiNodnosnoSsu centralni atomi, dok su u oba slučaja ligandi atomikisika(oksokompleksi). Centralni atomi i njihovi ligandi su povezani jedan s drugimkovalentnom vezom.Ionske veze nalaze se samo između aniona i kationa. Među nitratima poznate soli su, naprimjer,natrijum-nitrat(NaNO3), a među sulfatimanatrijum-sulfat(Na2SO4).
Katione uglavnom grade metali a njihove soli nazivaju sesoli metala( "metalne soli" ). Od nemetala sastoji se kompleksni kation amonij (NH4+) sa dušikom kao centralnim ionim ivodikomkao ligandom. Amonij ioni grade so poputamonijum-sulfata((NH4)2SO4). Pored amonijevih spojeva, postoje i njihovi analogi organski spojevi (kvartarni amonijevi spojevi).
Kod viševalentnih oksokompleksa mogu se javiti i OH-grupe kao ligandi, kao što je npr. kod solinatrijum-hidrogensulfata(NaHSO4). Analoge soli su poznate i među fosfatima: porednatrijum-fosfatapostoje i solidinatrijum-hidrogenfosfatinatrijum-dihidrogenfosfat.Iz uobičajenog formalnog načina pisanja (formalnih jedinica) za ove spojeve ne mogu se odmah prepoznati OH-grupe kao ligandi. Formalne jedinice takvih soli se izvode iz tradicionalnog načina pisanja zakiselinepoputsumporne(H2SO4) ifosfatne kiseline(H3PO4).

Prelazni metaline grade samo katione, nego i anione u vidu oksokompleksa. Tako naprimjerhrommože graditihromate([CrO4]2−), koji je anion ukalijum-hromatuK2[CrO4]), amanganpermanganate([MnO4]−), koji je anion ukalijum-permanganatu(K[MnO4]).
Kompleksni anioni mogu imati i metale kao centralni atom. Kod kalijheksacijanoferata(II) (K4[Fe(CN)6]), ion željeza Fe2+gradi stabilni anion sa četiri negativna naboja zajedno sa šestcijanidnihgrupa (CN−). U solima, ionske veze se nalaze između kationa kalija i aniona heksacijanoferata(II). Slično tome, ion željeza Fe3+gradi kalijheksacijanoferat(III) (K3[Fe(CN)6]), također jednu kompleksnu so. Kod K3[Fe(CN)6], ion željeza Fe3+gradi stabilni anion sa tri negativna naboja zajedno sa šest cijanidnih grupa (CN−).
|
| |||||||||||||||||||||||||||||||||||||||

- Mnoge soli su na sobnoj temperaturi u čvrstom stanju sa relativno visokomtačkom topljenja.Nagrizajuće soli su vrlo tvrde i krte te imaju glatke ivice pri lomu tokom mehaničke obrade. Ove osobine su uglavnom tipične za čvrste supstance, koje su izgrađene u vidu ionske rešetke te stoga gradekristale.Međutim, svaka kristalna supstance nije ujedno i so. Tako naprimjeršećer(saharoza) također gradi kristale, ali nema ionsku rešetku i ne ubraja se u soli.
- Brojne soli surastvorljiveu vodi a nisu rastvorljive u većini organskihotapala.Kod soli rastvorljivih u vodi,vodaprevazilazi energiju ionske rešetke pomoću hidratacije. Ako je energija hidratacije približno velika ili veća od energije rešetke, so je relativno dobro ili vrlo dobro rastvorljiva. U rastvorima su pojedinačni ioni vrlo čvrsto i intenzivno okruženi molekulama vode. U vidu reakcije, ovo se u hemiji predstavlja na sljedeći način:
Slovo (s) označava čvrstu supstancu dok (aq) označava, da se ion nalazi u hidratiziranom stanju. - Suhi kristali soli su električniizolatori.Istopljene soli i vodene otopine provode električnu struju zbog svojih slobodno pokretnih iona kao nosilaca električnog naboja. Stoga su onielektroliti.
- Rastvaranje soli u vodi može promijenitipH vrijednosttog rastvora. Ako se rastvaranjem određene soli ne promijeni ta vrijednost, onda se kaže da je ta soneutralna.Među neutralne soli se ubraja i natrijum-hlorid. Osim ovih, postoje ibazičneikiselesoli. Iz sastava soli vrlo teško se može procijeniti kako će određena so reagirati. Međutim, vrijedi opće pravilo: anioni (kiselinski ostaci) jakih kiselina uglavnom reagiraju neutralno. Kiselinski ostaci slabih kiselina uglavnom reagiraju bazično. Primjer osobina soli, nastalih od višeprotonskih kiselina, jeste ponašanje fosfata. Rastvaranje soli u vodenim otopinama organskih molekula, kao npr. biomolekula, može dovesti do denaturiziranja tih biomolekula ali i djelovati na taloženje makromolekula. Ovakvo djelovanje soli karakterizirano je takozvanomHofmeisterovom serijom.
- Metalni oksidi u velikom postotku čine Zemljinu koru, ali se oni mogu posmatrati i kao soli. Anion O2−(oksidni ion) se javlja kao takav samo u čvrstom ili istopljenom stanju, dok u vodenim rastvorima on nije poznat.Kisiku oksidnom ionu imaoksidacijski broj−2. Stoga, oksidacijski broj metala određuje sumarnu formulu određene soli odnosno spoja: MI2O, MIIO, MIII2O3.Ako je oksid rastvorljiv u vodi, dešava se specifična hemijska reakcija, naprimjer:
Natrijum-oksidreagira s vodom dajući hidroksidne ione i sodu (ione natrija).
Slično reagira i kalcijum-oksid (CaO), poznat i kaoživi kreč,dajućiugašeni krečodnosnokalcijum-hidroksid(Ca(OH)2). Međutim, postoji veliki broj oksida koji ne reagiraju s vodom. Naprimjer, spoj željezo(III) oksid (Fe2O3) nije rastvorljiv u vodi.
- Sulfidi: minerali se u prirodi često mogu naći u oblikusulfida(S2−), naprimjerpiritihalkozin.I sulfidi se mogu smatrati solima.Natrijum-sulfid(Na2S) je rastvorljiva so, koja je u vodi gotovo nerastvorljiva, slično kao i većina sulfida poputcink-sulfida(ZnS) ibakar(II) sulfida(CuS). Uanalitičkoj hemijise različita (slaba) rastvorljivost raznih metalnih sulfida koristi za razdvajanje sličnih hemijskih elemenata (u fazi razdvajanja sumporovodične funkcionalne grupe)
Mnoge soli, pored iona, sadržavaju i određene količine molekulavode,takozvanukristalnu vodu.[5]Ona se obično navodi u sumarnoj formuli, kao naprimjer unatrijum-sulfatdekahidratu: Na2SO4· 10 H2O.
Pored soli sa samo jednom vrstom kationa (M) poznate su i soli sa dva različita kationa. Takve soli nazivaju sedvostruke soli,kao što su alauni sa općenitom sumarnom formulom MIMIII(SO4)2.Primjer takve soli je aluminijkalijsulfat-dodekahidrat (KAl(SO4)2· 12 H2O).
- Supstance su soli, samo ako su hemijske veze između njihovih dijelova ionske. Da je zaista u nekom spoju prisutna ova vrsta veze, nije lahko zaključiti. Dok je kod kalcijum-oksida (CaO) prisutna ionska veza, dokhrom(IV) oksida(CrO3) radi se okovalentnoj veziizmeđu atomahromaikisika,pa ovaj spoj nije so. U ovakvim slučajevima je zbog toga bolje govoriti ometalnim oksidimaumjesto solima.
- Historijski, soli su po pravilu obuhvatalihemijske spojeve,koji imaju definirani sastav od različitih hemijskih elemenata. Međutim, poznati su i miješani kristali sastavljeni iz dvije soli, a koji nisu stehiometrijski građeni: tako naprimjerkalijum-permanganat(K[MnO4]) sabarijum-sulfatomsačinjava miješane kristale u gotovo proizvoljnim odnosima smjese (čak i kada se stavi i određena najveća količina barijum-sulfata), tako da komponente u miješanim kristalima i dalje zadržavaju slične kristalne strukture i udaljenosti unutar mreže. Za dobijanje miješanih kristala nije neophodna hemijska sličnost uključenih spojeva niti njihova identičnavalencija.
Osim gore opisanih neorganskih soli, također postoje i brojne soliorganskih spojeva.Anioni ovih soli nastali su odorganskih kiselina.Među ostalim, jedne od važnijih su soli karboksilnih kiselina, kao što jeacetatna kiselinaod koje nastaju brojne soli, poznati kaoacetati(CH3COO−). Tako naprimjer acetatna kiselina sa Na+daje sonatrijum acetatdok sa Cu2+gradi bakar-acetat. Sirćetna kiselina je monougljična kiselina (ima samo jednu -COOH grupu) pa daje samo jednovalentne anione. Limunska kiselina (citratna kiselina) je trougljična kiselina (ima tri -COOH grupe) i može davati trovalentne anione; njene soli nazivaju se citrati. Među poznatijim solima citratima sunatrijum-citratikalcijum-citrat.Mnogi acetati i citrati grade kristale, ali to nije pravi razlog za njihovo uvrštavanje u soli. Jedini pravi razlog i osnova leži u postojanju ionskih veza između aniona i kationa. Unutar iona organskih spojeva nalaze sekovalentne veze.
Praktični značaj imaju solikarboksilnih kiselina,koje se ubrajaju umasne kiseline.Natrijeve i kalijeve soli masnih kiselina nazivaju sesapuni.U komercijalnim sapunima nalazi se mješavina različitih soli masnih kiselina. Praktičan značaj imaju pri proizvodnji raznih tvrdih (natrijevih) i mehkih (kalijevih) sapuna. Konkretni primjer čine solipalmitinske kiselinekoji se nazivajupalmitati.Soli, koji se zasnivaju na tako velikim organskim molekulama, po pravilu nisu kristalizirane.
Analogno neorganskim sulfatima (SO42−) postoje i organski sulfati (R-O-SO3−), poputnatrijum-laurilsulfata,koji su svoju upotrebnu vrijednost pronašli kao tenzidi u komercijalnim šamponima i gelovima za tuširanje. Poznati su čak i solialkoholakoji se nazivaju alkoholati.[6]Alkoholi su izrazito slabe kiseline, ali se gotovo nikad ne nazivaju tako. Pod agresivnim uslovima reakcije mogu se dobiti spojevi oblika R-O−M+(gdje jeM= metal). Po analogiji sa brojnim neorganskim oksidima (MO) alkoholati reagiraju pri kontaktu s vodom (hidroliza) dajući odgovarajuće alkohole.
| Hidroliza oksidnih soli | |
|---|---|
| Natrijum-metanolat | |
| Natrijum-oksid | |
Među organskim kationima, spojevi analogni amonijum-kationima (NH4+) imaju veliki značaj. Općenito se nazivaju kvartarni amonijski spojevi. Kod ovih spojeva, atomdušikaobično nosi četiri alkil grupe (R-) i pozitivno naelektrisanje. Alkilamonijski spoj cetiltrimetilamonijbromid, naprimjer, je organski spoj amonija, kod kojeg se atombromanalazi kao anion. Praktični značaj imaju spojevi amonija sa tri kratke i jednom dugom alkil grupom, jer takvi kationi u vodenim rastvorima pokazuju osobinetenzida.Spojevi ove vrste također igraju veoma važnu ulogu umetabolizmuživih bića, kao što je npr.holin.
U principu, gotovo svaki organskiaminputem primanja jednogprotona(H+) može preći u kation. Slično kao i reakcija saamonijakom(NH3) koji prelazi u amonij ion (NH4+), reagira naprimjer i primarni amin (R-NH2;gdje jeR= organski ostatak) prelazeći u kation R-NH3+.Pošto su takvi spojevi uglavnompolarnii zbog toga lahko rastvorljivi u vodi, oni su i početne supstance koje prevode nekelijekovena bazi dušika putem njihovog razlaganja sahlorovodičnom kiselinomu soli, takozvane hidrohloride. Ovaj postupak olakšava njihovu apsorpciju u organizmu. Nasuprot amina, hidrohloridi se mogu mnogo lakše čistiti pomoćiprekristalizacije.Sa bromovodikom amini grade hidrobromide a safluorovodikomhidrofluoride. Osim molekula, koji mogu nositi neko pozitivnoilinegativno naelektrisanje, postoje također i molekule, koje posjeduju negativnoipozitivno naelektrisanje. One se nazivajuunutrašnje soliilicviterioni.Grupa spojeva betaina se ubraja u takve soli, među kojima je najjednostavniji spojbetain.
Aminokiselineposjeduju jednu karboksilnu (-COOH) i jedno amino grupu (-NH2) pa zbog toga mogu reagirati i kiselo i bazno. Pri unutrašnjoj neutralizaciji stvaraju se anionske (-COO−) i kationske (-NH3+) odnosno jedan cviterion. Jedna od najjednostavnijih aminokiselina jeglicin,koji je vrlo dobro rastvorljiv u vodi. Nasuprot drugih iona koji su dobro rastvorljivi u vodi, cviterioni pokazuju vrlo slabu (gotovo nikakvu)električnu provodljivost(amfoliti).
| Anioni organskih spojeva | ||
|---|---|---|
| grupa spojeva | primjer | struktura |
| Ugljične kiseline | acetati |  |
| palmitati |  | |
| citrati |  | |
| organskisulfati | laurilsulfati |  |
| alkoholati | etanolat | |
| Kationi organskih spojeva | ||
| grupa spojeva | primjer | struktura |
| kvartarni amonijski spojevi |
Cetiltrimetilamonij |  |
| holin |  | |
| organski amonijski spojevi |
solianilina, npr. anilin-hidrohlorid |
 |
| Unutrašnje soli: kationi i anioni u jednoj molekuli | ||
| grupa spojeva | primjer | struktura |
| betaini | betain | 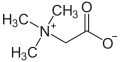 |
| aminokiseline | alanin | 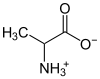 |
Soli nastaju pri reakciji kiselina sabazama(grč.basis;premaArrheniusu:baze su osnovice ( "baze" ) za soli). Pri tome se stvaraju oksonijum-joni kiselina koji sa ionima hidroksida iz baza dajuvodu(neutraliziraju se). Neke soli su vrlo teško rastvorljive u vodi te odmah pri nastanku stvaraju čvrsti talog. Obično se soli nalaze otopljene u rastvoru te se kristaliziraju (prelaze u čvrsto stanje) isparavanjem vode.
| kiselina + baza → so + voda |
|---|
hlorovodična kiselina+soda→natrijum-hlorid+ voda |
sumporna kiselina+barijum-hidroksid→barijum-sulfat+ voda |
Neke soli se mogu dobiti iz druge dvije soli. Ako se pomiješaju vodeni rastvori dviju soli, iz rastvora se može izdvojiti treća so u čvrstom obliku. Ovo vrijedi samo ako je treća so, nasuprot druge dvije, mnogo teže rastvorljiva.
| rastvor soli A + rastvor soli B → so C + rastvor soli D |
|---|
natrijum-hlorid+srebro nitrat→srebro-hlorid+natrijum-nitrat |
kalcijum-hlorid+natrijum-karbonat→kalcijum-karbonat+natrijum-hlorid |
Kako je gore opisano, mnogi oksidi metala imaju afinitet da sa vodom grade hidrokside. U kiselim uslovima, također reagiraju i mnogi oksidi metala, a koji su u čistoj vodinerastvorljivi(stabilni). Na ovaj način mogu se dobiti mnoge soli, kao što je naprimjer bakar-sulfat.
| oksid metala + kiselina → so + voda |
|---|
bakar(II) oksid+sumporna kiselina→bakar-sulfat+ voda |
Oni ioni koji ne nastaju u gore opisanim reakcijama, postoje već i prije nastanka nekih novih soli. Ako se pri reakcijama dobijanja neke novi soli ne nalaze nikako ioni sa potrebnom valencijom ili se ne nalaze svi potrebni, onda se odvijajuredoks reakcije.Tako se naprimjer iz elementarnih metala inemetaledobijaju soli.
- ↑IUPAC Compendium of Chemical Terminology (the “Gold Book” ).DOI:10.1351/goldbook.S05447verzija: 2.2.
- ↑Hans-Dieter Jakubke, Ruth Karcher (izd.):Lexikon der Chemie.,1. izd.; Spektrum Akademischer Verlag, Heidelberg 2001.;ISBN978-3827405524
- ↑Housecroft C. E., Sharpe A. G. (2008).Inorganic Chemistry(3rd izd.). Prentice Hall.ISBN978-0-13-175553-6.
- ↑Holleman A. F., Wiberg E. (2001).Inorganic Chemistry(1st edition izd.). San Diego: Academic Press.ISBN0-12-352651-5.
- ↑water of crystallization,Arhivirano2016-05-31 naWayback Machine-uWebster's NewWorld Dictionary. John Wiley & Sons Inc. 1988. Pristupljeno 28. april 2015.
- ↑Alkoholate,na stranici chemie.de, pristupljeno 29. aprila 2015.((de))
- Mark Kurlansky (2002).Salt: A World History.Walker Publishing Company.ISBN0-14-200161-9.
- Giričev G. V. (1999).Структура молекул солей кислородсодержащих кислот,Sorovskij obrazovateljnij žurnal, br. 11, str. 40-44.
- Ivan Ljudvigovič Knunjanc; Nikolaj Serafimovič Zefirov (1995).Химическая энциклопедия(4. tom),Pol-Tri,"Sovetskaja Ėnciklopedija"ISBN5-85270-092-4
- P. Wasserscheid, W. Keim (2000).Ionic Liquids—New “Solutions” for Transition Metal Catalysis,Angewandte Chemie, volume 39, izd. 21, str. 3772–3789DOI:10.1002/1521-3773(20001103)39:21<3772::AID-ANIE3772>3.0.CO;2-5,PMID11091453
- Лидин Р. А., Молочко В. А., Андреева Л. Л., Цветков А. А. (1983). Под ред. Б. Д. Стёпина. ur.Основы номенклатуры неорганических веществ.М: Химия. str. 112.
- Химическая энциклопедия (1995). Под ред. Н. С. Зефирова. ur.4.М: Большая российская энциклопедия.ISBN5-85270-092-4.










