Ugljikov ciklus
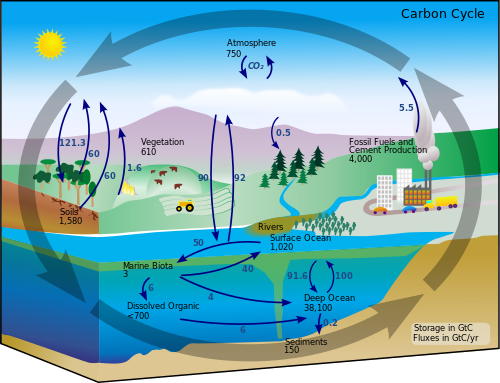



Ugljikov ciklusje biogeokemijski ciklus, u kojem seugljikizmjenjuje izmeđubiosfere,pedosfere, geosfere, hidrosfere iatmosferenaZemlji.To je jedan od najvažnijih ciklusa naZemljii omogućuje da ugljik ponovno iskoriste noviorganizmi.
Ugljikov ciklus je otkrioAntoine Lavoisirei Joseph Priestley, a kasnije je razvioHumphry Davy.[1]Ugljikov ciklus uključuje sljedeće glavne spremnike ugljika:
- Zemljinu atmosferu
- Zemljinubiosferu,koja obično uključuje sistemeslatke vodei nežive organske materijale, kao što je ugljik utlu.
- oceane,uključujući otopljeni anorganski ugljik, te sve žive i nežive morske organizme
- sedimente,uključujućifosilna goriva
- Zemljina unutrašnjost, a to se odnosi na ugljik koji se nalazi uZemljinoj koriiplaštu,a ispušta se u atmosferu i hidrosferu prekovulkanai geotermalnih izvora
Godišnje kretanje ugljika ili izmjena između spremnika, se javlja zbog različitih kemijskih, geoloških i bioloških procesa. Ocean sadrži najveći spremnik ugljika, ali dijelovi u dubokim oceanima se ne izmjenjuju tako brzo s atmosferom.
Proračun svjetskog ugljika je ravnoteža izmjena (ulaza i izlaza) ugljika između raznih spremnika. Taj proračun nam govori da li neki spremnik služi kao izvor ili za taloženje ugljika.
U Zemljinoj atmosferi ugljik prvenstveno postoji kao plinugljični dioksid(CO2). Iako ga ima samo mali postotak (oko 0,039 %), igra vrlo važnu ulogu u održanju života. Ostali plinovi koji sadrže ugljik sumetanikloroflorougljik(CFC ili freoni – samo zbog ljudskog utjecaja).Stabla,travei ostale zelene biljke, pretvaraju ugljični dioksid uugljikohidrate,procesom koji se nazivafotosinteza,oslobađajući kisik u zrak. Taj proces je prilično obilan kod novihšuma,gdje stabla još uvijek rastu. Kodbjelogoričnih šumaje taj proces najjači uproljeće,kad se stvarališće.To je dobro vidljivo na Keelingovoj krivulji mjerenja koncentracije ugljičnog dioksida. Prevladava najviše nasjevernoj polutciu proljeće, jer južna polutka nema toliko kopna u umjerenom pojasu.
- Šumesadrže 86 % ugljika iznad tla i 73 % ugljika u tlu, na Zemlji.[2]
- Površinaoceanaprema polovima ima sve više ugljika, jer što je morska voda hladnija, to može otopiti više ugljičnog dioksida iz zraka, pretvarajući je u ugljičnu kiselinu (H2CO3). Značajnu ulogu igratermohalinska pokretna traka,koja prebacuje gušću površinku vodu u unutrašnjost oceana.
- U gornjim područjima oceana, postoji velika biološka produktivnost, organizmi pretvaraju ugljik u tkiva ilikarbonateza tvrde zaštitne oklope, kao što suškoljkeilipuževi.Uglavnom se ugljik taloži prema dolje.
- Razgradnja ugljično-silikatnih stijena. Ugljična kiselina reagira s razgrađenim stijenama i stvarabikarbonatne ione,koje koriste morski organizmi za stvaranje zaštitnog tvrdog sloja. Ovaj ugljik se ne vraća ponovno u atmosferu.
- 1958. je izmjereno u zvjezdarnici Mauna Loa, naHavajima,da ima 0,032 % ugljičnog dioksida, dok je 2010. izmjereno 0,0385 % ugljičnog dioksida u atmosferi.[3]
Ugljik se oslobađa u atmosferu na nekoliko načina:
- prekodisanja,koje vrše biljke i životinje. To je eksotermna reakcija, koja oslobađa energiju u obliku topline, a uključuje razbijanje molekula ugljikohidrata na ugljični dioksid i vodu.
- preko raspadanja životinja i biljaka. Gljive i bakterije razlažu ugljikove spojeve kod mrtvih životinja i biljaka, pretvarajući ugljik u ugljični dioksid ili metan.
- prekoizgaranjaorganskih tvari, koje oksidiraju ugljik u ugljični dioksid.Fosilna gorivakao što sunafta,ugljeniprirodni plin,oslobađaju ugljik u obliku ugljičnog dioksida, koji je bio milionima godina spremljen u geosferi. Izgaranjabiogorivaisto oslobađa ugljikov dioksid, koji je bio spremljen samo par godina.
- preko proizvodnjecementa.Ugljični dioksid se oslobađa kada se zagrijavavapnenac(CaCO3), da bi se dobilovapno(CaO), kao sastojak cementa.
- u dijelovima oceana koji su topliji, otopljeni ugljični dioksid se vraća u atmosferu
- vulkanskeerupcije i rekristalizacija stijena, oslobađaju plinove u atmosferu. Vulkanski plinovi su prije svega vodena para, ugljični dioksid isumporov dioksid.
Ugljik je osnovni sastojak života na Zemlji. Oko polovina suhe težine (bez vode) kod živih organizama je ugljik. Igra važnu ulogu u izgradnjistanične opne,ubiokemijiiishranisvih živihstanica.Živi organizmi sadrže oko 575 x 1012kg ugljika,[4]od čega najviše imajustabla.Zemlja ima oko 1 500 x 1012kg ugljika, uglavnom u obliku organskog ugljika.[5]
- Autotrofisu organizmi koji stvaraju svoju organsku građu, koristeći ugljični dioksid iz zraka ili iz vode u kojoj žive. Za to trebaju vanjsku energiju, a to je uglavnomSunčeva energija,koja omogućujefotosintezu.Vrlo mali broj autotrofa koristi kemijsku energiju u procesu kemosinteze. Najvažniji autotrofi sufitoplanktoniu morima i oceanima, te stabla na kopnu. Fotosinteza slijedi kemijsku reakciju: 6CO2+ 6H2O → C6H12O6+ 6O2
- Ugljik se prenosi iz biosfereheterotrofijom,a to je hranjenje na tuđim organizmima ili dijelu organizma. To uključujegljiveilibakterijekoje koriste mrtvi materijal, procesomvrenjaili raspadanjem.
- Većina ugljika napušta biosferu prekostaničnog disanja,koje oslobađa ugljični dioksid, kemijskom reakcijom C6H12O6+ 6O2→ 6CO2+ 6H2O. Drugi oblik je nestanično disanje, kojim se oslobadametanu okolinu, atmosferu ili hidrosferu (močvarni plin).
- Izgaranjebiomasa(šumski požari,drvoza gorenje) isto oslobađa znatnu količinu ugljičnog dioksida u atmosferu.
- Ugljik može kružiti kroz biosferu kao mrtva tvar (kaotreset), koja ostaje u geosferi.Egzoskeletili kalcijev karbonat iz ljuštura životinja, može postativapnenackroz proces sedimentacije.
- Ugljik kruži i u dubokom oceanu, gdje se određene vrsteplaštenjaka,koje isto stvaraju tvrdu zaštitu, talože na dnu oceana.[6]
Oceanisadrže oko 36 000 x 1012kg ugljika, uglavnom u oblikubikarbonatnih iona.Ekstremne oluje, kao što suuraganiitajfuni,talože velike količine ugljika, budući da ispiru velike količine sedimenata. Jedna studija uTajvanuje izvjestila da je jedan tajfun više isprao ugljika u ocean, nego kiše koje padaju cijelu godinu. Ti bikarbonatni ioni su vrlo važni za uspostavljanjepHvrijednosti u oceanima.
Ugljik se stalno izmjenjuje između oceana i atmosfere. U području uzlaznih struja, ugljik se oslobađa u atmosferu. Suprotno, padaline prenose ugljični dioksid u oceane. Kada ugljični dioksid se otopi u ocean, on slijedi čitav niz kemijskih reakcija, koje su u ravnoteži u određenom dijelu: Otapanje:
- CO2(atmosferski) ⇌ CO2(otopljen)
Pretvaranje u ugljičnu kiselinu:
- CO2(otopljen) + H2O ⇌ H2CO3
Prva ionizacija:
- H2CO3⇌ H+ + HCO3−(bikarbonatni ion)
Druga ionizacija:
- HCO3−⇌ H+ + CO3−−(karbonatni ion)
Ravnoteža tih procesa se ispituje mjerenjima, koja su pokazala da je količina otopljenog ugljika u oceanima oko 10 % količine ugljika u atmosferi. Ako se količina ugljičnog dioksida poveća za 10 % u atmosferi, količina otopljenog ugljika u oceanima se poveća za 1 %.[7]
U oceanima, otopljeni karbonati uglavnom reagiraju skalcijem,stvarajući kruti kalcijev karbonat ilivapnenac(CaCO3), uglavnom kao zaštitne kućice za mikroskopske organizme. Nakon što ti organizmi uginu, vapnenac se taloži na dnu, što i prestavlja najveći spremnik u ugljikovom ciklusu.
- ↑Richard Holmes: "The Age Of Wonder", Pantheon Books, 2008.
- ↑Sedjo, Roger.1993. "The Carbon Cycle and Global Forest Ecosystem, Water, Air, and Soil Pollution",Oregon Wild Report on Forests, Carbon, and Global WarmingArhivirano2010-06-28 naWayback Machine-u)
- ↑[1]Trends in Carbon Dioxide — NOAA Earth System Research Laboratory
- ↑[2]
- ↑"Sequestration of atmospheric CO2in global carbon pools "Lal Rattan, journal = Energy and Environmental Science, 2008.
- ↑""Sinkers "provide missing piece in deep-sea puzzle", publisher=Monterey Bay Aquarium Research Institute MBARI), 2005.[3]
- ↑Millero Frank: "Chemical Oceanography", publisher=CRC Press, 2005.