Fenol
| Tomuto článku alebo sekcii chýbajúodkazyna spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešteoveriť. Pomôžte Wikipédii adoplňte do článkucitácie, odkazy naspoľahlivé zdroje. |
- Pozri ajfenoly.


Fenol,benzenolalebohydroxybenzén(zastarano ajkyselina karbolová) jehydroxyderivátbenzénu.Racionálny vzorecfenolu jeC6H5OH.
Je to tuhá bezfarebná kryštalická látka s charakteristickým zápachom. Na svetle avzduchupostupne ružovie až hnedne a pôsobením kyslíka zvetráva. Fenol je najjednoduchším zástupcom skupiny aromatickýchhydroxyderivátov–fenolov.
Vlastnosti
[upraviť|upraviť zdroj]Fyzikálne
[upraviť|upraviť zdroj]Zanormálnych podmienoktvorí fenol bezfarebnékryštály,ktoré majú niekedy tendenciu sa roztekať.Teplota topeniaje 40,5 °C,teplota varu181,7 °C ahustota1070 kg/m3.Rozpustnosť fenolu vovodeje pomerne nízka, ale je možné ju zvýšiť prídavkom silnej zásady (napr.NaOH). Fenol je silnédezinficiens,ale pre svoj zápach a jedovatosť (LDLO = 140 mg/kg) sa už na tieto účely nepoužíva.
- Mólová hmotnosť: 94,11 g/mol
- pH= 4,9–5,5 (50 g fenolu/1 L vody)
- Dynamickáviskozita:3,437 mPa.s (pri 50 °C)
- Tlak nasýtených pár: 0,2 hPa(pri 20 °C)
- Medza výbušnosti: 1,3–9,5 obj. %
Chemické vlastnosti
[upraviť|upraviť zdroj]Fenol je z hľadiskaBrønstedovejteórie slabákyselina(pKa= 9,95), pretoževodíkhydroxylovej skupiny je odštiepiteľný v podobeprotónu.Zvýšenú kyslosť fenolu oproti jeho alifatickému analógucyklohexanoluzapríčiňuje vysoká elektrónová hustota na aromatickom jadre.
Fenol poskytuje okrem elektrofilných substitučných reakcií na aromatickom jadre aj reakcie prebiehajúce na hydroxylovej skupine (napr.esterifikácia,tvorba alkalickýchfenolátov):
- C6H5OH + NaOH → C6H5ONa + H2O
Elektrofilné substitúcie prebiehajú na fenoleľahšienež nabenzéne,pretože substituent –OHzvyšujeelektrónovú hustotu jadra, keďže nad záporným indukčným efektom prevláda kladný mezomérny efekt (+M efekt):
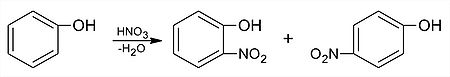
Výroba
[upraviť|upraviť zdroj]Fenol sa bežne nachádza v čienouhoľnom dechte a vo vypieracích vodách po karbonizáciičierneho uhlia.Tieto zdroje však zabezpečujú len malú časť svetovej produkcie fenolu (2,2 mil. ton ročne). Technologicky sú dobre zvládnuté viaceré metódy prípravy:
- alkalické taveniekyseliny benzénsulfónovej
- hydrolýzachlórbenzénu
- kuménový proces.
Najpoužívanejšia metóda je kuménový proces (kumén =izopropylbenzén), pretože pri tomto spôsobe vzniká ako vedľajší produktacetón.
Použitie
[upraviť|upraviť zdroj]Fenol má veľmi široké spektrum využitia. Najväčšia časť svetovej produkcie sa využíva na výrobu fenolformaldehydových živíc a ε-kaprolaktámu. Fenol je východiskovou surovinou pri príprave mnohých alkylovaných fenolov (krezoly,tymol), liečív, farbív, výbušnín, rozpúšťadiel,zmäkčovadiela iných látok.



