Fenol
| |||
| |||

| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
fenol
| |||
| Priporočeno IUPAC ime
Phenol[1] | |||
| Druga imena
karbolna kislina, karbol, benzenol, hidroksibenzen
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.303 | ||
| KEGG | |||
PubChemCID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard(EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C6H6O | |||
| Molska masa | 94,11 g·mol−1 | ||
| Videz | prozorna kristalinična trdnina | ||
| Vonj | sladek, po katranu | ||
| Gostota | 1,07 g/mL (20 °C) | ||
| Tališče | 40,5 °C (104,9 °F; 313,6 K) | ||
| Vrelišče | 181,7 °C (359,1 °F; 454,8 K) | ||
| 8,3 g/L (20 °C) | |||
| Kislost(pKa) | 9,95 (v vodi), 29,1 (v acetonitrilu)[2] | ||
| Struktura | |||
| Dipolni moment | 1,224D | ||
| Nevarnosti | |||
| GHS piktogrami | Predloga:GHSpPredloga:GHSpPredloga:GHSp[4] | ||
| 341, 331, 311, 301, 373, 314 | |||
| 280, 302+352, 301+330+331, 309, 310, 305+351+338[5] | |||
| NFPA 704(diamant ognja) | |||
| Plamenišče | 79 °C (174 °F; 352 K) | ||
| Sorodne snovi | |||
| Sorodne snovi | tiofenol natrijev fenoksid | ||
Če ni navedeno drugače, podatki veljajo za material vstandardnem stanjupri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Fenol,karbolna kislina ali krajše karbol, jearomatskaorganskaspojinas kemijsko formulo C6H5OH. Je bela kristalinična hlapna trdnina. Molekula je sestavljena iz fenilne skupine C6H5-, na katero je vezana hidroksilna skupina –OH. Fenol je srednje kisel in zahteva previdno rokovanje, ker povzroča kemične opekline.
Prvič so ga pridobili izpremogovega katrana,sedaj pa se industrijsko proizvaja iznafte.Letna svetovna proizvodnja je približno 10 milijonov ton.[6]Od tega se je leta 2013 50 % fenola porabilo za proizvodnjobisfenola A(surovina za plastične mase), 26 % za fenolne smole (bakelit), 12 % zakaprolaktam(surovina zapoliamid 6), ostalih 12 % pa za druge proizvode.[7]
Fenoli so navidezno podobnialkoholom,vendar imajo povsem drugačne lastnosti. Za razliko od alkoholov, v katerih je –OH skupina vezana na nasičen ogljikov atom,[8]je pri fenolih vezana na nenasičen aromatski obroč, pri fenolu nabenzenov.[9]Fenoli so zaradi stabilizacije konjugirane baze in resonance aromatskega obroča bolj kisli kot alkoholi.
Lastnosti
[uredi|uredi kodo]Fenol je zelo dobro topen v vodi (približno 84,2 g/L, 0,88 M). Poleg tega tvori homogene zmesi fenol-voda in voda-fenol do razmerja približno 1:2,6 ali celo več. Še bolj topna je njegova sol natrijev fenoksid (C6H5-ONa).
Kislost
[uredi|uredi kodo]Fenol je slabo kisel in pri visokih pH tvori fenolatni anion C6H5O-,ki se imenuje tudi fenoksid (Ph):[10]
- PhOH⇌PhO−+ H+(K = 10−10)
Fenol je milijonkrat bolj kisel od alifatskih alkoholov, a se kljub temu prišteva k šibkim kislinam. Popolnoma reagira z vodnimNaOHin porabi ves H+,medtem ko alkoholi reagirajo samo delno. Fenoli so manj kisli odkarboksilnih kislinin celoogljikove kisline.
Ena od razlag za povečano kislost v primerjavi z alkoholi je resonančna stabilizacija fenoksidnega aniona z aromatskim obročem. Negativni naboj kisika se na ta način delokalizira na orto in para ogljikova atoma.[11]Po drugi razlagi je povečana kislost posledica prekrivanja elektronskih orbital kisikovega prostega elektronskega para in aromatskega sistema.[12]Po tretji razlagi je posledica vpliva indukcije sp2hibridiziranih ogljikovih atomov. pKaenola acetona je 10,9, kar je primerljivo s pKafenola.[13]Kislosti fenola in enola acetona se v plinski fazi razlikujeta zaradi vpliva solvacije. Približno tretjina povečane kislosti fenola bi se lahko pripisalo indukcijskim učinkom, ostali dve tretjini razlike pa resonanci.[14]
Fenoksidni anion
[uredi|uredi kodo]
Fenoksidni anion ima podobno nukleofilnost kot prostiamini,vendar imajo to prednost, da se njihova konjugirana kislina (nevtralni fenol) celo v zmerno kislih pogojih ne deaktivira v celoti kot nukleofil. Fenoli se včasih uporabljajo v sintezipeptidovza aktiviranjekarboksilnih kislinaliestrov,da se pretvorijo aktivirane estre. Fenolatni estri so bolj stabilni protihidrolizikot kislinski anhidridi in acil halidi, vendar so pod milimi pogoji dovolj reaktivni, da olajšajo tvorbo amidnih vezi.
Tavtomerija
[uredi|uredi kodo]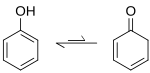
V fenolu je prisotnaketo-enolna tavtomerijaz nestabilnim keto tavtomerom cikloheksadienonom. Ravnotežna konstanta enolizacije je približno 10-13,se pravi da je v keto obliki vsak trenutek samo ena od deset trilijonov molekul.[15]Fenol je torej skoraj v celoti v enolni obliki.[16]
Fenoksidi so enolati, stabilizirani z aromatičnostjo. Pri normalnih pogojih so bolj reaktivni na položaju, kjer je kisikov atom, ki je "trd" nukleofil, medtem ko je α-ogljik "mehak".
Reakcije
[uredi|uredi kodo]
Fenol je zelo reaktiven velektrofilnih aromatskih substitucijah,ker π elektroni kisikovega atoma donirajo svojo elektronsko gostoto aromatskemu obroču. Na obroč se zato lahko s halogeniranjem, acililiranjem, sulfoniranjem in drugimi postopki vežejo različne atomske skupine. Fenolni obroč je za nekatere reakcije tako močno aktiviran, bolj ativiran je samoanilin,da med bromiranjem in kloriranjem substitucija ne poteče samo na enem ogljikovem atomu, ampak na obeh orto in para ogljikovem atomu.
Vodne raztopine fenola so rahlo kisle in moder lakmusov papir obarvajo rahlo rdeče. Fenol se zlahka nevtralizira z natijevim hidroksidom, pri čemer nastane natrijev fenolat (ali fenat). Je šibkejša kislina kotogljikova kislina,zato se ne more nevtralizirati znatrijevim bikarbonatomalinatrijevim karbonatom,da bi se sprostilogljikov dioksid.
- C6H5OH + NaOH → C6H5ONa + H2O
Če se zmes fenola inbenzoil kloridastresata v prisotnosti razredčene raztopine natrijevega hidroksida, nastane fenil benzoat (primerSchotten-Baumannove reakcije):
- C6H5OH + C6H5COCl → C6H5OCOC6H5+ HCl
Če se fenol destilira scinkovimprahom ači če njegove pare prehajajo skozi granuliran cink pri 400 °C, se reducira vbenzen:[17]
- C6H5OH + Zn → C6H6+ ZnO
Če fenol reagira zdiazometanomv prisotnosti borovega trifluiroda (BF3), kot glavna produkta nastanetaanisolin plinastidušik:
- C6H5OH + CH2N2→ C6H5OCH3+ N2
Proizvodnja
[uredi|uredi kodo]Fenol se lahko proizvaja po več postopkih. Trenutno prevladuje postopek delne oksidacijekumena(izopropilbenzena) sHockovo premestitvijo,po katerem se proizvede približno 95 % fenola (2003):[18]
- C6H5CH(CH3)2+ O2→ C6H5OH + (CH3)2CO
Kumensko-peroksidni postopek zahteva v primerjavi z večino drugih procesov relativno mile reakcijske pogoje in relativno poceni surovine, vendar njegova gospodarnost ni odvosna samo od prodaje fenola, ampak tudi od prodaje stranskega proizvodaacetona.
Eden od prvih postokov, ki sta ga razvila Bayer in Monsanto na začetku 20. stoletja, se je začel z reakcijo močne baze z benzensulfonatom:[19]
- C6H5SO3H + 2 NaOH → C6H5OH + Na2SO3 + H2O
Med druge postopkeza proizvodnjo fenola spadajo:
- hidroliza klorobenzena z bazo ali vodno paro (Raschig–Hookerjev postopek):[20]
- C6H5Cl + H2O → C6H5OH + HCl
- oksidacija benzena zdidušikovim oksidom,ki je potencialno "zelen" postopek:
- C6H6+ N2O → C6H5OH + N2
- oksidacijatoluena,ki jo je razvil Dow Chemical:
- C6H5CH3+ 2 O2→ C6H5OH + CO2+ H2O
Uporaba
[uredi|uredi kodo]Približno dve tretjini fenola se porabi za proizvodnjoplastičnih masali surovin zanje. S kondenzacijo fenola z acetonom nastanebisfenol A,ki je ključna surovina za proizvodnjopolikarbonatovinepoksidnih smol.S polikondenzacijo fenola, alkilfenolov ali difenolov sformaldehidomnastanejo fenolne smole, od katerih je najbolj znanbakelit.Z delnim hidrogeniranjem nastanecikloheksanon,ki je osnova za sintezonajlona.Neionskidetergentise proizvajajo z alkilacijo fenola, s katero nastanejo alkilfenoli, na primer nanolfenol, ki se zatem etoksilirajo.[18]
Fenol je osnovna surovina tudi za številna zdravila, od katerih je najbolj znanaspirin,inherbicidov.
Drugo
[uredi|uredi kodo]Fenol se je nekoč uporabljal kotantiseptik,predvsem v karbolnihmilih,ki so se na široko uporabljala od začetka 20. stoletja do 1970. let. Je tudi ena od komponent v sredstvih za odstranjevanje barvnih premazov, ki se v letalski industriji uporabljajo za odstranjevanje predvsem epoksidnih, poliuretanskih in drugih kemično odpornih premazov.[21] Derivati fenola se uporabljajo tudi za pripravo kozmetičnih preparatov, na primersredstev za zaščito pred soncem[22]barvanje las in svetlenja kože.[23]
Koncentrirane raztopine fenola se pogosto uporabljajo za kirurško obdelavo vraščenih nohtov na nogah, ker preprečujejo ponovno vraščanje odrezanega dela nohta. Postopek se imenuje fenolizacija.
Zgodovina
[uredi|uredi kodo]Nečist fenol je leta 1834 izoliralFriedlieb Ferdinand Rungeiz premogovega katrana.[24]Runge ga je imenoval karbolna kislina (Karbolsäure). Premogov katran je bil glavni vir fenola vse do razvoja petrokemijske industrije. Čist fenol je leta 1841 izoliral francoski kemikAuguste Laurent.[25]
Leta 1836 si je Auguste Laurent zabenzenizmislil ime "phène"[26](izgrškegaφαινω [faino], iluminat), ker ga je odkril v svetilnem plinu. Ime je postalo koren za besedi fenol in fenil. Leta 1843 je francoski kemikCharles Gerhardtphène preimenoval v fenol.[27]
Antiseptične lastnosti fenola je odkril in izkoriščalkirurgJoseph Lister(1827–1912) v svojih pionirskih antiseptičnih operacijah. Lister je zahteval, da se rane popolnoma očistijo, in nato prekrijejo s kosom tkanine ali vato, namočeno v fenol.[28]Stalna izpostavljenost fenolu je dražila kožo, kar je nazadnje privedlo do zamenjave fenola z manj agresivnimi razkužili.
Fenol je aktivna komponenta nekaterih oralnih analgetikov.
Fenol je bil tudi glavna sestavina tako imenovane "karbolne dimne žoge", neučinkovite naprave, ki so jo v 19. stoletju tržili v Londonu in naj bi ščitila pred gripo in drugim boleznim. Njena raba se je končala z razvpitim sodnim procesom.
Druga svetovna vojna
[uredi|uredi kodo]Toksičen vpliv fenola naosrednje živčevjepovzroči takojšnjo izgubo zavesti pri ljudeh in živalih. Temu sledijo krči, ki so posledica nekontrolirane aktivnosti osrednjega živčevja.[29]Leta 1939 so začelinacistiv okviruAkcije T4uporabljati injekcije fenola za usmrčevanje posameznikov.[30]Za usmrčevanje manjših skupin so jih uporabljali tudi potem, ko so za množične pomore začeli uporabljatiZyklon-B,[31]zlasti v taboriščuAuschwitz-Birkenau.Za usmrtitev človeka zadostuje 1 g fenola.[32][33]Najbolj znan zapornik, ki je bil v Auschwitzu umorjen s fenolom, je bil poljski katoliški duhovnikMaksimilijan Kolbe,ki je šel prostovoljno v smrt namesto nekega njemu neznanega zapornika.[33]
Naravna nahajališča
[uredi|uredi kodo]Fenol je normalen človekovpresnovniprodukt, ki se izloča zurinomv količinah do 40 mg / L.[29]
Izloček senčnih žlezslonjihsamcev med mastom vsebujejo nekaj fenola in 4-metilfenola.[34][35]
Fenol je tudi ena od spojin, ki jih vsebujebobrovina.Bobrovino se nabira z rastlin, s katerimi se bober prehranjuje.[36]
Viski
[uredi|uredi kodo]Fenol je merljiva komponenta arome in okusa islayskega škotskegaviskija.[37]Običajne vsebnosti so približno 30 ppm, dosežejo pa tudi vrednosti preko 150 ppm. Fenol nastaja med praženjemječmenavslad.[38]
Biološka razgradnja
[uredi|uredi kodo]BakterijaCryptanaerobacter phenolicuspresnavlja fenol in ga preko 4-hidroksibenzoata pretvarja v benzoat.[39]BakterijaRhodococcus phenolicuslahko razgrajuje fenol kot edini vir ogljika.[40]
Toksičnost
[uredi|uredi kodo]Fenol in njegovi hlapi razjedajo oči, kožo in dihalne poti.[41]Razjedanje kože in sluzničnih membran je posledica njegovega degenerativnega učinka nabeljakovine.[29]Ponavljajoč ali dolgotrajen stik s kožo lahko povzroči fenolni dermatitis in opekline druge ali celo tretje stopnje.[42]Vdihavanje fenolnih hlapov lahko povzroči pljučni edem.[41]Fenol ima škodljive učinke na osrednje živčevje in srce, ki se lahko končajo z aritmijo, srčnim napadom in komo.[43]Dolgotrajna ali ponavljajoča se izpostavljenost ima lahko škodljive učinke tudi na jetra in ledvice.[44]Njegova rakotvornost na ljudeh ni dokazana.[45]Eden od vzrokov za njegovo toksičnost bi poleg hidrofobnosti lahko bilo tudi nastajanje prostih fenoksilnih radikalov.[46]
Ker se fenol relativno hitro resorbira skozi kožo, lahko poleg lokalnih opeklin povzroči tudi splošno zastrupitev organizma.[29]Velike količine fenola se lahko resorbirajo tudi skozi majhno površino kože. Zastrupitvi hitro sledi paraliza osrednjega živčevja in resen padec telesne temperature. Oralna toksičnost LD50za pse, kunce in miši je 300-500 mg/kg telesne mase. Smrtni odmerek za človeka je 140 mg/kg telesne mase.[29]
Kemične opekline se lahko dekontaminirajo s spiranjem polietilen glikolom,[47]izopropil alkoholom[48]in morda celo z zelo velikimi količinami vode.[49]Kontaminirana oblačila se mora sleči in takoj poiskati zdravniško pomoč. To je zlasti pomembno, če je fenol pomešan skloroformom.Takšna zmes se uporablja v molekularni biologiji za očiščevanje DNA in RNA. Fenol je tudi reprodukcijski toksin, ki poveča verjetnost splava in majhne porodne mase.
Sklici
[uredi|uredi kodo]- ↑»Front Matter«.Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book).Cambridge:The Royal Society of Chemistry.2014. str. 690.doi:10.1039/9781849733069-FP001.ISBN978-0-85404-182-4.
Only one name is retained, phenol, for C6H5-OH, both as a preferred name and for general nomenclature.
- ↑A. Kütt, V. Movchun, T. Rodima, T. Dansauer, E.B. Rusanov, I. Leito, I. Kaljurand, J. Koppel, V. Pihl, I. Koppel, G. Ovsjannikov, L. Toom, M. Mishima, M. Medebielle, E. Lork, G.V. Röschenthaler, I.A. Koppel, A.A. Kolomeitsev (2008).Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline.The Journal of Organic Chemistry 73 (7): 2607–20. doi: 10.1021/jo702513w.PMID 18324831.
- ↑http://omlc.ogi.edu/spectra/PhotochemCAD/html/phenol.html
- ↑Sigma-Aldrich Co.,Phenol.Pridobljeno 2013-07-20.
- ↑GESTIS-StoffdatenbankArhivirano2015-04-05 naWayback Machine..
- ↑The Essential Chemical Industry online.Pridobljeno 1. januarja 2015.
- ↑Phenol: 2014 World Market Outlook and Forecast up to 2018.Pridobljeno 1. januarja 2015.
- ↑Alcohols.IUPAC, Compendium of Chemical Terminology. 2. izdaja. 1997.
- ↑Phenols.IUPAC, Compendium of Chemical Terminology. 2. izdaja. 1997.
- ↑M.B. Smith, J. March (2007).AdvancedOrganic Chemistry: Reactions, Mechanisms, and Structure.6. izdaja. New York: Wiley-Interscience.ISBN 0-471-72091-7.
- ↑Organic Chemistry. 2. Izdaja. John McMurry,ISBN 0-534-07968-7.
- ↑J. Clark.The Acidity of Phenol.ChemGuide. Jim Clark. Pridobljeno 5. avgusta 2007.
- ↑Acidity Concepts of Organic Molecules.
- ↑P.J. Silva (2009).Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens.J. Org. Chem.74(2): 914–916. doi: 10.1021/jo8018736.PMID 19053615.
- ↑M. Capponi, I.G. Gut, B. Hellrung, G. Persy, J. Wirz (1999).Ketonization equilibria of phenol in aqueous solution.Can. J. Chem.77(5–6): 605–613. doi: 10.1139/cjc-77-5-6-605.
- ↑J. Clayden, N. Greeves, S. Warren, P. Wothers (2001).Organic Chemistry.1. Izdaja. Oxford University Press. Str. 531.ISBN 978-0-19-850346-0.
- ↑H. Roscoe (1891).A treatise on chemistry3, 3. London: Macmillan & Co. Str. 23.
- ↑18,018,1Manfred Weber, Markus Weber, M. Kleine-Boymann (2004).Ullmann's Encyclopedia of Industrial chemistry.doi:10.1002/14356007.a19_299.pub2.ISBN 3527306730.
- ↑H.A. Wittcoff, B.G. Reuben (1980).Industrial Organic Chemicals in Perspective.Part One: Raw Materials and Manufacture. Wiley-Interscience, New York.
- ↑20,020,1H.-G. Franck, J.W. Stadelhofer (1988).Industrial Aromatic Chemistry.Springer-Verlag, New York. Str. 148-155.
- ↑CH207Aircraft paintstripper, phenolic, acid.Callington. 14. october 2009. Pridobljeno 27. avgusta 2011.
- ↑A. Svobodová, J. Psotová, D. Walterová (2003).Natural Phenolics in the Prevention of UV-Induced Skin Damage.A Review. Biomed. Papers 147 (2): 137–145. doi: 10.5507/bp.2003.019.
- ↑R. H. DeSelms.UV-Active Phenol Ester C ompounds.Enigen Science Publishing. Washington, DC, 2008.
- ↑F. F. Runge (1834).Über einige Produkte der Steinkohlendestillation.Annalen der Physik und Chemie,31:65-78 in 308-328.
- ↑A. Laurent (1841).Mémoire sur le phényle et ses dérivés.Annales de Chimie et de Physique3(3): 195-228.
- ↑A. Laurent (1836).Sur la chlorophénise et les acides chlorophénisique et chlorophénèsique.Annales de Chemie et de Physique63:27–45.
- ↑C. Gerhardt (1843). Recherches sur la salicine. Annales de Chimie et de Physique 3 (7): 215-229.
- ↑J. Lister (1867).Antiseptic Principle Of The Practice Of Surgery.Modern History Sourcebook.
- ↑29,029,129,229,329,4Phenol.Ullmann's Encyclopedia of Industrial Chemistry25:589–604. Wiley-VCH. 2003.
- ↑R.J. Lifton.The Nazi DoctorsArhivirano2017-10-22 naWayback Machine.. 14. poglavje. Killing with Syringes: Phenol Injections.
- ↑P. Tyson.The Experiments.NOVA.
- ↑Phenol: Hazards and PrecautionsArhivirano2012-04-05 naWayback Machine.. University of Connecticut, USA. Pridobljeno 2. decembra 2011.
- ↑33,033,1Killing through phenol injection. Auschwitz: Final Station Extermination.Linz, Austria: Johannes Kepler University. Pridobljeno 29. septembra 2006.
- ↑L.E.L Rasmussen, T.E. Perrin (1999).Physiological Correlates of Musth.Physiology & Behavior67(4): 539. doi: 10.1016/S0031-9384(99)00114-6.
- ↑D. Ananth.Musth in elephants.Zoo's print journal15(5): 259-262.
- ↑D. Müller-Schwarze (2003).The Beaver: Its Life and Impact.Str. 43.
- ↑P. Brossard.Peat, Phenol and PPM.Pridobljeno 27. maja. 2008.
- ↑Bruichladdich Octomore 4.2 "Comus" Islay Single Malt WhiskyArhivirano2016-04-21 naWayback Machine..
- ↑P. Juteau, V. Côté, M.F. Duckett, R. Beaudet, F. Lépine, R. Villemur, J.G. Bisaillon (2005).Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate.International Journal of Systematic and Evolutionary Microbiology55(1): 245–50. doi: 10.1099/ijs.0.02914-0.PMID 15653882.
- ↑M. Rehfuss, J. Urban (2005).Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources.Systematic and Applied Microbiology28(8): 695–701. doi: 10.1016/j.syapm.2005.05.011.PMID 16261859.
- ↑41,041,1S. Budavari, urednik (1996).The Merck Index: An Encyclopedia of Chemical, Drugs, and Biologicals.Whitehouse Station, NJ: Merck.
- ↑T.M. Lin, S.S. Lee, C.S. Lai, S.D. Lin (junij 2006).Phenol burn.Burns: Journal of the International Society for Burn Injuries32(4): 517–21. doi: 10.1016/j.burns.2005.12.016.PMID 16621299.
- ↑M.A. Warner, J.V. Harper (1985).Cardiac dysrhythmias associated with chemical peeling with phenol.Anesthesiology62(3): 366–7. doi: 10.1097/00000542-198503000-00030.PMID 2579602.
- ↑World Health Organization/International Labour Organization: International Chemical Safety Cards.
- ↑How can phenol affect my health?.U.S. Department of Health and Human Services. Toxicological Profile for Phenol: 24.
- ↑C. Hanscha, S.C. McKarns, C.J. Smith, D.J. Doolittle (junij 2000).Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity.Chemico-Biological Interactions127(1): 61–72. doi: 10.1016/S0009-2797(00)00171-X.PMID 10903419.
- ↑V.K.H. Brown, V.L. Box, B.J. Simpson (1975).Decontamination procedures for skin exposed to phenolic substances.Archives of Environmental Health30(1): 1–6. doi: 10.1080/00039896.1975.10666623.PMID 1109265.
- ↑D.M. Hunter, B.L. Timerding, R.B. Leonard, T.H. McCalmont, E. Schwartz (1992).Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns.Annals of Emergency Medicine21(11): 1303–7. doi: 10.1016/S0196-0644(05)81891-8.
- ↑T.G. Pullin, M.N. Pinkerton, R.V. Johnston, D.J. Kilian (1978).Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits.Toxicol Appl Pharmacol43(1): 199–206. doi: 10.1016/S0041-008X(78)80044-1.PMID 625760.





