Galvanisk element er en typebatteriderkjemisk energiomsettes tilelektrisitet.Det består av toelektrodersom er senket ned i enelektrolytt.Den negativt ladde elektroden eranode,og den positivt ladde elektroden erkatode.Elektrodene er forbundet med enledersom det kan gåstrømgjennom.
Faktaboks
- Uttale
- galvˈanisk elemˈent
Kjemisk energi omdannes tilelektrisk energived at spontane elektrokjemiske reaksjoner skjer på elektrodene.
Det galvaniske elementet ble oppfunnet i 1800 av italienerenAlessandro Volta.Han innførte betegnelsengalvanismeellergalvanisk strømpå strømmen fra slike elementer, til ære for sin avdøde landsmannLuigi Galvani.




Kommentarer (4)
skrevBenedicte S. Rossebø
skrevØyvind Grøn
skrevCaroline Merkesdal
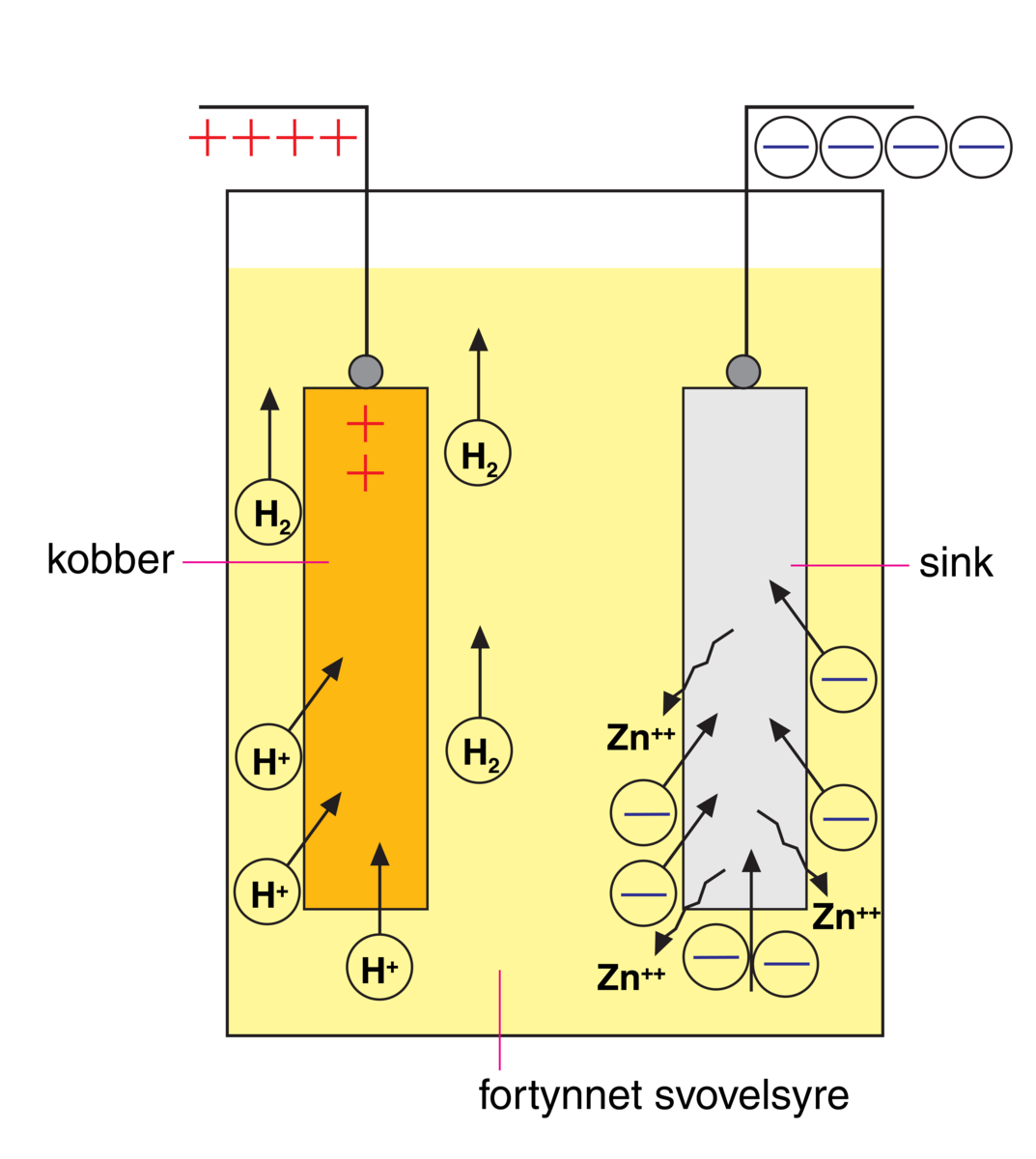
Jeg har lest om det galvaniske elementet mellom sink og kobber, hvor vi har en sinkelektrode dyppet i sinksulfatløsning, og en kobberelektrode dyppet i kobbersulfatløsning. Vi har en elektrolytt (saltbro) mellom løsningene. Elektrodene forbinnes med en ledning. Sink blir oksidert, og er den negative polen. Kobber blir redusert, og er den positive polen.
I følge denne artikkelen er det da sink som har høyest elektrokjemisk potensial, mens kobber har lavt potensial. Men dersom vi ser på spenningsrekken har sink lavere reduksjonspotensial enn kobber. Er det evt. oksidasjonspotensial som er beskrevet i artikkelen, eller har jeg misforstått noe?
Er de følgende utdragene fra denne artikkelen korrekt?
1. (…) Det er høyt potensial der det er positiv ladning og lavt potensial der det er negativ ladning. (…)
2. (…) Stoffer med høyt elektrokjemisk potensial avgir lett ioner i en elektrolytt og egner seg derfor som negativ pol, mens den positive polen må ha et lavt elektrokjemisk potensial. (…)
Jeg får det ikke til å stemme med de følgende artiklene.
SNL: Standard elektrodepotensial
Standard elektrodepotensial, upresis betegnelse for standard reduksjonspotensial, kvantitativt mål for et atom, molekyl eller ions evne til å bli redusert. (…)
(…) I en galvanisk Zn/Cu-celle (…) Den halvreaksjonen som har det mest positive reduksjonspotensialet, skjer som reduksjon, i eksempelet er reduksjonspotensialet størst for Cu2+/Cu. (…)
E_Zn^0= -0,76V
E_Cu^0= 0,34V
SNL: Spenningsrekken
(…) Edle metaller har de høyeste verdiene for standard elektrodepotensial. (…)
SNL: Edelmetaller
(…) Standard elektrodepotensial er et mål for metallenes edelhet. Jo høyere dette potensialet er, jo edlere er metallet. Gull er det edleste av alle metaller.
svarteKjell-Olav Hovde
Hei og takk for godt spørsmål Caroline. Fagansvarlig Øyvind Grøn har videresendt spørsmålet til Truls Norby ved Universitetet i Oslo. Nedenfor er svaret til Truls. Hilsen Kjell-Olav i redaksjonen.
Jeg vil si at artikkelen er riktig, men det ar alltid vanskelig å gi gode nok forklaringer i elektrokjemi.
Her er problemet nok at elektrokjemisk potensial ikke er et elektrisk potensial. Det første er et uttrykk for energi og kan bare være stort eller lite, men ikke negativt. Stort elektrokjemisk potensial betyr ganske enkelt ustabilt. Sink er mer ustabilt enn kobber, mhp alternativet, nemlig ioner og elektroner av metallene. Og siden Zn er mest ustabilt vil det i størst grad forsøke å bli til ioner og elektroner. Derfor blir den negativt ladet.
Å ha høyt elektrokjemisk potensial kan også gi omvendt effekt. F2 gass har høt elektrokjemisk potensial, er veldig ustabil, men mhp å OPPTA elektroner og bli til F- ioner.
Hovedproblemet her er altså at begrepet elektrokjemisk potensial neppe er godt nok forstått eller forklart.
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.