Протон
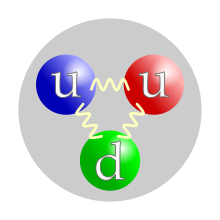 Кваркнисадржај протона.Додела бојапојединачним кварковима је произвољна, али све три боје морају бити присутне. Силе између кваркова посредоване суглуонима. | |
| Класификација | Барион |
|---|---|
| Композиција | 2горња кварка(u), 1доња кварка(d) |
| Статистике | Фермионске |
| Интеракције | Гравитација,електромагнетна,слаба,јака |
| Симбол | p,p+,N+,1 1H+ |
| Античестица | Антипротон |
| Теорије | Вилијам Праут(1815) |
| Откривен | Уочен као H+заслугомЕугена Голдстајна(1886).Ернест Радерфордје идентификовао протон у другим језгрима (и именовао га) (1917–1920). |
| Маса | 1,67262192369(51)×10−27kg[1] 1,007276466621(53)u[2] |
| Средњи полуживот | >2,1×1029година(стабилан) |
| Наелектрисање | +1e 1,602176634×10−19C[2] |
| Радијус наелектрисања | 0,8414(19)fm[2][3] |
| Електрични диполни моменат | <5,4×10−24e⋅cm |
| Електрична поларизабилност | 1,20(6)×10−3fm³ |
| Магнетни момент | 1,41060679736(60)×10−26J⋅T−1[2] 2,79284734463(82)μN[2] |
| Магнетна поларизабилност | 1,9(5)×10−4fm³ |
| Спин | 1/2 |
| Изоспин | 1/2 |
| Парност | +1 |
| Кондензован | I(JP) =1/2(1/2+) |
Уфизици,протон(грч.πρώτος[prótos— протос] — „први “) јесубатомска честицаса позитивним елементарнимнаелектрисањемод 1,6 × 10−19кулонаи масом од 938MeV/c2(1,6726231 × 10−27kg,што је око 1800 пута већа од масеелектрона).[4]Протон се генерално сматра стабилном честицом, са доњом границомполураспадаод око 1035година, и није сигурно да ли уопште може да се распадне. Пошто се не зна да постоји неки физички закон због ког протон не би могао да се распадне, неке данашње теорије предвиђају стабилност, а неке распад протона.[5]
Протон, попутнеутрона,спада унуклеоне,односно честице које сачињавају језгра атома.Атомско језгронајраспрострањенијег изотопаводоникачини само један протон. Језгра других атома се састоје из протона инеутронакоје на окупу држијака нуклеарна сила.Број протона у језгру дефинишехемијски елементи одређује хемијска својства атома. Протон на основу своје унутрашње структуре спада у класубарионаи састоји се од два Up ( "горња" )кваркаи једног Down ( "доњег" ) кварка, који се на окупу држе јаким нуклеарним силама прекоглуона.Античестицапротона јеантипротон,који као честица има све карактеристике исте као и протон, осим што му је наелектрисање супротног знака, односно има јединично негативно наелектрисање (као електрон). Ухемијиибиохемији,терминпротонможе да се односи наводониковјон.У овом контексту, донор протона јекиселина,а акцептор протона јебаза.
Реч протон је изведена из грчке речи са значењем „први”, а ово име је језгру водоника даоЕрнест Радерфорд1920. Претходних година, Радерфорд је открио даводониковојезгро (познато да је најлакше језгро) може да се извади из језгараазотаатомским сударима.[6]Протони су, према томе, били кандидат зафундаменталну честицу,а самим тим и градивни блок азота и свих других тежих атомских језгара.
Иако су протони изворно сматрани основним или елементарним честицама, у савременомстандардном моделуфизике честицапротони су класификовани каохадрони,попутнеутрона,који је исто таконуклеон.Протони су композитне честице састављене од тривалентна кварта:двагорња кварканабоја +2/3eи једногдоњег кварканабоја –1/3e.Масе мировањакваркова доприносе само око 1% масе протона.[7]Остатак протонске масе настаје захваљујућиенергији везивања квантне хромодинамике,која укључујекинетичку енергијукваркова и енергијуглуонскихпоља која везују кваркове заједно. Како протони нису основне честице, они поседују мерљиву величину; средњи квадратни коренполупречника набојапротона је око 0,84–0,87fm(или0,84×10−15до0,87×10−15m).[8][9]Године 2019, две различите студије, користећи различите технике, откриле су да је радијус протона 0,833 fm, са неизвесношћу од ±0,010 fm.[10][11]
Атомска теорија
[уреди|уреди извор]У атомској теоријиматерије,атомсе састоји одатомског језграоко кога кружеелектрони.Данас је генерално признато мишљење да се атомска језгра свиххемијских елеменатасастоји од позитивно набијених протона инеутронакоји немајуелектрични набој.Честице које се налазе у атомском језгру, то јест протони и неутрони, зову се заједничким именомнуклеони(лат.nucleus:језгра). Неутрон имамасуготово једнаку маси протона. Протон је језгроводониковогатома, те му је маса једнака маси атома водоника. Број протона у атомском језгру који се зовеатомски број,једнак је њезиномелектричном набојуи увек одговара редном броју хемијског елемента упериодном систему.Дакле атомским бројем одређена је врста хемијског елемента.
У неутралном атому број електрона што круже око језгре једнак је броју протона у језгру. Позитиван набој једног протона једнако је велик као негативан набој електрона. Године 1869, руски хемичарД. И. Мендељејевоткрио је законитост понављања хемијских својства елемената код повећања њихове атомске масе. Он је тада све познате елементе поређао по растућим атомским масама један изнад другога и саставио периодни систем. Мендељејев је доказао да сваки хемијски елемент има одређен састав атома који означава атомска маса и место у периодном систему елемената.
Број протонаPи неутронаNу језгру одређује атомску масуAодређеног елемента, то јест:
и зове семасени бројатома. На пример језгрохелијумасастоји се од два протона и два неутрона. Према томе јеелектрични набојјезгра иредни бројхелијума 2, арелативна атомска маса4. Око атомског језгра круже негативно набијени електрони, а број електрона једнак је броју протона у језгру.
За дати број протона у језгри могу постојати различите количине неутрона. Два атома који имају исти број протона, а различити број неутрона, имају скоро иста хемијска својства и исти редни број, али различите атомске масе. Такви елементи који имају исти редни број, а различиту атомску масу, зову сеизотопи.Тако на пример постојихлоркоји има редни број 17, то јест његово језгро садржи 17 протона, док му је атомска маса 35, што значи да језгро његовог атома садржи 18 неутрона (17 + 18 = 35). Међутим, постоји и хлор с атомском масом 37, то јест језгро његовог атома садржи 20 неутрона (17 + 20 = 37). Обичан хлор који се налази у једињењима у природи има атомску масу 35,46, што значи да је он смеша та два изотопа који су у њему заступани у односу 3: 1, то јест:
Први изотоп хлора пише се симболички17Cl35,а други17Cl37.Горњи број уз хемијски симбол елемента значи релативну атомску масу тог елемента, а доњи - број протона у језгру тог елемента, односно његов редни број.Водоникима три изотопа:1H1обичан водоник,1H2тешки водоник илидеутеријум,и1H3трицијум.
Овакви изотопи нађени су готово код свих хемијских елемената. Такоуранијум,који је важан за добивањенуклеарне енергије,има 5 изотопа. Уранијум има редни број 92, а његови изотопи имају атомске масе 234, 235, 237, 238 и 239. У природном уранијуму најјаче је заступљен изотоп с атомском масом 238. Има га 137 пута више него изотопа с атомском масом 235. Осталих његових изотопа има још и мање. Изотопи се данас у знатној мери примењују у медицини, техници и привреди, а нарочито су веома важни у производњи нуклеарне енергије. Одељивање изотопа врши се центрифугирањем, дестилацијом, дифузијом и тако даље.
Да се језгро атома која се састоји од позитивно набијених протона не би распало, јер се истоимени електрични набоји међусобно одбијају, делују привлачне силе које владају, између протона и неутрона. То су такозване силе језгра илиосновне силекоје, иако су врло велике, делују само на врло малим раздаљинама, то јест на димензијама атомског језгра. Тумачење тих сила се у данашње време убраја у главне проблеме атомске физике.[12]
Историја
[уреди|уреди извор]Протон је1918.откриоЕрнест Радерфорд.Он је запазио да при бомбардовању гасовитогазотаалфа честицама,светлоснидетекторипоказују присуство водониковог језгра. Радерфорд је закључио да је једино место одакле водоник може да потиче - азот, и стога азот мора садржативодониково језгро.Он је стога закључио да је водониково језгро, за које је било познато да има атомски број 1, елементарна честица. Овој честици је дао име протон одгрчкеречи πρώτος [protos— протос] — „први “.
Технолошке примене
[уреди|уреди извор]Попут других елементарних честица, протон поседујеспин.Ово својство је искоришћено унуклеарној магнетној резонанцији(НМРспектроскопији).
Види још
[уреди|уреди извор]Референце
[уреди|уреди извор]- ^„2018 CODATA Value: proton mass”.The NIST Reference on Constants, Units, and Uncertainty.NIST.20. 5. 2019.Приступљено2019-05-20.
- ^абвгдђе"2018 CODATA recommended values"https://physics.nist.gov/cuu/Constants/index.html
- ^Pohl, Randolf; et al. (8. 7. 2010).„The size of the proton”.Nature.466(7303): 213—216.Bibcode:2010Natur.466..213P.PMID20613837.S2CID4424731.doi:10.1038/nature09250.
- ^„What is Proton - Properties of Proton”.Nuclear Power(на језику: енглески).Приступљено9. 10. 2019.
- ^„Proton Decay Searches: Hyper-Kamiokande”.www.hyper-k.org.Приступљено9. 10. 2019.
- ^„proton | Definition, Mass, Charge, & Facts”.Encyclopedia Britannica.Приступљено20. 10. 2018.
- ^Cho, Adrian (2. 4. 2010).„Mass of the Common Quark Finally Nailed Down”.Science Magazine.American Association for the Advancement of Science.Приступљено27. 9. 2014.
- ^„Proton size puzzle reinforced!”.Paul Shearer Institute.25. 1. 2013.
- ^Antognini, Aldo; et al. (25. 1. 2013).„Proton Structure from the Measurement of 2S-2P Transition Frequencies of Muonic Hydrogen”(PDF).Science.339(6118): 417—420.Bibcode:2013Sci...339..417A.PMID23349284.S2CID346658.doi:10.1126/science.1230016.hdl:10316/79993.Архивирано изоригинала(PDF)14. 03. 2020. г.Приступљено12. 08. 2020.
- ^Bezginov, N.; Valdez, T.; Horbatsch, M.; Marsman, A.; Vutha, A. C.; Hessels, E. A. (6. 9. 2019). „A measurement of the atomic hydrogen Lamb shift and the proton charge radius”.Science.365(6457): 1007—1012.Bibcode:2019Sci...365.1007B.ISSN0036-8075.PMID31488684.S2CID201845158.doi:10.1126/science.aau7807.
- ^Xiong, W.; Gasparian, A.; Gao, H.; Dutta, D.; Khandaker, M.; Liyanage, N.; Pasyuk, E.; Peng, C.; Bai, X.; Ye, L.; Gnanvo, K. (новембар 2019). „A small proton charge radius from an electron–proton scattering experiment”.Nature.575(7781): 147—150.Bibcode:2019Natur.575..147X.ISSN1476-4687.OSTI1575200.PMID31695211.S2CID207831686.doi:10.1038/s41586-019-1721-2.
- ^Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
Литература
[уреди|уреди извор]- Macura, Slobodan; Radić-Perić, Jelena (2004).Atomistika.Beograd: Fakultet za fizičku hemiju Univerziteta u Beogradu/Službeni list. стр. 499.


