Ciklooksigenaza
| Prostaglandin endoperoksid sintaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||||
| EC broj | 1.14.99.1 | ||||||||
| CAS broj | 9055-65-6 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA pristup | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG pristup | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| StrukturePBP | RCSB PDBPDBePDBjPDBsum | ||||||||
| Ontologija gena | AmiGO/EGO | ||||||||
| |||||||||
| Ciklooksigenaza 1 | |
|---|---|
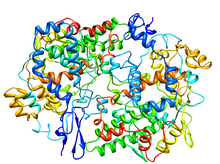 Kristalografska struktura kompleksa prostaglandin H2 sintaze-1 saflurbiprofena.[1] | |
| Identifikatori | |
| Simbol | PTGS1 |
| Alt. simboli | COX-1 |
| Entrez | 5742 |
| HUGO | 9604 |
| OMIM | 176805 |
| PDB | 1CQE |
| RefSeq | NM_080591 |
| UniProt | P23219 |
| Ostali podaci | |
| EC broj | 1.14.99.1 |
| Lokus | Hromozom 9q32-q33.3 |
| Ciklooksigenaza 2 | |
|---|---|
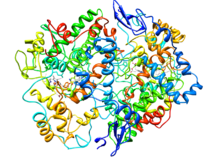 Ciklooksigenaza-2 (Prostaglandin sintaza-2) u kompleksu sa COX-2 selektivnim inhibitorom.[2] | |
| Identifikatori | |
| Simbol | PTGS2 |
| Alt. simboli | COX-2 |
| Entrez | 5743 |
| HUGO | 9605 |
| OMIM | 600262 |
| PDB | 6COX |
| RefSeq | NM_000963 |
| UniProt | P35354 |
| Ostali podaci | |
| EC broj | 1.14.99.1 |
| Lokus | Hromozom 1q25.2-25.3 |
Ciklooksigenaza(COX) jeenzim(EC1.14.99.1) koji je odgovoran za formiranje važnih bioloških posrednika zvanihprostanoidi,među kojima suprostaglandini,prostacikliniitromboksan.Farmakološka inhibicijaCOX-amože da proizvede olakšavanje simptomainflamacijeibola.Nesteroidni antiinflamatorni lekovi,poputaspirinaiibuprofena,deluju putem COX inhibicije. Imena "prostaglandin sintaza (PHS)" i "prostaglandin endoperoksid sintetaza (PES)" su još uvek u upotrebi za COX.
Funkcija
[уреди|уреди извор]COXkonvertujearahidonsku kiselinu(AA,ω-6PUFA) doprostaglandina H2(PGH2), prekursora serije-2prostanoida.Ovaj enzim sadrži dva aktivna mesta:hemsaperoksidaznimdejstvom, koje je odgovorno za redukciju PGG2do PGH2,i ciklooksigenazno mesto, gde se arahidonska kiselina konvertuje u hidroperoksi endoperoksid prostaglandin G2(PGG2). Reakcija obuhvata oduzimanje H atoma sa arahidonske kiselinetirozinskimradikalom koji formiraperoksidaznoaktivno mesto.Dva O2molekula zatim reaguju sa arahidonskim anjonom, proizvodeći PGG2.
Trenutno su triCOXizoenzimapoznata:COX-1,COX-2,iCOX-3.COX-3is asplajsna varijantaCOX-1, koja zadržavaintronjedan i imamutaciju okvira čitanja;tako da se koristi i imeCOX-1biliCOX-1 varijanta(COX-1v).[3]
Različita tkiva izražavaju promenljive nivoeCOX-1iCOX-2.Mada oba enzima deluju na isti načini, selektivna inhibicija može da proizvede različite nuspojave.COX-1se smatra konstitutivnim enzimom, koji se nalazi u većini tkiva sisara.COX-2,s druge strane se ne može detektovati u većini normalnih tkiva. On jeinduktivni enzim,koji postaje izobilan u aktiviranimmakrofagamai drugim ćelijama na mestima inflamacije. Nedavno je bilo pokazano da je on povišeno izražen u raznimkarcinomimai da ima centralnu ulogu u tumorigenezi.
COX-1 i -2 (poznati i kao PGHS-1 i -2) takođe oksigenuju dve druge esencijalne masne kiseline -DGLA(ω-6) iEPA(ω-3) - da proizveduprostanoideserije-1 i serije-3, koji su manjeinflamatorniod članova serije-2. DGLA i EPA sukompetitivni inhibitorisa AA-om za COX put. Ova inhibicije je glavni mod dejstva kojim dijetarni izvori DGLA i EPA (npr.,boražina,riblje ulje) redukuju inflamaciju.[4]

Reference
[уреди|уреди извор]- ^PDB:1CQE.Picot D, Loll PJ, Garavito RM (1994). „The X-ray crystal structure of the membrane protein prostaglandin H2 synthase-1”.Nature.367(6460): 243—9.Bibcode:1994Natur.367..243P.PMID8121489.S2CID4340064.doi:10.1038/367243a0.
- ^PDB:6COX.Kurumbail RG, Stevens AM, Gierse JK, McDonald JJ, Stegeman RA, Pak JY, Gildehaus D, Miyashiro JM, Penning TD, Seibert K, Isakson PC, Stallings WC (1996). „Structural basis for selective inhibition of cyclooxygenase-2 by anti-inflammatory agents”.Nature.384(6610): 644—8.Bibcode:1996Natur.384..644K.PMID8967954.S2CID4326310.doi:10.1038/384644a0.
- ^Chandrasekharan NV, Dai H, Roos KL, Evanson NK, Tomsik J, Elton TS, Simmons DL (2002).„COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: Cloning, structure, and expression”.Proc. Natl. Acad. Sci. U.S.A.99(21): 13926—31.PMC129799
 .PMID12242329.doi:10.1073/pnas.162468699
.PMID12242329.doi:10.1073/pnas.162468699  .
.
- ^Simopoulos, A. P. (2002). „Omega-3 fatty acids in inflammation and autoimmune diseases”.J Am Coll Nutr.21(6): 495—505.PMID12480795.S2CID16733569.doi:10.1080/07315724.2002.10719248.
Literatura
[уреди|уреди извор]- Nicholas C. Price; Lewis Stevens (1999).Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins(Third изд.). USA: Oxford University Press.ISBN019850229X.
- Eric J. Toone (2006).Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution(Volume 75 изд.). Wiley-Interscience.ISBN0471205036.
- Branden C; Tooze J.Introduction to Protein Structure.New York, NY: Garland Publishing.ISBN0-8153-2305-0.
- Irwin H. Segel.Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems(Book 44 изд.). Wiley Classics Library.ISBN0471303097.
- William P. Jencks (1987).Catalysis in Chemistry and Enzymology.Dover Publications.ISBN0486654605.
- Silva, Pedro J.; Fernandes, Pedro A.; Ramos, Maria J. (2003). „A theoretical study of radical-only and combined radical/Carbocationic mechanisms of arachidonic acid cyclooxygenation by prostaglandin H synthase”.Theoretical Chemistry Accounts: Theory, Computation, and Modeling (Theoretica Chimica Acta).110(5): 345—351.S2CID95285078.doi:10.1007/s00214-003-0476-9.
Spoljašnje veze
[уреди|уреди извор]- Ciklooksigenaza
- CyclooxygenaseнаUS National Library of Medicine Medical Subject Headings(MeSH)
- GONUTS: ciklooksigenaza
