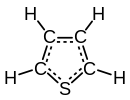
Tiofen
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Thiophene
| |||
| Drugi nazivi
Tiofuran
Tiaciklopentadien | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.003.392 | ||
| RTECS | XM7350000 | ||
| UNII | |||
| |||
| Svojstva | |||
| C4H4S | |||
| Molarna masa | 84,14 g/mol | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 1,051 g/mL, tečnost | ||
| Tačka topljenja | −38 °C (−36 °F; 235 K) | ||
| Tačka ključanja | 84 °C (183 °F; 357 K) | ||
| Indeks refrakcije(nD) | 1.5287 | ||
| Viskoznost | 0.8712 cPna 0.2 °C 0.6432 cPna 22.4 °C | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | External MSDS | ||
EU klasifikacija(DSD)
|
nije na listi | ||
| NFPA 704 | |||
| Tačka paljenja | −1 °C | ||
| Srodna jedinjenja | |||
Srodne materija:tioetri
|
Tetrahidrotiofen Dietil sulfid | ||
Srodna jedinjenja
|
Furan Pirol | ||
Ukoliko nije drugačije napomenuto, podaci se odnose nastandardno stanjematerijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Tiofenjeheterociklično jedinjenjesa formulom C4H4S. On sadržiaromatičanravan petočlani prsten, i podleže ekstenzivnim reakcijama supstitucije. Srodni tiofenu subenzotiofenidibenzotiofen,koji sadrže tiofenski prsten spojen sa jednim i dva benzenska prstena, respektivno. Jedinjenja analogna tiofenu sufuran(C4H4O) ipirol(C4H4NH).[3][4]
Izolacija, rasporstarnjenost[уреди|уреди извор]
Tiofen je nađen kao kontaminant ubenzenu.[5]Primećeno je daisatinformira plavu boju kad se pomeša sasumpornom kiselinomi sirovimbenzenom.Za formiranje plavog indofenina se dugo verovalo da je reakcija benzena.Viktor Mejerje uspeo da izoluje supstancu odgovornu za ovu reakciju u benzenu. To novo heterociklično jedinjenje je bio tiofen.[6]
Tiofen i njegovi derivati se javljaju upetroleumu,u pojedinim slučajevima u koncentracijama i do 1-3%. Tiofenski sadržajpetroleumaiugljase odstranjuje procesomhidrodesulfurizacije(HDS). U HDS, tečni ili gasni materijal se prevodi prekomolibden disulfidnogkatalizatora p pritiskom H2.Tiofen podleže hidrogenolizi i formiraju seugljovodoniciivodonik sulfid.Na taj način, tiofen se konvertuje u butan i H2S. Prevalentniji i problematičniji u petroleumu subenzotiofenidibenzotiofen.
Osobine[уреди|уреди извор]
Na sobnoj temperaturi, tiofen je bezbojna tečnost sa blagim prijatnim mirisom koji podseća nabenzen.Visoka reaktivnost tiofena u reakciji sulfonacije je osnova za separaciju tiofena iz benzena, što je teško postićidestilacijomusled njihovih sličnih tačaka ključanja (razlikuju se za 4 °C na sobnom pritisku). Poput benzena, tiofen formiraazeotropsa etanolom.
Molekul je ravan; sa uglom veze na sumporu od oko 93 stepena, C-C-S ugao je oko 109, i druga dva ugljenika imaju ugao veze od oko 114 stepeni. C-C veze ugljenika susednih sumporu su oko 1.34A, C-S veza je duga oko 1.70A, i druga C-C veza je oko 1.41A.
Reaktivnost[уреди|уреди извор]
Tiofen se smatra aromatičnim, mada teorijske kalkulacije sugeriraju da je njegov stepen aromatičnosti manji od benzena. Elektronski parovi sumpora su znatnodelokalizovaniupi elektronskomsistemu. Posledica njegove aromatičnosti je da tiofen ne manifestuje osobine konvencionalnihtioetara.Na primer atom sumpora je otporan na alkilaciju i oksidaciju.
Literatura[уреди|уреди извор]
- ^Li Q, Cheng T, Wang Y, Bryant SH (2010).„PubChem as a public resource for drug discovery.”.Drug Discov Today.15(23-24): 1052—7.PMID20970519.doi:10.1016/j.drudis.2010.10.003.
- ^Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”.Annual Reports in Computational Chemistry.4:217—241.doi:10.1016/S1574-1400(08)00012-1.
- ^Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001).Organic Chemistry(I изд.). Oxford University Press.ISBN978-0-19-850346-0.
- ^Katritzky A.R.; Pozharskii A.F. (2000).Handbook of Heterocyclic Chemistry(Second изд.). Academic Press.ISBN0080429882.
- ^Viktor Meyer (1883).„Ueber den Begleiter des Benzols im Steinkohlenteer”.Berichte der Deutschen chemischen Gesellschaft.16:1465—1478.doi:10.1002/cber.188301601324.
- ^Ward C. Sumpter (1944). „The Chemistry of Isatin”.Chemical Reviews.34(3): 393—434.doi:10.1021/cr60109a003.
Spoljašnje veze[уреди|уреди извор]