Nitrat
| Den här artikelnbehöver fler eller bättrekällhänvisningarför att kunnaverifieras.(2022-07) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kanifrågasättasoch tas bort utan att det behöver diskuteras pådiskussionssidan. |
| nitrat | |
 | |
| Systematiskt namn | nitrat |
|---|---|
| Kemisk formel | NO3- |
| Molmassa | 62.00 g/mol |
| SI-enheter&STPanvänds om ej annat angivits | |
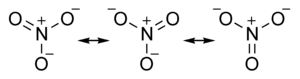
Nitraterär, inom den oorganiska kemin,salteravnitratjonen.Nitratjonen är ensammansatt jonmed den kemiska beteckningen NO3-.
Nitratjoner bildas närnitrifikationsbakterieromvandlarammoniumjonerNH4+tillnitritjoneroch sedan vidare till nitratjoner. Nitratjonerna kan sedan omvandlas tillkvävgasgenomdenitrifikationav fakultativtanaeroba bakterier.
Alla metallnitrat är lösliga ivatten.Vissa nitrater är flyktiga, till exempelkopparnitrat(Cu(NO3)2) ochkvicksilvernitrat(Hg(NO3)2). Vid upphettning sönderfaller metallnitrat vanligen till metalloxidochkvävedioxid,undantagetnatrium- ochkaliumnitratsom bildar motsvarande metallnitritochsyre.Ammoniumnitratsönderdelas vid upphettning tilllustgasoch vattenånga. Ett viktigt exempel på ett organiskt nitrat ärnitroglycerin,som används både inommedicinenochsprängmedelsindustrin.
Finns i
[redigera|redigera wikitext]Gödning
[redigera|redigera wikitext]Nitrat är en viktig beståndsdel i såvälnaturgödselsommineralgödsel.Eftersom nitrat är mycket lättlösligt i vatten kan det lakas ut ivattendragoch hav och där ge problem medövergödning.[1]
Livsmedel
[redigera|redigera wikitext]Nitrat finns naturligt i exempelvis spenat, rödbeta, sallat och ruccola. En del omvandlas i kroppen tillnitrit.
Nitrat och nitrit kan finnas i vatten från egen brunn. Troligen på grund av att gödselvatten runnit in i brunnen.
Nitrat och nitrit förekommer även som tillsats i exempelvis charkprodukter för att förhindra uppkomst av livsfarligtbotulinumtoxin.[2]
Ge inte födoämnen rika på nitrat till spädbarn under ett år. Låt inte smoothies, grönsaksjuice eller andra maträtter innehållande nitratrika födoämnen stå länge framme irumstemperatur,eftersom det är då nitraterna omvandlas till de betydligt farligare nitriterna.
Läkemedel
[redigera|redigera wikitext]Nitrater finns exempelvis i vissa mediciner motkärlkramp(angina pectoris). De fungerar kärlvidgande, vilket sänkerblodtrycketoch på så vis avlastar hjärtat.[3]
Referenser
[redigera|redigera wikitext]- ^”sprida gödsel”.jordbruksverket.https://jordbruksverket.se/vaxter/odling/vaxtnaring/sprida-godsel.Läst 31 juli 2022.
- ^”Nitrat, nitrit och nitrosaminer”.www.livsmedelsverket.se.https://www.livsmedelsverket.se/livsmedel-och-innehall/oonskade-amnen/nitrat-nitrit-och-nitrosaminer.Läst 31 juli 2022.
- ^”Läkemedel vid kärlkramp”.1177.https://www.1177.se/behandling--hjalpmedel/behandling-med-lakemedel/lakemedel-utifran-diagnos/lakemedel-vid-karlkramp/.Läst 31 juli 2022.
