Isotop
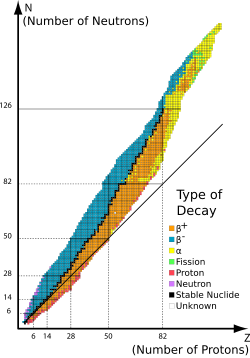
Enisotopav ettgrundämneär en variant med ett specifikt antalneutroner.Atomslagetbestäms av antaletprotoneri kärnan,atomnumret,och är avgörande förelektronkonfigurationen,och därmed de kemiska egenskaperna hos ett ämne. I kärnan finns också för de flesta grundämnen neutroner, som påverkar de kemiska egenskaperna i långt mindre grad. Olika isotoper av samma ämne har därför vanligen nästan helt identiska kemiska egenskaper, även ommasstaletskiljer.
Skillnaderna i masstal kan dock innebära att vissa fysikaliska egenskaper, somdensitet,smältpunkt ochkokpunkt,är olika. Förväte,där atommassan är låg från början, påverkar också skillnaden i massa mellan vanligt ochtungt vätede kemiska egenskaperna något. Dessutom varierar atomkärnans stabilitet kraftigt mellan olika isotoper, varför man vanligen bara kan hitta ett fåtal olika isotoper av ett ämne i naturen. Andra isotoper kan skapas i laboratorier, men är då radioaktiva.
För lättare atomslag är antalet neutroner i kärnan ungefär lika med antalet protoner. Tyngre grundämnen har en högre andel neutroner vilket ses i nuklidkartan.
Ordet isotoper används ibland oegentligt i stället för nuklider.[1]Begreppet nuklid syftar i första hand på nukleära egenskaper framför kemiska egenskaper, medan begreppet isotop främst syftar på kemiska egenskaper framför nukleära. När man fokuserar på en bestämd typ av atomkärna och dess egenskaper, till exempel i kärnreaktioner, väljer man lämpligastnuklid.När det handlar om att gruppera olika slags atomer av ett visst grundämne ärisotopdet mer adekvata begreppet.
Som exempel visar nuklidkartan att grundämne nummer 50 –tenn- har 7 stabila isotoper (svarta rutor) och ytterligare 31 instabila isotoper (orange och blå rutor). Kartan visar också att det finns 3 stabila nuklider (88Sr,89Y och90Zr) med neutronantalet 50. För de två sistnämnda finns det dock även de radioaktivakärnisomererna89mY och90mZr vilka inte markeras i kartan.
Stabila isotoper[redigera|redigera wikitext]
Stabila isotoper är isotoper som inte genomgårradioaktivt sönderfall.Det finns 254 kända stabilanuklider,fördelade på 80 olikagrundämnen.De flesta isotoper är radioaktiva, men eftersom de flesta radioaktiva isotoper har halveringstider som är betydligt kortare än jordens ålder och sönderfallskedjor alltid avslutas med någon stabil isotop, består huvuddelen av materien på jorden av stabila isotoper. Ettgrundämnekan sakna stabila isotoper, eller ha en enda stabil isotop (varamonoisotopt) eller flera. Den tyngsta kända stabila isotopen ärbly-208.
För de flesta grundämnen med flera isotoper är en stabil isotop dominerande i naturen. Detta gör att de flesta grundämnen har enatommassasom ligger nära ett heltal. Ett undantag ärklormed en atommassa på 35,5 u, eftersom naturligt klor består av ¾35Cl och ¼37Cl.
Kunskapen om huruvida en isotop är stabil eller inte, grundar sig på mätningar av dess sönderfall. Det innebär att vissa av de isotoper som idag räknas som stabila, kan tänkas ha ett mycket långsamt sönderfall, som ännu inte kunnat observeras.
Instabila isotoper[redigera|redigera wikitext]
Många isotoper finns men är instabila, det vill säga att de genomgårradioaktivt sönderfall.En isotopshalveringstidbeskriver den tid det tar för hälften av atomerna att sönderfalla.
Det är givet att stabila isotoper och isotoper med lång halveringstid förekommer i naturen i högre grad än andra. För vissa (tyngre) atomslag saknas helt stabila isotoper.
För naturligt förekommande isotoper sker sönderfallet med antingenalfasönderfallellerbetasönderfall;i alfasönderfallet minskar atomtalet med 2 och masstalet med 4; i betasönderfallet ökar atomtalet med 1 och masstalet är oförändrat, eftersom en neutron blir en proton och sedan skjuts en elektron (betapartikel) iväg. I många fall uppstår på så sätt en ny instabil isotop som sönderfaller vidare. På så vis bildas ensönderfallskedja.Vissa kortlivade isotoper som skapas ifissionkan även sönderfalla genom att skicka ut en neutron.
Instabila isotoper på jorden kan delas in i fyra grupper beroende på dess källa.
- Sådana som finns kvar sedan jorden skapades. Dessa har en halveringstid på över 100 miljoner år.
- Sönderfallsprodukter från långlivade isotoper.
- Isotoper som kontinuerligt nybildas av kosmisk strålning.
- Isotoper som skapats vid mänskliga aktiviteter.
Radioaktiva ämnen[redigera|redigera wikitext]
Radioaktiva ämnen kallas ämnen som innehåller instabila isotoper. Vid sönderfallet avges strålning som kan vara skadlig för levande organismer och naturligtvis även förändra döda material. Det radioaktiva sönderfallet, exempelvisurantillbly,kan även användas för att datera olika bergarter.
Exempel på isotoper[redigera|redigera wikitext]
Den upphöjda siffran i exemplen angermasstalet.
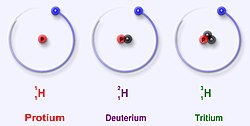
Väte[redigera|redigera wikitext]
Vätehar atomnummer 1, och förekommer som
- 1H (protium), 99,985 %, stabil
- 2H (deuterium), 0,015 %, stabil
- 3H (tritium), halveringstid 12,2 år. Nybildas av kosmisk strålning.
Deuterium kallas också tungt väte, ochvattenmolekylersom innehåller deuterium kallastungt vatten.Tungt vatten har något annorlunda kemiska egenskaper än vanligt vatten och har cirka 10 % större massa per volymenhet. Deuteriums kärnsammansättning är viktig vid användning som moderator i vissa kärnreaktioner.
Kol[redigera|redigera wikitext]
Kolhar atomnummer 6 och förekommer naturligt som
- 12C, 98,9 %, stabil
- 13C, 1,1 %, stabil
- 14C, spår, halveringstid 5730 år. Nybildas av kosmisk strålning.
Det sistnämnda är känt i den vanliga metoden förradiometrisk dateringi bland annatarkeologi,kol-14-metoden.
Uran[redigera|redigera wikitext]
Uranhar atomnummer 92 och förekommer naturligt som
- 234U, 0,006 %, halveringstid 0,25 miljon år. Sönderfallsprodukt i238U:s sönderfallskedja.
- 235U, 0,72 %, halveringstid 0,7 miljard år.
- 238U, 99,275 %, halveringstid 4,5 miljard år.
235U är denklyvbaraisotop som används ikärnkraftverk.Uran behöver därförisotopanrikas,en sorteringsprocess där man sållar bort238U och behåller235U. Avfallet efter anrikning kallasutarmat uran.Urans långa halveringstid utnyttjas vidradiometriska dateringarav äldrebergarter.
Se även[redigera|redigera wikitext]
Källor[redigera|redigera wikitext]
Noter[redigera|redigera wikitext]
- ^Hägg, G. 1963, Allmän och oorganisk kemi, Almqvist & Wiksell Uppsala, avsnitt 1-3c sid 23
