Lustgas
| Lustgas | |
  | |
| Systematiskt namn | Dikvävemonoxid |
|---|---|
| Övriga namn | Lustgas |
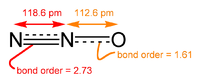
| Kemisk formel | N2O |
| Molmassa | 44,013 g/mol |
| Utseende | Färglös gas |
| CAS-nummer | 10024-97-2 |
| SMILES | N#[N+][O-] [N-]=[N+]=O |
| Egenskaper | |
| Densitet | 0,001977 g/cm³ |
| Löslighet(vatten) | 1,5 g/l (15 °C) |
| Smältpunkt | -90,86 °C |
| Kokpunkt | -88,48 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| SI-enheter&STPanvänds om ej annat angivits | |

Lustgas,kväveoxidul,dikväveoxid,salpeteroxid,N2O, är en icke-brännbargas.
Medicin
[redigera|redigera wikitext]Den är relativt ofarlig vid kontrollerad användning, milt bedövande, men intenarkotikaklassad.Lustgas är enhallucinogenoch kategoriseras underdissociativa droger.[1]Den används främst som smärtlindring vidförlossningar,operationeroch inomtandvårdeneller för att inleda fullnarkosmed annat ämne.
Farmakologisktär lustgas ett relativt säkert medel då den används inom vården och uppblandad medsyreinandas i mask. I slutet av1700-taletupptäcktes att lustgas kunde geförändrat medvetandetillstånd,geberusningoch stilla smärtor. Första gången lustgas anges ha använts som bedövningsmedel var den 11 december 1844 när den amerikanske tandläkarenHorace Wellsi samband med utdragning av en tand lät sig bedövas med lustgas[2].
Det finns färdiga blandningar bestående av lika delar syrgas och lustgas som säljs under namn somEntonox(tillverkas avBOC Group),Kalinox(tillverkas avAir Liquide) ochLivopan(tillverkas avAGA). Svenska ambulanser är vanligtvis utrustade med någon av dessa produkter som kan användas för akut smärtlindring utan attanestesipersonalbehöver närvara.
Risker
[redigera|redigera wikitext]Om mängden syrgas i inandningsluften är låg på grund av att syret ersatts med lustgas kan syrebrist uppkomma. Detta kan i allvarliga fall leda till döden.
Lustgas minskar mängdenvitaminB12i kroppen. För långvarig eller för tät användning av lustgas kan därför geB12-brist.Risker med upprepat så kallatrekreationelltlustgasbruk ärneurologiskaskador, allvarligapsykiskasymtom ochbenmärgspåverkanmedpancytopeni.Det finns också risk för kroniska besvär.[3]
Motorer
[redigera|redigera wikitext]Lustgas underhåller förbränning något bättre än luft och används ilustgassystemför att höja effekten hos förbränningsmotorer och som oxidator i raketmotorer, till exempel iSpaceShipOne.
Gasen bildas även i katalytisk avgasrening.
Förpackningar
[redigera|redigera wikitext]Lustgas används somförpackningsgasilivsmedeloch harE-nummerE 942. Lustgas finns även som drivmedel till exempel i patroner tillgräddsifoner.Fördelen jämfört med luft är att lustgas inte orsakarhärskningav fetter i matvarorna, som därigenom håller sig fräscha längre.
Miljöeffekter
[redigera|redigera wikitext]Lustgas räknas tillväxthusgaserna.Ett kg lustgas bidrar, enligtIPCC:sjämförelsemått för växthusgaser (GWP), under en 20-årsperiod lika mycket tillväxthuseffektensom 289 kgkoldioxid.Andelen lustgas i atmosfären var 2015 cirka 328ppbatt jämföra med det förindustriella värdet cirka 280 ppb.[4]Även om andelen lustgas i atmosfären alltså är mindre än en tusendel av andelen koldioxid gör dess kraftigare verkan att lustgasens bidrag till växthuseffekten är en knapp tredjedel av koldioxidens.
Lustgas påverkar även ozonet istratosfärenpå så sätt att N2OfotolyserastillkväveoxidNO som bryter ned ozonmolekylerna O3till syrgas O2och kvävedioxid NO2.Idag är dikväveoxid den största källan av ozonpåverkande gaser.
I dag finns det anläggningar för sjukhus att destruera lustgas. Lustgasen i utandningsluften samlas in. Den uppsamlade lustgasen skickas till en destruktionsapparat där den omvandlas till kvävgas och syrgas, innan den skickas ut i atmosfären
Lokala förbud
[redigera|redigera wikitext]Från 1 juli 2024 blirStaffanstorp kommunförst iSkånemed (tio) lustgasfria zoner.[5]ÄvenEskilstuna kommunplanerar något liknande från 1 januari 2026.[6]
Se även
[redigera|redigera wikitext]Referenser
[redigera|redigera wikitext]- ^”Tullverket stoppar farlig lustgas. TT, läst 22 februari 2023.”.https://via.tt.se/pressmeddelande/farlig-lustgas-stoppas-av-tullverket?publisherId=3235930&releaseId=3337333.
- ^”Lustgas”.Nationalencyklopedin.Höganäs: Bokförlaget Bra Böcker AB. 2000.ISBN 91-7133-749-0
- ^Wekim, Roffe; Lindeman, Erik; Grass, Johanna Nordmark; Arhammar, Jenny Bång (2023).”Lustgasbruk gav pseudodemens”.Läkartidningen(Sveriges läkarförbund) 120 (45): sid. 1302.https://lakartidningen.se/klinik-och-vetenskap-1/artiklar-1/fallbeskrivning/2023/11/lustgasbruk-gav-pseudodemens/.Läst 23 november 2023.
- ^”Climate Change Indicators: Atmospheric Concentrations of Greenhouse Gases”.US Environmental Protection Agency.Augusti 2016.https:// epa.gov/climate-indicators/climate-change-indicators-atmospheric-concentrations-greenhouse-gases.Läst 7 juni 2019.
- ^”Staffanstorp först i Skåne med lustgasfria zoner”.Sydsvenskan.21 maj 2024.https:// sydsvenskan.se/2024-05-21/staffanstorp-forst-i-skane-med-lustgasfria-zoner/.Läst 22 maj 2024.
- ^Ledare: (13 maj 2024).”LEDARE: Minskar ett förbud lustgasanvändandet i Eskilstuna?”.ekuriren.se.https://ekuriren.se/ledare/artikel/minskar-ett-forbud-lustgasanvandandet-i-eskilstuna/re6my3zl.Läst 22 maj 2024.
Externa länkar
[redigera|redigera wikitext] Wikimedia Commons har media som rörLustgas.
Wikimedia Commons har media som rörLustgas.- FASS om lustgas
- Stockholms läns landsting om lustgas vid förlossning

