Ytterbium
| Den här artikelnbehöver fler eller bättrekällhänvisningarför att kunnaverifieras.(2024-03) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kanifrågasättasoch tas bort utan att det behöver diskuteras pådiskussionssidan. |
| Ytterbium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  Emissionsspektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generella egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativ atommassa | 173,04u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Silvervit | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet | 6 570kg/m³(273 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | Fast | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 1 097K(824°C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 1 467 K (1 194 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolym | 24,84 × 10-6m³/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 7,66kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 128,9kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomära egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie | 175 (222)pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jonisationspotential | Första: 603,4 kJ/mol Andra: 1 174,8 kJ/mol Tredje: 2 417 kJ/mol Fjärde: 4 203 kJ/mol (Lista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | [Xe] 4f146s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
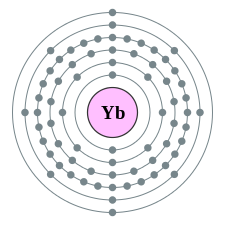
| e−per skal | 2, 8, 18, 32, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | 3,2 (svagbas) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,1 (Paulingskalan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 1 590m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk konduktivitet | 3,51·106A/(V×m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stabilaste isotoper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI-enheterochSTPanvänds om inget annat anges. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ytterbiumär ettmetallisktgrundämnesom tillhörlantanoidernaoch desällsynta jordartsmetallerna.Kemiska tecknetYbochatomnummer70Det har fått sitt namn efterYtterby gruvaiStockholms skärgård.Ämnet upptäcktes 1878 av schweizarenJean Charles Galissard de Marignac.[1]Det är ävenUpplandslandskapsämne.
År 1878 separerade den schweiziske kemisten Jean Charles Galissard de Marignac den sällsynta jordarten "erbium" (en annan oberoende komponent) som han kallade "ytterbium", efter Ytterby gruva nära vilken han fann den nya komponenten av erbium. Han misstänkte att ytterbia var en förening av ett nytt grundämne som han kallade "ytterbium" (totalt fick fyra grundämnen namn efter gruvan, de andra varyttrium,terbiumocherbium.År 1907 separerades den nya jorden "lutecia" från ytterbium, från vilken grundämnet "lutecium" (nulutetium) extraherades avGeorges Urbain,Carl Auer von WelsbachochCharles James.Efter viss diskussion behölls Marignacs namn "ytterbium". Ett relativt rent prov av metallen erhölls dock inte förrän 1953. För närvarande används ytterbium främst somdopningsmedelirostfritt ståleller aktiva lasermedier, och mer sällan somgammastrålkälla.
- Metallen utgör enbrand- och explosionsrisk.
Egenskaper
[redigera|redigera wikitext]Rent ytterbium är en grå, mjuk metall, som ej angrips av luft men reagerar långsamt med vatten. Den harsmältpunkt824 °C ochkokpunkt1 194 °C samt täthet 6,57 g/cm3.[1]
Ytterbium har treallotropersom betecknas med de grekiska bokstäverna alfa, beta och gamma. Deras omvandlingstemperaturer är -13 °C och 795 °C, vid normalt tryck.
Till skillnad från de andra sällsynta jordartsmetallerna, som vanligtvis harantiferromagnetiskaoch/ellerferromagnetiskaegenskaper vid låga temperaturer, är ytterbiumparamagnetisktvid temperaturer över 1,0 kelvin. I motsats till de flesta andra lantanoider, som har ett tätpackat hexagonalt gitter, kristalliserar ytterbium i kubiskt system. Ytterbium har en densitet på 6,973 g/cm³, vilket är betydligt lägre än för de närliggande lantanoiderna,tulium(9,32 g/cm³) och lutetium (9,841 g/cm³). Dess smält- och kokpunkt är också betydligt lägre än för tulium och lutetium. Detta beror på ytterbiums slutna elektronkonfiguration ([Xe] 4f146s2), som innebär att endast de två 6s-elektronerna är tillgängliga förmetallbindning(i motsats till de andra lantanoiderna där tre elektroner är tillgängliga) och ökar ytterbiums metalliska radie.
Förekomst
[redigera|redigera wikitext]Ytterbium förekommer mycket sparsamt ijordskorpan,oftast tillsammans medyttrium.Naturligt förekommer sju isotoper varav174Yb är den vanligaste (31,82 %).[1]Dessa isotoper, som tillsammans förekommer i koncentrationer på 0,3 miljondelar. Ytterbium bryts i Kina, USA, Brasilien och Indien i form av mineralernamonazit,euxenitochxenotim.Ytterbiumkoncentrationen är låg eftersom det bara finns bland många andra sällsynta jordartsmetaller; dessutom är det bland de minst rikliga. Efter utvinning och bearbetning är ytterbium något farligt som ögon- och hudirriterande.
Naturligt ytterbium består av sju stabilaisotoper:168Yb,170Yb,171Yb,172Yb,173Yb,174Yb och176Yb, där174Yb är den vanligaste, med 31,8% av den naturliga förekomsten. Trettiotvå radioisotoper har observerats, varav de mest stabila är169Yb med enhalveringstidpå 32,0 dagar,175Yb med en halveringstid på 4,18 dagar och166Yb med en halveringstid på 56,7 timmar. Alla övriga radioaktiva isotoper har halveringstider som är kortare än två timmar, och de flesta av dessa har halveringstider som är kortare än 20 minuter. Ytterbium har också 12metastabila tillstånd,där det mest stabila är169mYb (t1/246 sekunder).
Användning
[redigera|redigera wikitext]Isotopen169Yb (med en halveringstid på 32 dagar), som bildas tillsammans med den kortlivade isotopen175Yb (halveringstid 4,2 dagar) genomneutronaktiveringvid bestrålning av ytterbium ikärnreaktorer,har använts som strålkälla i bärbara röntgenapparater. Liksom röntgenstrålar passerar gammastrålarna från källan genom mjuka vävnader i kroppen, men blockeras av ben och andra täta material. Små169Yb-prover (som avger gammastrålning) fungerar därför som små röntgenapparater som är användbara för radiografi av små föremål. Experiment visar att röntgenbilder som tas med en169Yb-källa är ungefär likvärdiga med dem som tas med röntgenstrålar som har energier mellan 250 och 350 keV.169Yb används också inomnuklearmedicin.
Ett par experimentellaatomurbaserade på ytterbiumatomer vidNational Institute of Standards and Technology(NIST) har satt rekord i stabilitet. Fysiker från NIST rapporterade i Science Express den 22 augusti 2013 att ytterbiumklockornas tickningar är stabila inom mindre än två delar på 1 kvintiljon (1 följt av 18 nollor), vilket är ungefär 10 gånger bättre än de tidigare bästa publicerade resultaten för andra atomur. Klockorna skulle vara exakta inom en sekund under en period som är jämförbar med universums ålder.
Ytterbium kan också användas som dopningsmedel för att förbättra kornförfiningen, styrkan och andra mekaniska egenskaper hos rostfritt stål. Vissa ytterbiumlegeringar har sparsamt använts inom tandvården.
Yb3+-jonen används somdopningsmateriali aktiva lasermedier, särskilt i solid state-lasrar och dubbelmantlade fiberlasrar. Ytterbiumlasrar är mycket effektiva, har lång livslängd och kan generera korta pulser. Ytterbium kan också enkelt införlivas i det material som används för att tillverka lasern.
Ytterbiummetall ökar sin elektriska resistivitet när den utsätts för högdragspänning.Denna egenskap används i spänningsmätare för att övervaka markdeformationer från jordbävningar och explosioner.
Pyrolant – ersättning för magnesium i pyrotekniska laddningar med hög densitet för kinematiska infrarödalockfaklor.Eftersom ytterbium(III)oxid har en betydligt högreemissiviteti det infraröda området änmagnesiumoxid,erhålls en högre strålningsintensitet med ytterbiumbaserade nyttolaster jämfört med de som vanligtvis är baserade på magnesium/teflon/viton(MTV).
Källor
[redigera|redigera wikitext]- Den här artikeln är helt eller delvis baserad på material frånengelskspråkiga Wikipedia,Ytterbium,14 mars 2024.
Noter
[redigera|redigera wikitext]- ^ [abc]Bra Böckers lexikon,1981.
|
