Asidong amino
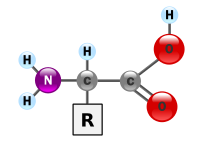
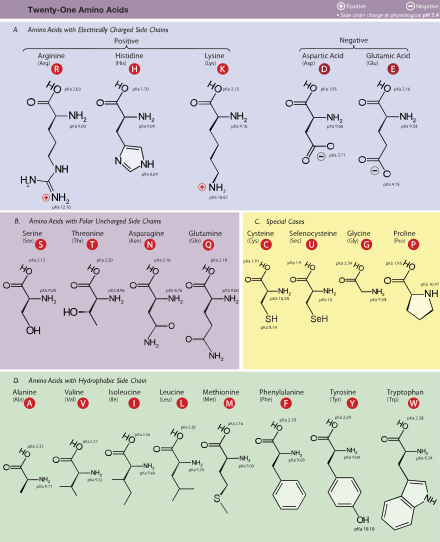
Ang mgaasidong amino[1]oamino acidang mgakompuwestong organikona mahalaga sabiyolohiyana gawa mula sa mgafunctional groupnaamine(-NH2) atcarboxylic acid(-COOH) kasama ng isangkadenang gilidna spesipiko sa bawat asidong amino. Ang mga mahahalagang elemento ng asidong amino angcarbon,hidroheno,oksiheno,atnitrohenobagaman ang ilang mga elemento ay matatagpuan sa mga kadenang gilid ng ilang mga asidong amino. Ang mga 500 asidong amino ay alam[2]at mauuri sa maraming mga paraan. Sa istruktura, sila ay mauuri ayon sa mga lokasyon ng mga functional group bilang mga asidong amino naalpha- (α-), beta- (β-), gamma- (γ-) or delta- (δ-).Ang ibang mga kategorya ay nauugnay sapolaridad na kimikal,lebel ngpHat uri ng pangkat na kadenang gilid (aliphatic,asikliko, aromatiko, naglalaman ng hydroxyl o sulfur, etc.) Sa anyo ng mga protina, ang mga asidong amino ay bumubuo pinakamalaking sangkap (pagkatapos ng tubig) ng mga muscle, mga selula at mga tisyu ng tao.[3]Ang mga asidong amino na nag-aangkin ng parehong mga pangkat na amine at asidong carboxylic na nakakabit sa atomonguna (alpha-) carbonay may partikular na kahalagahan sabiyokimika.Ang mga ito ay kilala bilang2-, alpha-,oα-amino acid(henerikong pormula H2NCHRCOOH in most cases[4]kung saan ang R ay isang organikongsubstituentna kilala bilang "side-chain");[5].Kadalasan, ang katagang "asidong amino" ay ginagamit upang spesipikong tumukoy sa mga ito. Ito ay kinabibilangan ng mga 23proteinogenic( "nagtatayo ng protina" ) asidong amino na naghahalo tungo sa mga kadenangpeptide( "polypeptides" ) upang bumuo ng mga pantayong bloke ng isang malaking bilang ng mga protina.[6]Ang lahat ng ito ay mga L-stereoisomer( "kaliwang panig"na mgaisomer) bagaman ang ilang mga D-amino acid ( "kanang panig" ) ay nangyayari sa mgaenvelope ng bakteryaat ilang mgaantibiyotiko.[7][8]Ang 20 sa 23 asidong amino na proteinogenic ay tuwirang kinokodigo ng mga tripletcodonsakodigong henetikoat kilala bilang mga pamantayang asidong amino. Ang ibang tatlo(na hindi pamantayan o hindi kanonikal) aypyrrolysine(na matatagpuan sa mga organismongmetanohenikoatibang mgaeukaryote),selenocysteine(na umiiral sa maraming mga hindi eukaryote gayundin sa karamihan ng mga eukaryote), atN-Formylmethionine.Halimbawa, ang 25 na protinang pantao ay kinabibilangan ng selenocysteine (Sec) sa kanilang pangunahing istruktura,[9]at ang mga inilalarawan sa istrukturang mga enzyme (selenoenzyme) ay gumagamit ng Sec bilang katalitikongmoietysa kanilang mga aktibong lugar.[10]Ang Pyrrolysine at selenocysteine ay kinokodigo sa pamamagitan ng mga bersiyong codon. Halimbawa, ang selenocysteine ay kinokodigo ngstop codonatelementong SECIS.[11][12][13]Ang mga kombinasyong Codon–tRNAna hindi matatagpuan sa kalikasan ay maaari ring gamitin upangpalawakin ang kodigong henetikoat lumikha ng mga bagong protina na kilala bilang mgaalloproteinna nagsasama ng mga hindi- proteinogenic na mga asidong amino.[14][15][16]
Mga sanggunian
[baguhin|baguhin ang wikitext]- ↑"Tagalog Glossary: A"(PDF).Multilingual Glossary, Middle School Glossary, Science.Glencoe/McGraw-Hill.Nakuha noong2013-11-11.
{{cite web}}:CS1 maint: date auto-translated (link) - ↑Wagner, Ingrid; Musso, Hans (1983). "New Naturally Occurring Amino Acids".Angew. Chem. Int. Ed. Engl.22(22): 816–828.doi:10.1002/anie.198308161.
{{cite journal}}:Unknown parameter|month=ignored (tulong)CS1 maint: date auto-translated (link) - ↑Human nutrition in the developing world–United NationsFood and Agriculture Organization,ch.8
- ↑Prolineis an exception to this general formula. It lacks the NH2group because of thecyclizationof the side-chain and is known as animino acid;it falls under the category of special structured amino acids.
- ↑– INTRODUCING AMINO ACIDS
- ↑"The Structures of Life".National Institute of General Medical Sciences. Inarkibo mula saang orihinalnoong 7 Hunyo 2014.Nakuha noong20 Mayo2008.
{{cite web}}:CS1 maint: date auto-translated (link) - ↑"Biochemical pathways: an atlas of biochemistry and molecular biology" – Michal, p.5
- ↑"Biochemistry I: Amino Acids".Cliffsnotes.com.Nakuha noong9 Nobyembre2012.
{{cite web}}:CS1 maint: date auto-translated (link) - ↑Kryukov GV, Castellano S, Novoselov SV, Lobanov AV, Zehtab O, Guigo R, et al. Characterization of mammalian selenoproteomes. Science. 2003;300:1439–1443.
- ↑Gromer, S., Urig, S., Becker, K. (2004) The Thioredoxin System - From Science to Clinic. Medicinal Research Reviews. 24(1):40-89.
- ↑Modeling Electrostatic Contributions to Protein Folding and Binding[patay na link]– Tjong, p.1 footnote
- ↑Frontiers in Drug Design and Discoveryed. Atta-Ur-Rahman & others, p.299
- ↑Elzanowski A, Ostell J (7 Abril 2008)."The Genetic Codes".National Center for Biotechnology Information (NCBI).Nakuha noong10 Marso2010.
{{cite web}}:CS1 maint: date auto-translated (link) - ↑Xie J, Schultz PG (2005). "Adding amino acids to the genetic repertoire".Curr Opin Chem Biol.9(6): 548–54.doi:10.1016/j.cbpa.2005.10.011.PMID16260173.
{{cite journal}}:Unknown parameter|month=ignored (tulong)CS1 maint: date auto-translated (link) - ↑Wang Q, Parrish AR, Wang L (2009)."Expanding the genetic code for biological studies".Chem. Biol.16(3): 323–36.doi:10.1016/j.chembiol.2009.03.001.PMC2696486.PMID19318213.
{{cite journal}}:Unknown parameter|month=ignored (tulong)CS1 maint: date auto-translated (link) CS1 maint: multiple names: mga may-akda (link) - ↑Simon M (2005).Emergent computation: emphasizing bioinformatics.New York: AIP Press/Springer Science+Business Media. pp.105–106.ISBN0-387-22046-1.
{{cite book}}:CS1 maint: date auto-translated (link)
