Manganez


ManganveyaManganezkimyasal birelementtir.SimgesiMnveatom numarası25'tir.
Sert, kırılgan, gümüşi bir metaldir ve genellikle doğada minerallerde demirle birlikte bulunur.
Manganez ilk kez 1774'te manganez dioksit bileşiğinden karbonun indirgenmesi neticesinde elde edilmiştir.
Manganez, özellikle paslanmaz çeliklerde çok yönlü endüstriyelalaşımkullanımına sahip birgeçiş metalidir.Mukavemeti, işlenebilirliği ve aşınma direncini artırır. Çeliğin dayanımını geliştiren bir alaşım elementidir. Bu özelliği içinde bulunan karbon miktarına bağlıdır. Yüksek karbonlu çeliklerde manganın etkisi sertlik ve dayanımı artırır. Çelikteki aşınma ve paslanmanın önlenmesinde kullanılır.
Manganez oksit, oksitleyici madde olarak kullanılır. Kauçuk katkı maddesi olarak, cam yapımında, gübrelerde ve seramikte kullanılır. Manganez sülfat fungisit olarak kullanılabilir.
Manganez aynı zamanda makro besin metabolizmasında, kemik oluşumunda veserbest radikalsavunma sistemlerinde önemli temel bir insan beslenme elementidir. Düzinelerce protein ve enzimin kritik bileşenidir.[1]Çoğunlukla kemiklerde, aynı zamanda karaciğer, böbrekler ve beyinde de bulunur.[2]İnsan beyninde manganez, manganez metaloproteinlerine, özellikle deastrositlerdekiglutamin sentetazına bağlanır.
Laboratuvarda koyu menekşe tuzupotasyum permanganatformunda tanıdıktır. Bazıenzimlerinaktif bölgelerindemeydana gelir.[3]Özellikle ilgi çekici olan, bitkiler tarafından oksijen üretiminde oksijen geliştiren kompleks olan Mn-O kümesinin kullanılmasıdır. Manganez iyonları çok çeşitli enzimlerde ve fotosentetik bitkilerde yer alabilir. Yüksek seviyelerde manganez memelilerde zehirlenme etkisi yapar.
Periyodik tablonun7-B grubundadır. Elementler için kullanılan periyodik yapı A B olarak adlandırılmıştır.
Manganez adını Yunanistan'ın magnezya bölgesinden almıştır.
Endüstride oksitlenme aşamasına göre birçok farklı renk alabilen element renklendirici olarak da kullanılmaktadır.
Çinko karbon ve alkalinli pillerin üretiminde kullanılan önemli bir elementtir.
Özellikler
[değiştir|kaynağı değiştir]Fiziksel özellikler
[değiştir|kaynağı değiştir]Manganez demire benzeyen gümüşi gri birmetaldir.Sert ve çok kırılgandır, kaynaşması zordur, ancak oksitlenmesi kolaydır.[4]Manganez metali ve ortak iyonlarıparamanyetiktir.[5]Manganez havada yavaşça kararır ve çözünmüş oksijen içeren sudaki demir gibi oksitlenir ( "paslanır" ).
İzotoplar
[değiştir|kaynağı değiştir]Doğal olarak oluşan manganez,55Mn adlı kararlı birizotoptanoluşur.
Atom ağırlığı 46uile (46Mn) 72 u (72Mn) arasında değişen çeşitliradyoizotoplarizole edilmiş ve açıklanmıştır. En kararlı olanları 3,7 milyon yıllıkyarılanma ömrünesahip53Mn, 312,2 günlük yarılanma ömrüne sahip54Mn ve 5.591 günlük yarılanma ömrüne sahip52Mn'dir. Geriye kalan tümradyoaktifizotopların yarılanma ömürleri üç saatten kısa, çoğunluğu ise bir dakikadan azdır.
En bol bulunan kararlı izotop olan55Mn'den daha hafif olan izotoplardaki birincilbozunma modu,elektron yakalamadırve daha ağır izotoplardaki birincil bozunma modu,beta bozunmasıdır.[6]Manganezin ayrıca üçmeta durumuvardır.[6]
Manganez,süpernovapatlamasından kısa süre önce büyükyıldızlardasentezlendiği düşünülen demir element grubunun bir parçasıdır.[7]
53Mn, 3,7 milyon yıllık yarılanma ömrüyle53Cr'ye bozunur. Nispeten kısa yarılanma ömrü nedeniyle,53Mn nispeten nadirdir vekozmik ışınlarındemireçarpmasıyla üretilir.[8]Manganez izotop içerikleri tipik olarakkromizotop içerikleriyle birleştirilir ve izotop jeolojisi veradyometrik tarihlemedeuygulama alanı bulmuştur.
Mn-Cr izotop oranları,Güneş Sistemininerken tarihi için26Al ve107Pd'den elde edilen kanıtları güçlendirmektedir. Çeşitlimeteoritlerden53Cr/52Cr ve Mn/Cr oranlarındaki değişiklikler, başlangıçta53Mn/55Mn oranını akla getirir; bu da Mn-Cr izotopik bileşiminin, farklılaşmış gezegen cisimlerindeki53Mn'ninin situbozunmasından kaynaklanması gerektiğini gösterir. Dolayısıyla53Mn, Güneş Sisteminin birleşmesinden hemen öncekinükleosentetiksüreçlere ilişkin ek kanıtlar sağlar.[9][10][11][12]
Allotroplar
[değiştir|kaynağı değiştir] |
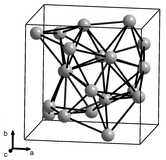 |
Katı manganezin art arda daha yüksek sıcaklıklarda oluşan α, β, γ ve δ olarak etiketlenmiş dörtallotropu(yapısal form) bilinmektedir. Hepsi metalik, standart basınçta kararlı ve kübik kristal kafese sahiptir, ancak atom yapıları bakımından çok farklıdırlar.[13][14][15]
Alfa manganez(α-Mn) oda sıcaklığında denge fazıdır.Vücut merkezli kübikbir kafese sahiptir ve dört farklı tipte hücre başına 58 atom (ilkel birim hücre başına 29 atom) içeren çok karmaşık bir birim hücreye sahip olması nedeniyle element metalleri arasında alışılmadık bir durumdur.[13][16]Oda sıcaklığındaparamanyetiktirve 95 K (-178 °C; -288,4 °F) altındaki sıcaklıklardaantiferromanyetiktir.[17]
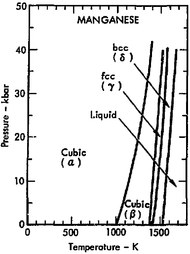 |
Beta manganez(β-Mn), 973 K (700 °C; 1292 °F) geçiş sıcaklığının üzerine ısıtıldığında oluşur. İki tip bölgede birim hücre başına 20 atomlu ilkel kübik yapılı olması diğer element metalleri kadar karmaşıktır.[18]Hızlı söndürme ile oda sıcaklığında kolayca yarı kararlı bir faz olarak elde edilir. Ölçülen en düşük sıcaklığa (1.1 K) kadar paramanyetik kalarakmanyetik sıralamagöstermez.[18][19][20]
Vücut metabolizmasına etkileri
[değiştir|kaynağı değiştir]Vücutta protein sentezlenmesinde, sindirimde ve besinlerden enerji üretilmesinde görev alan önemli minerallerin içinde bulunan etkili bir elementtir. Eksikliğinde sürekli yorgunluk, hafıza problemleri, kısırlık, kilo kaybı, özellikle çocuklarda ve bebeklerde büyüme geriliği gibi belirtiler görülür. Mangan bitkiler için de çok önemli bir elementtir ve günümüz modern tarım sektöründe vazgeçilmez bir gübre içeriğidir.
Uygulamalar
[değiştir|kaynağı değiştir]Manganez, metalurjideki ana uygulamalarında memnuin edici bir yerine geçen malzeme yoktur.[21]Küçük uygulamalarda (örneğin, manganez fosfatlama) iseçinkove bazen devanadyumuygun ikamelerdir.
Çelik
[değiştir|kaynağı değiştir]
Dövülebilirliğini geliştirmek için fazla çözünmüş oksijen, kükürt ve fosforu uzaklaştırmak için ilk olarak 1856'da çeliğe manganı Spiegeleisen şeklinde katan İngiliz metalurji uzmanı Robert Forester Mushet (1811-1891) tarafından tanınan Manganez, kükürtü sabitleme, oksitsizleştirme vealaşımlamaözellikleri nedeniyle demir ve çelik üretiminde gereklidir.
Çelik üretimi,[22]demir üretim bileşeni dahil, manganez talebinin çoğunu karşılar ki halen toplam talebin %85 ila %90'ı aralığındadır.[23]Manganez, az maliyetlipaslanmaz çeliğinönemli bir bileşenidir.[24][25]Çoğunlukla ferromanganez (genellikle yaklaşık %80 manganez) modern proseslerde ara maddedir.
Az miktarlarda manganez, yüksek sıcaklıkta eriyen sülfür oluşturarak ve tanecik sınırlarında sıvı demir sülfür oluşumunu önleyerek çeliğin yüksek sıcaklıkta işlenebilirliğini artırır. Manganez içeriği %4'e ulaşırsa, çeliğin gevrekleşmesi baskın özellik haline gelir. Gevreklik, daha yüksek mangan konsantrasyonlarında azalır ve %8'de kabul edilebilir bir düzeye ulaşır.
%8 ila %15 manganez içeren çeliğin 863 MPa'ya kadar yüksek çekme mukavemeti vardır.[26][27]%12 manganlı çelik 1882'de Robert Hadfield tarafından keşfedildi ve hala Hadfield çeliği (mangalloy) olarak bilinir. İngiliz ordusu içinçelik kasklarınyapımında ve daha sonra ABD ordusunca kullanıldı.[28]
Alüminyum alaşımları
[değiştir|kaynağı değiştir]Manganez için ikinci büyük uygulama alüminyum alaşımlarındadır. Kabaca %1.5 manganlı alüminyum, galvanik korozyona yol açabilecek yabancı maddeleri emen tanecikler yoluyla korozyona karşı direnci artırmıştır.[29]Korozyona dayanıklıalüminyum alaşımları3004 ve 3104 (%0.8 ila 1.5 manganez) çoğuiçecek kutularıiçin kullanılır.[30]2000'den önce, bu alaşımların 1.6 milyondanton'undan fazlası kullanıldı; %1 manganezde bu miktar 16,000 ton manganez 'e karşılık gelir.[30]
| Elementveyaperiyodik tabloile ilgili bu maddetaslakseviyesindedir. Madde içeriğinigenişleterekVikipedi'ye katkı sağlayabilirsiniz. |
Kaynakça
[değiştir|kaynağı değiştir]- ^Kaynak hatası:Geçersiz
<ref>etiketi;Erikson-2019isimli refler için metin sağlanmadı (Bkz:Kaynak gösterme) - ^Kaynak hatası:Geçersiz
<ref>etiketi;Emsley2001isimli refler için metin sağlanmadı (Bkz:Kaynak gösterme) - ^Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). "Manganese Homeostasis and Transport". Banci, Lucia (Ed.).Metallomics and the Cell.Metal Ions in Life Sciences.12.Springer. ss. 169-201.doi:10.1007/978-94-007-5561-1_6.ISBN978-94-007-5560-4.PMC6542352 $2.PMID23595673.Electronic-book978-94-007-5561-1.
- ^Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan".Lehrbuch der Anorganischen Chemie(Almanca) (91–100 bas.). Walter de Gruyter. ss. 1110-1117.ISBN978-3-11-007511-3.
- ^Lide, David R. (2004).Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics.CRC press.ISBN978-0-8493-0485-9.17 Aralık 2019 tarihindekaynağındanarşivlendi.Erişim tarihi: 7 Eylül 2019.
- ^abNUBASE2016
- ^Clery, Daniel (4 Haziran 2020)."The galaxy's brightest explosions go nuclear with an unexpected trigger: pairs of dead stars".Science.8 Nisan 2023 tarihinde kaynağındanarşivlendi.Erişim tarihi:26 Temmuz2021.
- ^Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). "Terrestrial manganese-53 – A new monitor of Earth surface processes".Earth and Planetary Science Letters.251(3–4): 334-345.Bibcode:2006E&PSL.251..334S.doi:10.1016/j.epsl.2006.09.016.
- ^Birck, J.; Rotaru, M.; Allègre, C. (1999). "53Mn-53Cr evolution of the early solar system".Geochimica et Cosmochimica Acta.63(23–24): 4111-4117.Bibcode:1999GeCoA..63.4111B.doi:10.1016/S0016-7037(99)00312-9.
- ^Lugmair, G.; Shukolyukov, A. (1998)."Early solar system timescales according to 53Mn-53Cr systematics".Geochimica et Cosmochimica Acta.62(16): 2863-2886.Bibcode:1998GeCoA..62.2863L.doi:10.1016/S0016-7037(98)00189-6.
- ^Shukolyukov, Alexander; Lugmair, Günter W. (2000). "On The 53Mn Heterogeneity In The Early Solar System".Space Science Reviews.92:225-236.Bibcode:2000SSRv...92..225S.doi:10.1023/A:1005243228503.
- ^Trinquier, A.; Birck, J.; Allègre, C.; Göpel, C.; Ulfbeck, D. (2008). "53Mn–53Cr systematics of the early Solar System revisited".Geochimica et Cosmochimica Acta.72(20): 5146-5163.Bibcode:2008GeCoA..72.5146T.doi:10.1016/j.gca.2008.03.023.
- ^abcYoung, D.A. (1975)."Phase diagrams of the elements".International Nuclear Information System.LNL: 15.Erişim tarihi:30 Ocak2023.
- ^Dhananjayan, N.; Banerjee, T. (1969).Crystallographic modifications of manganese and their transformation characteristics.Chapter 1 of:Structure of Electro-Deposited Manganese.CSIR-NML. ss. 3-28. 9 Temmuz 2023 tarihinde kaynağındanarşivlendi.Erişim tarihi:8 Nisan2024.
- ^Kemmitt, R. D. W.; Peacock, R. D. (1973).The Chemistry of Manganese, Technetium and Rhenium. Pergamon Texts in Inorganic Chemistry.Saint Louis: Elsevier Science. s. 778.ISBN978-1-4831-3806-0.OCLC961064866.
- ^Bradley, A.J.; Thewlis, J. (1927). "The crystal structure of α-manganese".Proceedings of the Royal Society of London, Series A.115(771): 456-471.Bibcode:1927RSPSA.115..456B.doi:10.1098/rspa.1927.0103.ISSN0950-1207.
- ^Lawson, A. C.; Larson, Allen C.; Aronson, M. C.; ve diğerleri. (1994). "Magnetic and crystallographic order in α-manganese".J. Appl. Phys.76(10): 7049-7051.Bibcode:1994JAP....76.7049L.doi:10.1063/1.358024.ISSN0021-8979.
- ^abPrior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). "Ferromagnetism in the beta-manganese structure: Fe1.5Pd0.5Mo3N ".Journal of Physics: Condensed Matter.16(13): 2273-2281.Bibcode:2004JPCM...16.2273P.doi:10.1088/0953-8984/16/13/008.ISSN0953-8984.
- ^Funahashi, S.; Kohara, T. (1984). "Neutron diffuse scattering in β-manganese".J. Appl. Phys.55(6): 2048-2050.Bibcode:1984JAP....55.2048F.doi:10.1063/1.333561.ISSN0021-8979.
- ^Duschanek, H.; Mohn, P.; Schwarz, K. (1989). "Antiferromagnetic and ferromagnetic gamma-manganese generalisation of the fixed-spin-moment method".Physica B: Condensed Matter.161(1–3): 139-142.doi:10.1016/0921-4526(89)90120-8.ISSN0921-4526.
- ^Kaynak hatası:Geçersiz
<ref>etiketi;USGSMCS2009isimli refler için metin sağlanmadı (Bkz:Kaynak gösterme) - ^Verhoeven, John D. (2007).Steel metallurgy for the non-metallurgist.Materials Park, Ohio: ASM International. ss.56-57.ISBN978-0-87170-858-8.
- ^Kaynak hatası:Geçersiz
<ref>etiketi;hydrometIisimli refler için metin sağlanmadı (Bkz:Kaynak gösterme) - ^Manganese USGS 2006
- ^Dastur, Y. N.; Leslie, W. C. (1981). "Mechanism of work hardening in Hadfield manganese steel".Metallurgical Transactions A.12(5): 749-759.Bibcode:1981MTA....12..749D.doi:10.1007/BF02648339.
- ^Stansbie, John Henry (2007).Iron and Steel.Read Books. ss. 351-352.ISBN978-1-4086-2616-0.20 Kasım 2021 tarihinde kaynağındanarşivlendi.Erişim tarihi:6 Haziran2022.
- ^Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002).Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors.New York, NY: McGraw-Hill. ss. 585-587.ISBN978-0-07-136076-0.22 Kasım 2021 tarihinde kaynağındanarşivlendi.Erişim tarihi:6 Haziran2022.
- ^Tweedale, Geoffrey (1985). "Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale".Notes and Records of the Royal Society of London.40(1): 63-74.doi:10.1098/rsnr.1985.0004
 .JSTOR531536.
.JSTOR531536.
- ^"Chemical properties of 2024 aluminum allow".Metal Suppliers Online, LLC. 28 Haziran 2002 tarihindekaynağındanarşivlendi.Erişim tarihi:30 Nisan2009.
- ^abKaufman, John Gilbert (2000)."Applications for Aluminium Alloys and Tempers".Introduction to aluminum alloys and tempers.ASM International. ss. 93-94.ISBN978-0-87170-689-8.

