Carbon
| Carbon,6C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ vạchcủa carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên,ký hiệu | Carbon, C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Có hai màu tùy vào cấu trúc phân tử là trong suốt (kim cương) và đen (than chì) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Carbon trongbảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử(Z) | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn(Ar) | 12,0107(8) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | phi kim | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm,phân lớp | 14,p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | 1s22s22p2or [He] 2s22p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2,4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Trong suốt hoặc đen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ thăng hoa | 3915 K (3642 °C, 6588 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | Vô định hình:[1]1.8–2.1g·cm−3(ở 0 °C, 101.325kPa) Than chì: 2,267 g·cm−3 Kim cương: 3,515 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm ba | 4600 K, 10800[2][3]kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 117 (than chì)kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 8,517(than chì), 6,155(kim cương) J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 4,3[4],2,1[5],0,-1,-2,-3,-4[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 2,55 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 1086,5 kJ·mol−1 Thứ hai: 2352,6 kJ·mol−1 Thứ ba: 4620,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 77(sp³), 73(sp²), 69(sp)pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 170 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | que mỏng: 18350 (kim cương) m·s−1(ở 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 0,8 (kim cương)[7]µm·m−1·K−1(ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 119-165 (than chì) 900-2300 (kim cương) W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Nghịch từ[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 1050 (kim cương)[7]GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 478 (kim cương)[7]GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 442 (kim cương)[7]GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hệ số Poisson | 0,1 (kim cương)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 1-2 (than chì) 10 (kim cương) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-44-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính:Đồng vị của Carbon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CarbonhayCacbon(bắt nguồn từtiếng Phápcarbone(/kaʁbɔn/)),[9]lànguyên tố hóa họctrongbảng tuần hoàncó ký hiệu làCvàsố nguyên tửbằng 6,nguyên tử khốibằng 12. Là một nguyên tốphi kimcó hóa trị 4 phổ biến, carbon có nhiều dạng thù hình khác nhau, phổ biến nhất là 4 dạng thù hình gồmcarbon vô định hình,graphit,kim cươngvàQ-carbon.
Các sợi carbon là tương tự như carbon thủy tinh. Dưới các xử lý đặc biệt (kéo giãn các sợi hữu cơ và carbon hóa) nó có khả năng sắp xếp các mặt tinh thể carbon theo hướng của sợi. Vuông góc với trục của sợi không có các mặt tinh thể carbon. Kết quả là các sợi có độ bền đặc biệt cao hơn cả thép.
Carbon tồn tại đa số trong mọisự sốnghữu cơ và nó là nền tảng củahóa hữu cơ.Phi kim này còn có thuộc tính hóa học đáng chú ý là có khả năng tự liên kết với nó và liên kết với một loạt các nguyên tố khác, tạo ra gần 10 triệu hợp chất đã biết. Khi liên kết vớioxynó tạo racarbon dioxidelà rất thiết yếu đối với sự sinh trưởng củathực vật.Khi liên kết vớihydro,nó tạo ra một loạt các hợp chất gọi là cáchydrocarbonlà rất quan trọng đối với công nghiệp trong dạng của cácnhiên liệu hóa thạch.Khi liên kết với cả oxy và hydro nó có thể tạo ra rất nhiều nhóm các hợp chất bao gồm cácacid béo,là cần thiết cho sự sống, vàester,tạo ra hương vị của nhiều loại hoa quả.
Đồng vịcarbon-14được sử dụng trong xác định tuổi tuyệt đối cho các mẫu vật nguồn gốcsinh vậttheo phương phápđịnh tuổi bằng đồng vị carbon,được ứng dụng trongkhảo cổ họcvà nghiên cứuđịa chấtkỷ Đệ Tứ.
Các thuộc tính đặc trưng
[sửa|sửa mã nguồn]
Carbon là nguyên tố đáng chú ý vì nhiều lý do.Các dạng khác nhaucủa nó bao gồm một trong những chất mềm nhất (graphit) và hai trong những chất cứng nhất (graphenvàkim cương,hayfullerene-hợp chất rất cứng có thể nói là cứng nhất của carbon và các hợp chất khác) cũng như làchất bán dẫntốt nhất, hơn cảsilic.Ngoài ra, nó có ái lực lớn để tạo raliên kếtvới cácnguyên tửnhỏ khác, bao gồm cả các nguyên tử carbon khác, và kích thước nhỏ của nó làm cho nó có khả năng tạo ra liên kết phức tạp. Vì các thuộc tính này, carbon được biết đến như là nguyên tố có thể tạo ra cỡ 10 triệu loại hợp chất khác nhau, chiếm phần lớn trong cáchợp chất hóa học.[10]Các hợp chất của carbon tạo ra nền tảng cho mọi loại hình sự sống trênTrái Đấtvàchu trình carbon-nitơdự trữ và tái cung cấp một số năng lượng được sản sinh từMặt Trờivà cácngôi sao.
Carbon cũng có điểm thăng hoa cao nhất trong tất cả các nguyên tố. Trong điều kiệnáp suất khí quyểnnó không có điểm nóng chảy vìđiểm ba trạng tháicủa nó ở tại 10,8 ± 0,2 MPa và 4.600 ± 300 K (~4.330 °C hay 7.820 °F), do đó nhiệt độ thăng hoa của nó trong trường hợp này vào khoảng 3.900 K.[11][12]
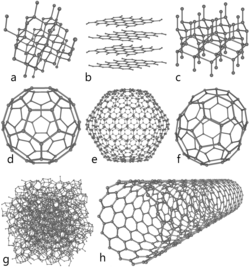
Các thù hình
[sửa|sửa mã nguồn]Các thù hình của carbon là khác nhau về cấu trúc mạng nguyên tử mà các nguyên tử tinh khiết có thể tạo ra. Ba dạng được biết nhiều nhất làcarbon vô định hình,graphitvàkim cương.Một số thù hình kỳ dị khác cũng đã được tạo ra hay phát hiện ra, bao gồm cácfullerene,carbon ống nano,lonsdaleitvàq-carbon.Muội đèn bao gồm các bề mặt dạng graphit nhỏ. Các bề mặt này phân bổ ngẫu nhiên, vì thế cấu trúc tổng thể là đẳng hướng.Carbon thủy tinhlà đẳng hướng và có tỷ lệ độ xốp cao. Không giống như graphit thông thường, các lớp graphit không xếp lên nhau giống như các trang sách, mà chúng có sự sắp xếp ngẫu nhiên.
Ở dạng vô định hình, carbon chủ yếu có cấu trúc tinh thể củagraphitnhưng không liên kết lại trong dạng tinh thể lớn. Trái lại, chúng chủ yếu nằm ở dạng bột và là thành phần chính củathan,muội,bồ hóng,nhọ nồivàthan hoạt tính.
Ở áp suất bình thường carbon có dạng củagraphit,trong đó mỗi nguyên tử liên kết với 3 nguyên tử khác trong mặt phẳng tạo ra các vònglục giác,giống như các vòng trong cáchydrocarbon thơm.Có hai dạng của graphit đã biết, là alpha (lục giác) và beta (rhombohedral), cả hai có các thuộc tính vật lý giống nhau, ngoại trừ về cấu trúc tinh thể. Các loại graphit có nguồn gốc tự nhiên có thể chứa tới 30% dạng beta, trong khi graphit tổng hợp chỉ có dạng alpha. Dạng alpha có thể chuyển thành dạng beta thông qua xử lý cơ học và dạng beta chuyển ngược thành dạng alpha khi bị nung nóng trên 1000 °C.
Vì sự phi tập trung hóa của cácđám mây pi,graphit có tínhdẫn điện.Vật liệu vì thế là mềm và các lớp, thường xuyên bị tách ra bởi các nguyên tử khác, được giữ cùng nhau chỉ bằng cáclực van der Waals,vì thế chúng dễ dàng trượt trên nhau.
Ở áp suất cực kỳ cao các nguyên tử carbon tạo thành thù hình gọi làkim cương,trong đó mỗi nguyên tử được liên kết với 4 nguyên tử khác. Kim cương có cấu trúc lập phương nhưsilicvàgermanivà vì độ bền của cácliên kếtcarbon-carbon, cùng với chấtđẳng điệnbor nitride(BN) là những chất cứng nhất trong việc chống lại sự mài mòn. Sự chuyển hóa thànhgraphitở nhiệt độ phòng là rất chậm và khong thể nhận thấy. Dưới các điều kiện khác, carbon kết tinh như làLonsdaleit,một dạng giống như kim cương nhưng có cấu trúc lục giác.
Các fulleren có cấu trúc giống như graphit, nhưng thay vì có cấu trúc lục giác thuần túy, chúng có thể chứa 5 (hay 7) nguyên tử carbon, nó uốn cong các lớp thành các dạng hình cầu, elip hay hình trụ. Các thuộc tính của các fulleren vẫn chưa được phân tích đầy đủ. Tất cả các tên gọi của các fulleren lấy theo tên gọi củaBuckminster Fuller,nhà phát triển củakiến trúc mái vòm,nó bắt chước cấu trúc của các "buckyball".
Sự phổ biến
[sửa|sửa mã nguồn]Carbon là nguyên tố phổ biến thứ 4 trong vũ trụ về khối lượng sau hydro, heli, và oxy. Carbon có rất nhiều trongMặt Trời,cácngôi sao,sao chổivà bầu khí quyển của phần lớn cáchành tinh.Một sốthiên thạchchứa các kim cương vi tinh thể, loại được hình thành khihệ Mặt Trờivẫn còn là mộtđĩa tiền hành tinh.Các kim cương vi tinh thể này có thể đã được tạo ra bằng áp lực rất mạnh và nhiệt độ cao tại những nơi mà thiên thạch đó va chạm.[13]
Có khoảng 10 triệu hợp chất khác nhau của carbon màkhoa họcđã biết và hàng nghìn trong số đó là tối quan trọng cho các quá trình của sự sống và cho các phản ứng trên cơ sở hữu cơ rất quan trọng về kinh tế. Trong tổ hợp với các nguyên tố khác, carbon được tìm thấy trong bầu khí quyển Trái Đất và hòa tan trong mọi thực thể có chứa nước. Với một lượng nhỏ hơn củacalci,magnesivàsắt,nó tạo ra thành phần chủ yếu của một lượng rất lớnđácarbonat(đá vôi,dolomit,đá cẩm thạchv.v.). Khi tổ hợp vớihydro,carbon tạo thànhthan,dầu mỏvàkhí tự nhiên,còn được gọi là cáchydrocarbon.
Graphit được tìm thấy với một số lượng lớn ở các bangNew YorkvàTexas(Mỹ);Nga;México;GreenlandvàẤn Độ.
Kim cương tự nhiên có trong khoáng chấtkimberlittìm thấy trong các "cổ" hay "ống" núi lửa cổ đại. Phần lớn các mỏ kim cương nằm ởchâu Phi,chủ yếu làNam Phi,Namibia,Botswana,Cộng hòa CongovàSierra Leone.Cũng có các mỏ ởArkansas,Canada,vùngBắc cựcnước Nga,Brasilvà ở miền bắc và tây nướcÚc.
Đồng vị
[sửa|sửa mã nguồn]Carbon có 2đồng vịổn định, có nguồn gốc tự nhiên:carbon-12,hay12C, (98,89%) vàcarbon-13,hay13C, (1,11%),[14]Năm1961,Liên đoàn Quốc tế về Hoá học Thuần túy và Ứng dụng(IUPAC) đã chấp nhận đồng vịcarbon-12làm cơ sở để đokhối lượng nguyên tử.[15]
Một đồng vị không ổn định, cũng có nguồn gốc tự nhiên làđồng vị phóng xạcarbon-14hay14C. Đồng vị14C phát sinh do sự tương tác củaneutron1n trongbức xạ vũ trụvớinitơ14N trong khí quyển. Nó đượcthực vậthấp thụ bằng quá trìnhquang hợpnhư với mọi đồng vị carbon khác, và lan truyền vào mọicơ thể sốngtheochuỗi thức ăn.Khi sinh vật chết chúng lắng đọng trong các tầng đất, đặc biệt trongthan bùnvà các vật liệu hữu cơ khác.[16]Đồng vị này phân rã bằng cách phát xạ hạtβ−có năng lượng 0,158 MeV. Dochu kỳ bán rãcó 5730 năm,14C hầu như không có mặt trong các đá cổ,[17]Sự phong phú của14C trongkhí quyểnvà trong cáccơ thể sốnglà một hằng số, nhưng chúng sẽ giảm sau khi sinh vật đó chết đi, và tỷ số đồng vị14C/12C nói lên quãng thời gian chết của chúng. Nguyên tắc này được sử dụng trong phương phápđịnh tuổi bằng đồng vị carboncho mẫu vật, đượcWillard Libbyphát minh năm 1949, và nay được sử dụng rộng rãi để xác định tuổi của các mẫu vật chứa carbon với giới hạn lên đến khoảng 60.000 năm[18][19]và được ứng dụng chủ yếu trongkhảo cổ học.
Tỷ số đồng vị13C/12C trongtrầm tíchcổ được sử dụng để nghiên cứucổ khí hậu(Paleoclimate). Nó dựa trên hiện tượng thực vật thực hiệnquang hợpvới12C dễ hơn. Do đó nhữngsinh vật phù duở biển nhưbenthicforaminiferakhi phát triển mạnh thì làm lệch tỷ số đồng vị. Nếu các tầng nướcđại dươngkhông bịđối lưupha trộn, thì sự lệch tỷ số này xảy ra trong thời gian dài, và dấu hiệu này được lưu giữ trong các tầngtrầm tíchbiển. (Lynch-Stieglitz et al., 1995)[20]
Tổng số đồng vị carbon là 15, từ8C đến22C, trong đó 12 đồng vị là nhân tạo. Đồng vị có tuổi ngắn nhất là8C, nó phân rã theobức xạ protonvàphân rã alpha,cóchu kỳ bán rãlà 1,98739x10−21s[21].Đồng vị kích thích19C thể hiện tính chất của một hạt nhân halo, tức là bán kính của nó có thể lớn hơn đáng kể so với bán kính dự đoán nếu hạt nhân nguyên tử là một khối hình cầu có tỷ trọng không đổi.[22]
Hình thành trong các ngôi sao
[sửa|sửa mã nguồn]Carbon đã không được tạo ra trongVụ Nổ Lớnvì thiếu các yếu tố cần thiết cho sự va chạm ba của các hạt alpha (hạt nhânheli) để sản xuất nó. Vũ trụ đầu tiên được mở rộng ra và bị làm nguội quá nhanh để điều này có thể xảy ra. Tuy nhiên, nó được sản xuất trong tâm của các ngôi sao trongnhánh ngang,ở đó các ngôi sao chuyển hóa nhânhelithành carbon bằng các cách thức củaquy trình ba-alpha.Nó cũng đã được tạo ra trong các trạng thái nguyên tử phức tạp.
Chu trình carbon
[sửa|sửa mã nguồn]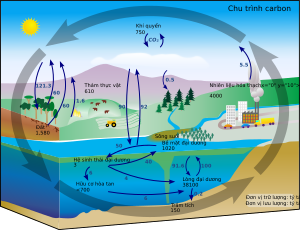
Trong các điều kiện trên Trái Đất, sự chuyển biến từ một nguyên tố này thành một nguyên tố khác là rất hiếm. Dù vậy, hàm lượng carbon trên Trái Đất là không đổi. Do đó, các quá trình sử dụng carbon phải tiêu thụ nó ở một nơi và thải ra ở một nơi khác. Những cách mà carbon di chuyển trong môi trường tạo thành một chu trình gọi làchu trình carbon.Một phần của sinh khối này được động vật tiêu thụ, trong khi một lượng carbon được động vật thải ra ở dạng carbon dioxide. Chu trình carbon được xem là phức tạp hơn vòng tuần hoàn ngắn này; ví dụ như carbon dioxide bị hòa tan trong các đại dương; thực vật chất hoặc xác động vật có thể hình thành nêndầu mỏhoặcthan,nếu đốt chúng sẽ thải ra carbon.[23][24]
Ứng dụng
[sửa|sửa mã nguồn]Carbon là các thành phần thiết yếu cho mọi sự sống đã biết, và không có nó thì sự sống mà chúng ta đã biết không thể tồn tại (XemSự sống phi carbon). Việc sử dụng kinh tế chủ yếu của carbon là trong dạng các hydrocarbon, chủ yếu là cácnhiên liệu hóa thạchnhưthan,khímethanvàdầu mỏ(xăngdầu). Dầu mỏ được sử dụng trongcông nghiệp hóa dầuđể sản xuất ra các sản phẩm nhưxăngvàdầu hỏa,thông qua các quy trìnhchưng cấttronglọc dầu.Dầu mỏ cũng là nguồn nguyên liệu cho nhiều chất hữu cơ tổng hợp khác, rất nhiều trong số chúng gọi chung là cácchất dẻo(plastic).
Các ứng dụng khác
[sửa|sửa mã nguồn]- Đồng vịCarbon-14được phát hiện vào ngày27 tháng 2năm1940và được sử dụng trongđịnh tuổi bằng đồng vị phóng xạ.
- Một số các thiết bị phát hiện sử dụng một lượng nhỏđồng vị phóng xạcủa carbon làm nguồnbức xạ ion hóa(Phần lớn các thiết bị như thế sử dụng đồng vị củaAmerici)
- Graphit kết hợp vớiđất sétđể tạo ra 'chì' sử dụng trong các loạibút chì.
- Kim cương được sử dụng vào mục đích trang sức hay trong các mũi khoan và các ứng dụng khác đòi hỏi độ cứng cao của nó.
- Carbon được thêm vào quặngsắtđể sản xuấtgangvàthép.
- Carbon dưới dạng than chì được sử dụng như là các thanhđiều tiết neutrontrong cáclò phản ứng hạt nhân.
- Graphit carbon trong dạng bột, bánh được sử dụng như là than đểđun nấu,bột màu trongmỹ thuậtvà các sử dụng khác.
- Than hoạt tính được sử dụng trong y tế trong dạng bột hay viên thuốc để hấp thụ các chất độc từ hệ thống tiêu hóa hay trong các thiết bị thở.
Các thuộc tính hóa học và cấu trúc của các fulleren, trong dạng cácống nano carbon,có ứng dụng đầy hứa hẹn trong các lĩnh vực mới phát sinh của công nghệ nano.
Lịch sử
[sửa|sửa mã nguồn]Ít ai nghĩ sợi carbon (Carbon fiber – CF) được sáng chế vào năm 1879 bởi Thomas Edison và được coi là loại sợi tổng hợp cổ nhất của loài người, lại có giá trị lớn lao đến thế đối với sự phát triển khoa học kỹ thuật hiện đại. Ban đầu, nhà phát minh này đã sử dụng sợi carbon làm dây tóc của bóng đèn. Mặc dù lúc đó sợi carbon không giống như sợi carbon ngày nay, nhưng chúng lại có sức chịu đựng đáng kể với nhiệt độ, điều này khiến cho sợi carbon trở thành ý tưởng không tồi cho các loại sợi dẫn điện.
Edison chế tạo sợi carbon dựa trên chấtcellulosegồm có cotton hoặc tre, hoàn toàn không giống như sợi carbon ngày nay làm từ dầu mỏ. Sự carbon hóa được tiến hành từ việc đốt cháy các sợi tre ở nhiệt độ cao trong môi trường tiêu chuẩn dưới sự kiểm soát chặt chẽ. Thomas Edison đã mất 40 giờ đốt cháy liên tục vật chất trên nhằm loại bỏ oxy, nitơ, hydro và chỉ giữ lại carbon để tạo ra những sợi carbon đầu tiên trên thế giới. Phương pháp chế tạo trên được gọi là "nhiệt phân" và vẫn được dùng trong thời đại ngày nay. Kết quả là những sợi tre được "carbon hóa" có khả năng chịu lửa và nhiệt độ cao – điều kiện cần thiết cho sự cháy sáng của dây tóc bóng đèn.
Về sau, đến tận những năm 1950 khả năng kéo giãn của sợi carbon mới được khám phá. Người đầu tiên được cho là tạo ra sợi carbon ngày nay có tên là Rayon. Ngày nay, sợi carbon hiện đại được sản xuất bởi một vật liệu có tên làpolyacrylonitrile(PAN), đây cũng là nguyên liệu được sử dụng để sản xuất hầu hết khối lượng sợi carbon hiện tại.
Sản xuất
[sửa|sửa mã nguồn]Than chì
[sửa|sửa mã nguồn]Các mỏ than chì tự nhiên có giá trị thương mại xuất hiện nhiều nơi trên thế giới, nhưng các nguồn quan trọng nhất có giá trị kinh tế tập trung ởTrung Quốc,Ấn Độ,BrazilvàTriều Tiên.Các mỏ than chì có nguồn gốcbiến chất,được tìm thấy cùng vớithạch anh,micavàfeldspartrong các đá phiến,gneissvà cát kết vàđá vôibị biến chất ở dạng thấu kính hoặc mạch, đôi khi có bề dày một mét hoặc lớn hơn. Các mỏ than chì ởBorrowdale,Cumberland,Anhđầu tiên có kích thước và độ tinh khiết (cho đến thế kỷ XIX) đủ để làm các câybút chìbằng cách đơn giản là cưa chúng thành các que và lấp vỏ gỗ vào. Ngày nay, các mỏ than chì nhỏ hơn được khai thác bằng cách nghiền đá gốc và dùng phương pháp tuyển nổi để lấy than chì nhẹ hơn nổi trên mặt.[25]
Có ba loại than chì tự nhiên gồm: vô định hình, than chì lớp, và mạch. Than chì vô định hình có chất lượng thấp và phổ biến nhất. Khác với khoa học, trong công nghiệp "vô định hình" ở đây đê cập đến kích thước tinh thể rất nhỏ thay vì không có một cấu trúc tinh thể rõ ràng. Dạng vô định hình được sử dụng cho các sản phẩm than chì có giá trị thấp và là than chì có giá thấp nhất. Một lượng lớn các mỏ than chì vô định hình được phát hiện ở Trung Quốc, châu Âu, Mexico và Hoa Kỳ.
Than chì Flake ít phổ biến hơn và có chất lượng cao hơn dạng vô định hình; nó có mặt ở dạng các tấm tách biệt được kết tinh trong đá biến chất. Than chì Flake có thể đắt gấp 4 lần dạng vô định hình. Flake chất lượng tốt có thể được xử lý thành than chì có thể giãn nở được dùng cho nhiều mục đích khác nhau nhưchất chống cháy.Các mỏ quan trọng nhất của dạng này được tìm thấy ở Áo, Brazil, Canada, Trung Quốc, Đức và Madagascar. Than chì dạng mạch là hiếm nhất, có giá trị nhất, và là loại than chì tự nhiên có chất lượng cao nhất. Nó xuất hiện ở các dạng mạch dọch theo các nơi tiếp xúc với đá xâm nhập, và loại thương mại được khai thác chỉ có tại Sri Lanka.[25]
TheoUSGS,sản lượng than chì tự nhiên trên thế giới là 1,1 triệu tấn năm 2010, trong đó Trung Quốc là 800.00 tấn, Ấn Độ 130.000 tấn, Brazil 76.000 tấn, Triều Tiên 30.000 tấn và Canada 25.000 tấn. Than chì không có nguồn gốc tự nhiên đã được khai thác ở Hoa Kỳ, nhưng 118.000 tấn than chì tổng hợp có giá trị khoảng 998 triệu USD đã được sản xuất năm 2009.[25]
Kim cương
[sửa|sửa mã nguồn]Các hợp chất
[sửa|sửa mã nguồn]Hợp chất vô cơ
[sửa|sửa mã nguồn]Các hợp chất chứa carbon phổ biến liên quan đến các khoáng vật hoặc không chứa hydro hoặc fluor được xem là một nhóm cáchợp chất vô cơriêng biệt; tuy nhiên định nghĩa này là không cứng nhắc. Oxide nổi tiếng nhất của carbon làcarbon dioxide,CO2.Nó là thành phần nhỏ củaKhí quyển Trái Đất[26],được sử dụng và sản sinh ra bởi các thực thể sống, và nó có mặt ở mọi nơi. Trongnướcnó tạo thành một lượng nhỏacid carbonic,H2CO3,nhưng giống như phần lớn các hợp chất với nhiều liên kết của các đơn nguyên tử oxy trên một nguyên tử carbon duy nhất là không bền.[27]Thông qua trung gian này, cácioncarbonatổn định hơn được tạo ra. Một số khoáng chất quan trọng là các carbonat, nổi tiếng nhất làcalcit.Carbon disulfide,CS2,là tương tự.
Các oxide khác làcarbon monoxide,CO và carbon suboxide không phổ biến lắm, C3O2.Carbon monoxide được tạo ra do sự cháy không hết, và nó là chất khí không màu, không mùi. Các phân tử đều có liên kết ba và làphân cựcthật sự, kết quả là chúng có xu hướng liên kết vĩnh cửu với các phân tửhemoglobin,vì thế khí này là một khí rất độc.[28][29]Cyanide,CN-,có cấu trúc tương tự và có các tính chất rất giống với các ionhalide;nitridecyanogen,(CN)2,là tương tự. Ví dụ, nó có thể tạo thành phân tửcyanogennitrit (CN)2), tương tự như halide 2 nguyên tử. Cá oxide không phổ biến khác nhưcarbon suboxide(C
3O
2),[30]dicarbon monoxidekhông bền (C2O),[31][32]carbon trioxide(CO3),[33][34]cyclopentanepenton(C5O5)[35]cyclohexanehexon(C6O6),[35]vàmellitic anhydride(C12O9).
Khi phản ứng với các kim loại nhưwolfram,carbon tạo thành cáccarbide(C4–), hoặcacetylide(C2−
2) từ đó tạo ra các hợp kim có nhiệt độ nóng chảy cao. các anion này cũng kết hợp vớimethanvàacetylen,cả hai đều là các acid rất yếu. Với độ âm điện 2,5,[36]carbon tạo nên các liên kết cộng hóa trị. Một vài carbide có các ô mạng cộng hóa trị, giống nhưCarborunđum(SiC), có cấu trúc tương tựkim cương.
Hợp chất với kim loại
[sửa|sửa mã nguồn]Với cáckim loạimạnh carbon tạo ra hoặc là các carbide, C-,hoặc các acetylide, C22-;các ion này có liên quan vớimethanvàacetylen,cả hai đều là cácacidrất yếu. Trên tất cả, với độ điện âm 2,55, carbon có xu hướng tạo ra các liên kếtcộng hóa trị.Một số carbide là các lưới cộng hóa trị, giống nhưcarborundum,SiC, là chất giống vớikim cương.
Mạch carbon
[sửa|sửa mã nguồn]Các hydrocarbon là một mạch của các nguyên tử carbon, được bão hòa bởi các nguyên tử hydro. Các loạixăng dầucó mạch carbon ngắn. Cácchất béocó mạch carbon dài hơn, và các loạisápcó mạch carbon cực dài.
Cảnh báo
[sửa|sửa mã nguồn]Carbon tương đối an toàn. Tuy nhiên, việc hít thở vào một lượng khói lớn chứa thuần túybồ hóngcó thể gây nguy hiểm. Carbon có thể bắt lửa ở nhiệt độ cao và cháy rất mãnh liệt (như trongvụ cháy Windscale).
Có nhiều hợp chất của carbon là những chất độc chết người như các (cyanide,CN-), haycarbon monoxide,CO và một số các chất có nguồn gốc tự nhiên hay tổng hợp khác.
Điều chế
[sửa|sửa mã nguồn]Cách để điều chế carbon là dùng kim loại mạnh là nhôm hoặc magnesi để khử một hợp chất oxide carbon bất kì thành carbon. Ví dụ:
- 2Al + 3CO → Al2O3+ 3C
- 2Mg + CO2→ 2MgO + C
Sau đó cho hỗn hợp vào một dung dịch acid (không có tính oxy hóa mạnh) như HCl, H2SO4loãng để hòa tan Al2O3hoặc MgO, còn lại carbon không tan, ta lọc carbon ra khỏi dung dịch.
Ngoài ra có thể điều chế carbon theo các phương trình sau nhưng hiệu suất không cao do khí hydro rất dễ bay lên:
- CO + H2↔ C + H2O (Nhiệt độ khoảng 1050 độ C)
- CO + 3H2→ CH4↑ + H2O (Chất xúc tác: Nickel, 250 độ C)
- CO2+ 4H2→ CH4↑ + 2H2O (Xúc tác, nhiệt độ cao, áp suất cao)
- CH4→ C + 2H2↑ (Nhiệt độ trên 1000 độ C)[cần dẫn nguồn]
Xem thêm
[sửa|sửa mã nguồn]Chú thích
[sửa|sửa mã nguồn]- ^Lide, D. R. biên tập (2005).CRC Handbook of Chemistry and Physics(ấn bản 86). Boca Raton (FL): CRC Press.ISBN0-8493-0486-5.
- ^Haaland, D (1976). “Graphite-liquid-vapor triple point pressure and the density of liquid carbon”.Carbon.14:357.doi:10.1016/0008-6223(76)90010-5.
- ^Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”.Carbon.43:1115.doi:10.1016/j.carbon.2004.12.027.
- ^“Fourier Transform Spectroscopy of the System of CP”(PDF).Truy cập ngày 6 tháng 12 năm 2007.
- ^“Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical”(PDF).Truy cập ngày 6 tháng 12 năm 2007.
- ^“Carbon: Binary compounds”.Truy cập ngày 6 tháng 12 năm 2007.
- ^abcdeProperties of diamond,Ioffe Institute Database
- ^Magnetic susceptibility of the elements and inorganic compounds,in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^Đặng Thái Minh, "Dictionnaire vietnamien - français. Les mots vietnamiens d’origine française",Synergies Pays riverains du Mékong,n° spécial, năm 2011. ISSN: 2107-6758. Trang 78.
- ^Chemistry Operations (ngày 15 tháng 12 năm 2003).“Carbon”.Los Alamos National Laboratory.Bản gốclưu trữ ngày 13 tháng 9 năm 2008.Truy cập ngày 9 tháng 10 năm 2008.
- ^Greenville Whittaker, A. (1978). “The controversial carbon solid−liquid−vapour triple point”.Nature.276(5689): 695–696.Bibcode:1978Natur.276..695W.doi:10.1038/276695a0.ISSN0028-0836.
- ^Zazula, J. M. (1997).“On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam”(PDF).CERN.Truy cập ngày 6 tháng 6 năm 2009.
- ^Mark, Kathleen (1987).Meteorite Craters.University of Arizona Press.ISBN0-8165-0902-6.
- ^“Carbon – Naturally occurring isotopes”.WebElements Periodic Table.Truy cập ngày 9 tháng 10 năm 2008.
- ^“Official SI Unit definitions”.Truy cập ngày 21 tháng 12 năm 2007.
- ^Brown, Tom (ngày 1 tháng 3 năm 2006).“Carbon Goes Full Circle in the Amazon”.Lawrence Livermore National Laboratory.Truy cập ngày 25 tháng 11 năm 2007.
- ^Bowman, S. (1990).Interpreting the past: Radiocarbon dating.British Museum Press.ISBN0-7141-2047-2.Đã định rõ hơn một tham số trong
|author=và|last=(trợ giúp) - ^Libby, W. F. (1952).Radiocarbon dating.Chicago University Press and references therein.
- ^Westgren, A. (1960).“The Nobel Prize in Chemistry 1960”.Nobel Foundation.Truy cập ngày 25 tháng 11 năm 2007.
- ^Lynch-Stieglitz et al. Past Ocean Dynamics[liên kết hỏng]
- ^“Use query for carbon-8”.barwinski.net.Truy cập ngày 21 tháng 12 năm 2007.
- ^Watson, A. (1999).“Beaming Into the Dark Corners of the Nuclear Kitchen”.Science.286(5437): 28–31.doi:10.1126/science.286.5437.28.
- ^Falkowski, P.; Scholes, RJ; Boyle, E; Canadell, J; Canfield, D; Elser, J; Gruber, N; Hibbard, K; Högberg, P (2000). “The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System”.Science.290(5490): 291–296.Bibcode:2000Sci...290..291F.doi:10.1126/science.290.5490.291.PMID11030643.
- ^Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (1993).“The global terrestrial carbon cycle”.Water, Air, & Soil Pollution.70:19–37.doi:10.1007/BF01104986.
- ^abcUSGS Minerals Yearbook: Graphite, 2009and Graphite: Mineral Commodity Summaries 2011
- ^Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). “The prebiological paleoatmosphere: stability and composition”.Origins of Life and Evolution of Biospheres.12(3): 245–259.Bibcode:1982OrLi...12..245L.doi:10.1007/BF00926894.
- ^Loerting, T.; và đồng nghiệp (2001). “On the Surprising Kinetic Stability of Carbonic Acid”.Angew. Chem. Int. Ed.39(5): 891–895.doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E.PMID10760883.
- ^Haldane J. (1895).“The action of carbonic oxide on man”.Journal of Physiology.18(5–6): 430–462.PMC1514663.PMID16992272.
- ^Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (2003). “The clinical toxicology of carbon monoxide”.Toxicology.187(1): 25–38.doi:10.1016/S0300-483X(03)00005-2.PMID12679050.
- ^“Compounds of carbon: carbon suboxide”.Truy cập ngày 3 tháng 12 năm 2007.
- ^Bayes, K. (1961). “Photolysis of Carbon Suboxide”.Journal of the American Chemical Society.83(17): 3712–3713.doi:10.1021/ja01478a033.
- ^Anderson D. J.; Rosenfeld, R. N. (1991). “Photodissociation of Carbon Suboxide”.Journal of Chemical Physics.94(12): 7852–7867.Bibcode:1991JChPh..94.7857A.doi:10.1063/1.460121.
- ^Sabin, J. R.; Kim, H. (1971). “A theoretical study of the structure and properties of carbon trioxide”.Chemical Physics Letters.11(5): 593–597.Bibcode:1971CPL....11..593S.doi:10.1016/0009-2614(71)87010-0.
- ^Moll N. G., Clutter D. R., Thompson W. E. (1966). “Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2”.Journal of Chemical Physics.45(12): 4469–4481.Bibcode:1966JChPh..45.4469M.doi:10.1063/1.1727526.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^abFatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. (1963).“Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)”(PDF).Journal of Research of the National Bureau of Standards A: Physics and Chemistry.67A(2): 153–162.doi:10.6028/jres.067A.015.
- ^Pauling, L. (1960).The Nature of the Chemical Bond(ấn bản 3). Ithaca, NY: Cornell University Press. tr.93.ISBN0-8014-0333-2.
Liên kết ngoài
[sửa|sửa mã nguồn]| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải vềCarbon. |
Bản mẫu:Hợp chất của carbon với các nguyên tố khác trong bảng tuần hoàn Bản mẫu:Hợp chất vô cơ của carbon
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |