Ether
- Bài này nói vềethernhư là một lớp chung các hợp chất hữu cơ. Đối với các nghĩa khác, xem bàiête (định hướng)

Etherlà tên gọi chung cho một lớphợp chất hữu cơtrong đó có chứanhóm chứcether —nguyên tửoxyliên kết với hai (được thay thế) nhómalkyl.Một ví dụ điển hình làdung môivàthuốc gây têdiethyl ether(ethoxyethan, CH3-CH2-O-CH2-CH3).
Các cấu trúc tương tự
[sửa|sửa mã nguồn]
Không phải mọi hợp chất có công thức R-O-R' đều là các ether. Ether không nên nhầm lẫn với các lớp hợp chất hữu cơ sau có cùng một công thức cấu trúc tổng quát R-O-R'.
- Cáchợp chấtvòng thơmnhưfurantrong đó nguyên tử oxy là một phần của vòng thơm.
- Các hợp chất trong đó một trong số các nguyên tửcarbontiếp ngay sau nguyên tử oxy được liên kết với oxy,nitơhaylưu huỳnh:
Các ether bậc nhất, bậc hai, bậc ba
[sửa|sửa mã nguồn]Các thuật ngữ"ether bậc nhất","ether bậc hai"và"ether bậc ba"đôi khi được sử dụng và nó chỉ tới nguyên tử carbon ngay sau nguyên tử oxy của ether. Trongether bậc nhấtthì nguyên tử carbon này chỉ được nối với một nguyên tử carbon khác, như trongdiethyl etherCH3-CH2-O-CH2-CH3.Ví dụ vềether bậc hailàdiisopropyl ether(CH3)2CH-O-CH(CH3)2và ví dụ vềether bậc balàdi-tert-butyl ether(CH3)3C-O-C(CH3)3.
Các polyether
[sửa|sửa mã nguồn]Polyether là các hợp chất có nhiều hơn một nhóm ether. Trong khi thuật ngữ này nói chung để chỉ tới cácpolymernhưpolyethylen glycolvàpolypropylen glycol,các hợp chất thấp phân tử như các ether lon đôi khi cũng có thể được gọi như thế.
Tổng hợp
[sửa|sửa mã nguồn]- R-OH+ R-OH → R-O-R +H2O
- Phản ứng trực tiếp này cần các điều kiện mạnh (nhiệt và xúc tác acid) và thông thường không được áp dụng trong thực tế. Các điều kiện như thế có thể phá hủy các cấu trúc nhạy cảm của một sốnhóm chức.Tồn tại một số phương pháp nhẹ nhàng hơn để sản xuất ether.
- R-O-+R-X→ R-O-R +X-
- Phản ứng này gọi làtổng hợp ether Williamson.Nó bao gồm việc xử lýrượugốc với cácbasemạnh để tạo raanionalkoxide, tiếp theo là thêm một lượng vừa đủ hợp chất béo chứanhóm thếthích hợp (R-X). Các nhóm thế thích hợp (X) bao gồmiodide,bromidehaysulfonat.Phương pháp này chỉ cho kết quả tốt nhất đối với các nguyên tử carbon bậc nhất, do các nguyên tử carbon bậc hai sẽ tham gia phản ứng khử E2 khi tiếp xúc với các anion alkoxide gốc sử dụng trong phản ứng. Các ether gốc aryl có thể được điều chế theo phản ứngtổng hợp ether Ullmann.
- R2C=CR2+ R-OH → R2CH-C(-O-R)-R2(xúc tácacid)
Tính chất hoá học
[sửa|sửa mã nguồn]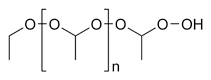
Ether là các hợp chất cóphản ứng hóa họcrất kém.Chúng chỉ bịthủy phântrong những điều kiện rất mạnh chẳng hạn đốt nóng vớiBF3hay đun sôi trongHBr.Các acid vô cơ chứa halôgen thấp phân tử khác, chẳng hạnHClcũng sẽ chia cắt các ether, nhưng rất chậm. Chỉ cóHBrvàHIlà có thể chia cắt chúng với tốc độ nhận thấy được.
Các ether có thể phản ứng như là cácbase Lewis.Ví dụ, diethyl ether tạo ra phức chất với các hợp chất củabor,chẳng hạn nhưbor trifluoridediethyl etherat F3B:O(CH2CH3)2.
Cácepoxide,hay các ether vòng trong các vòng ba thành viên, là rất dễ bị tổn thương trước các tấn công kiểu ái lực hạt nhân (nucleophil) và chúng phản ứng theo cách này.
Các ether bậc nhất và bậc hai với nhóm CH ngay sau nguyên tử oxy của ether dễ dàng tạo ra cácperoxide hữu cơcó khả nănggây nổcao (ví dụdiethyl ether peroxide) khi có mặt oxy, ánh sáng và kim loại cũng như các tạp chấtaldehyde). Vì lý do này các ether như diethyl ether vàTHFthông thường không nên sử dụng làmdung môitrong các quy trình công nghiệp.
Ether có thể được dùng làm nhiên liệu
R-O-R’ + O2-> CO2+ H2O
Điều này quan trọng vì các vùng/quốc gia có khí hậu lạnh như Alaska (Hoa Kỳ) hoặc Nga, Canada, hay các bang từ Washington đến Maine ( Hoa Kỳ) thường xuyên có nhiệt độ thấp trong mùa đông.
Ether có thể được khử thành hydrocarbon:
R – O – R’ + 2H2-> R-H + R’-H + H2O (to,p, xúc tác Mo-Ni hoặc Co-Mo trên nền γ-alumina)
Thuộc tính vật lý
[sửa|sửa mã nguồn]Các phân tử ether không thể tạo ra cácliên kết hydrovới nhau, vì thế kết quả là chúng cóđiểm sôitương đối thấp khi so sánh với cácalcoholtương tự. Các ether làkhông ưa nướchơn nhiều so với các ester hayamidevới cấu trúc tương tự.
Danh pháp
[sửa|sửa mã nguồn]Tên thông thường
[sửa|sửa mã nguồn]Tên thông thường của ether chính là tên gốc - chức, xác định bằng cách gọi tên hai nhóm thế liên kết với nguyên tửoxy.
Theo một số tài liệu, thứ tự gọi tên hai nhóm thế trong tên thông thường phụ thuộc vào sự đơn giản của nhóm. Nghĩa là nhóm thế đơn giản hơn sẽ đứng trước. Ví dụ: CH3-O-CH2-CH3là methyl ethyl ether.
Tuy nhiên, theo khuyến nghị củaIUPAC,thứ tự hai nhóm thế lại phụ thuộc vào bảng chữ cái. Khi đó, methyl ethyl ether sẽ trở thành ethyl methyl ether.
Một số ether có tên thông thường mà không phải tên gốc - chức, như diethyl ether gọi làether,methyl phenyl ether gọi làanisole,epoxyethan gọi làoxiran.
Danh pháp IUPAC
[sửa|sửa mã nguồn]Trong hệ thốngdanh pháp IUPAC,các ether được đặt tên theo nguyên tắc chung"alk-oxy-alkan",ví dụ CH3-CH2-O-CH3là methoxyethan. Nếu ether là một phần của các phân tử phức tạp hơn thì nó được miêu tả như là gốc thay thế alkoxy, vì thế -OCH3có thể coi như là nhóm"methoxy- ".
Các ether quan trọng
[sửa|sửa mã nguồn]- ethylen oxide(epoxide), là ether vòng nhỏ nhất:

- dimethyl ether,chất đẩy trong các bình xịt:

- Diethyl ether,một dung môi thông dụng có điểm sôi thấp:

- dimethoxyethan,dung môi có điểm sôi cao:

- dioxan,ether vòng có điểm sôi cao:

- THF,một ether vòng, một trong các ether phân cực đơn giản nhất được sử dụng làm dung môi:

- Anisol(methoxybenzen), thành phần chính củatinh dầuhồi:

- Cáccrown ether,các polyether vòng được sử dụng như là cácchất xúc tác chuyển pha:
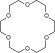
- Polyethylen glycol,polyether thẳng, được sử dụng trongmỹ phẩm:

Tham khảo
[sửa|sửa mã nguồn]Xem thêm
[sửa|sửa mã nguồn]- Nhóm chức
- Methoxy
- Xăng ether,không phải là ether mà là hỗn hợp các alkan có điểm sôi thấp.
- Thiôether,các hợp chất tương tự của ether trong đó nguyên tử oxy được thay thế bằng nguyên tử lưu huỳnh.
Liên kết ngoài
[sửa|sửa mã nguồn]- Ether (chemical compound)tạiEncyclopædia Britannica(tiếng Anh)
- Trang web của ILPIvề các ether.
