Acid formic
| Acid formic | |
|---|---|
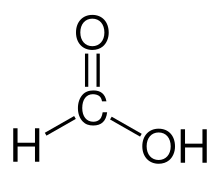 Cấu trúc của acid formic | |
| Tổng quan | |
| Danh pháp IUPAC | Acid methanoic |
| Tên khác | Acid hydro carboxylic Acid formylic Acid aminic Acid carbonơ |
| Công thức phân tử | CH2O2 HCOOH |
| Phân tử gam | 46,0254 g/mol |
| Biểu hiện | Chất lỏng không màu, dễ bốc khói |
| Số CAS | 64-18-6 |
| Thuộc tính | |
| Tỷ trọngvàpha | 1,22 g/mL, lỏng |
| Độ hòa tantrongnước | Trộn lẫn |
| Nhiệt độ nóng chảy | 8,4 °C (47,1 °F) |
| Điểm sôi | 100,8 °C (213,3 °F) |
| pKa | 3,744 |
| Độ nhớt | 1,57 cPở 26 °C |
| Khác | |
| MSDS | ScienceLab |
| Cácnguy hiểmchính | Ăn mòn; kích thích; gây mẫn cảm. |
| NFPA 704 | |
| Điểm bắt lửa | 69 °C (156 °F) |
| Rủi ro/An toàn | R10, 35, S1/2, 23, 26, 45 |
| SốRTECS | LQ4900000 |
| Các hợp chất liên quan | |
| Cáchợp chấttương tự | Acid acetic Acid propionic |
| Các hợp chất liên quan | Formaldehyde Methanol |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Acid formic(tên hệ thốngacid methanoic) là dạngacid carboxylicđơn giản nhất. Công thức của nó làHCOOH hoặc CH2O2.Nó là một sản phẩm trung gian trong tổng hợp hóa học và xuất hiện trong tự nhiên, phần lớn trong nọc độc củaongvà vòi đốt củakiến.
Trong tự nhiên, nó có trong các vòi đốt và nọc độc của nhiều loại côn trùng củabộ Cánh màng(Hymenoptera), chủ yếu là các loàikiến.Nó cũng là một sản phẩm đốt cháy đáng kể sinh ra từ các xe cộ dùng nhiên liệu thay thế đốtmethanol(vàethanol,nếu có nhiễmnước) khi trộn vớixăng.Tên gọi của nó có nguồn gốc từ một từ Latinh: con kiến,formica,do nó ban đầu người ta có thể tách nó dễ dàng từ việcchưng cấtcácxáckiến. Mộthợp chất hóa họcnhư mộtmuốitừ việctrung hòaacid formic với cácnhóm rượu bên hữu cơ,hoặc mộtesterthu được từ acid formic, được gọi làformiat(haymethanoat).Ionformiat có công thức HCOO−.
Đặc điểm
[sửa|sửa mã nguồn]
Đường màu xanh nét đứt thể hiện liên kết hydro
Acid formic là một chất lỏng không màu có mùi hăng, thâm nhập[1]ở nhiệt độ phòng, không giống nhưacid aceticcó liên quan. Acid formic hòa tan trong nước và các chất dung môi hữu cơ khác và hòa tan một ít trong cáchydrocarbon.Trong các Hydrocarbon và trong pha hơi, nó thực sự bao gồm các nhị trùngliên kết hydrohơn là các phân tử riêng rẽ.[2][3]Trong pha khí, mối liên kết hydro này tạo ra một kết quả có độ lệch lớn so vớiđịnh luật khí lý tưởng.Acid formic lỏng và rắn gồm có một mạng liên kết hydro vô hạn của các phân tử acid formic.
Hiện diện trong tự nhiên
[sửa|sửa mã nguồn]Trong tự nhiên, acid formic được tìm thấy ở hầu hết các loài kiến và trongong Dúcủa chiOxytrigona.Nó cũng được sử dụng như một chất kháng sinh trong thức ăn chăn nuôi.[4][5]kiến gỗtừ chiFormicacó thể phun acid formic lên con mồi hoặc để bảo vệ tổ. Nó cũng được tìm thấy trong cáctúm lôngcủatầm ma gốc lạ(Urtica dioica). Acid formic là thành phần tự nhiên củakhí quyểnchủ yếu do khí thải rừng.[6]
Tính chất hóa học
[sửa|sửa mã nguồn]Tính acid
[sửa|sửa mã nguồn]Acid formic là acid yếu. Tuy nhiên nó mạnh nhất trong dãy đồng đẳng củaacid carboxylicno, đơn chức, mạch hở và mạnh hơnacid carbonic(H2CO3) do hiệu ứng dồn mật độelectrontrong nhóm -COOH. Cụ thể:
- Dung dịch HCOOH làm quỳ tím chuyển màu đỏ nhạt.
- Tác dụng với kim loại mạnh:
- 2Na + 2HCOOH → 2HCOONa + H2
- Tác dụng với oxide base:
- CuO + 2HCOOH → (HCOO)2Cu + H2O
- Tác dụng với base
- NaOH + HCOOH → HCOONa + H2O
- Tác dụng với muối của acid yếu hơn:
- NaHCO3+ HCOOH → HCOONa + CO2+ H2O
Phản ứng ester hóa
[sửa|sửa mã nguồn]- HCOOH + CH3OH → HCOOCH3+ H2O.
Phản ứng này là phản ứng thuận nghịch được xúc tác nhờ acid sulfuric đặc và nhiệt độ.
Tính andehit
[sửa|sửa mã nguồn]- Phản ứng tráng gương
- HCOOH + 2Ag(NH3)2OH → (NH4)2CO3+ 2Ag↓+ 2NH3↑+ H2O
Sản xuất
[sửa|sửa mã nguồn]Một số lượng đáng kể acid formic được sản xuất như là một sản phẩm phụ của quá trình sản xuất các hóa chất khác, đặc biệt làacid acetic.Quá trình sản xuất này không đủ để đáp ứng yêu cầu hiện nay đối với acid formic, và một số lượng acid này phải được sản xuất cho mục đích riêng.
Khimethanolvàcarbon monoxideđược kết hợp với sự có mặt của mộtbasemạnh sẽ tạo ramethyl formiat,một dẫn xuất của acid formic, theophương trình hóa học
- CH3OH + CO → HCOOCH3
Trong công nghiệp, phản ứng này được thực hiện trong pha lỏng với áp suất cao. Các điều kiện phản ứng điển hình là nhiệt độ 80 °C dưới áp suất 40 atm. Sựthủy phâncủa methyl formiat tạo ra acid formic:
- HCOOCH3+ H2O → HCOOH + CH3OH
Để quá trình thủy phân trực tiếpmethyl formiatđạt hiệu quả đòi hỏi một số lượng nước dư, do đó một vài nhà sản xuất thực hiện quá trình này bằng cách gián tiếp là cho methyl formiat phản ứng vớiamoniađể tạo raformamide,và sau đó thủy phân formamide bằngacid sulfuricđể tạo ra acid formic:
- HCOOCH3+ NH3→ HCONH2+ CH3OH
- 2HCONH2+ 2H2O + H2SO4→ 2HCOOH + (NH4)2SO4
Kỹ thuật này có vấn đề, đặc biệt là việc thải ra sản phẩm phụamoni sulfatdo đó một số nhà sản xuất gần đây đã phát triển các cách hiệu quả về năng lượng bằng cách tách acid formic khỏi lượng nước dư thừa lớn được sử dụng trong quá trình thủy phân trực tiếp. Một trong những công nghệ này (đượcBASFsử dụng) đó là acid formic được lấy ra khỏi nước thông qua việcchiết chất lỏngvới một base hữu cơ.
Trong phòng thí nghiệm, acid formic có thể thu được bằng cách nung nóngacid oxalictrongglyxerolkhan và chiết bằng cách chưng hơi. Một cách điều chế khác (phải được thực hiện dưới một mũ trùm khói) là thủy phân acidethyl isonitrilsử dụng dung dịchHCl.[7]
- C2H5NC + 2H2O → C2H5NH2+ HCOOH
Tham khảo
[sửa|sửa mã nguồn]- ^“OSHA Occupational Chemical Database - Occupational Safethy and Health Administration”.osha.gov.Bản gốclưu trữ ngày 29 tháng 4 năm 2021.Truy cập ngày 15 tháng 8 năm 2019.
- ^Reutemann, Werner; Kieczka, Heinz (2000). “Formic Acid”.Ullmann's Encyclopedia of Industrial Chemistry.doi:10.1002/14356007.a12_013.ISBN978-3-527-30673-2.
- ^Roman M. Balabin (2009). “Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters”.The Journal of Physical Chemistry A.113(17): 4910–8.Bibcode:2009JPCA..113.4910B.doi:10.1021/jp9002643.PMID19344174.
- ^Hoffman, Donald R (2010). “Ant venoms”.Current Opinion in Allergy and Clinical Immunology.10(4): 342–6.doi:10.1097/ACI.0b013e328339f325.PMID20445444.
- ^Roubik, DW; Smith, BH; Carlson, RG (1987). “Formic acid in caustic cephalic secretions of stingless bee,Oxytrigona (Hymenoptera: Apidae)”.J Chem Ecol.13(5): 1079–86.doi:10.1007/BF01020539.PMID24302133.
- ^Sanhueza, Eugenio; Andreae, Meinrat O (1991). “Emission of formic and acetic acids from tropical Savanna soils”.Geophysical Research Letters.18(9): 1707–10.Bibcode:1991GeoRL..18.1707S.doi:10.1029/91GL01565.
- ^Cohen, Julius B.:Practical Organic ChemistryMacMillan 1930
