Oxy
| Oxy,8O | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Oxy lỏng sôi (O2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên,ký hiệu | Oxy, O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Khí: không màu, trong suốt (ở thểO 3,khí màu xanh) xanh nhạt ở thể lỏng, phát ánh sáng tím ở thểplasma Lỏng và rắn: xanh nhạt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxy trongbảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử(Z) | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn(Ar) | 15,99903[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | phi kim | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm,phân lớp | 16,p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [He] 2s22p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Trong suốt, không màuO 2(Xanh nhạtO 3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Thể khí | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | (O 2) 54.36K(-218,79 °C, -361,82 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | (O 2) 90,20 K (-182,95 °C, -297,31 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 1,429g·cm−3(ở 0 °C, 101.325kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 1,141 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm ba | 154,59 K, 5,043 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | (O2) 0,444kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | (O2) 6,82 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | (O2) 29,378 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 2,1,0,-1,-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 3,44 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 1313,9 kJ·mol−1 Thứ hai: 3388,3 kJ·mol−1 Thứ ba: 5300,5 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 66±2pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | (thểkhí,27°C) 330m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 26,58×10-3W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Thuận từ[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cảm từ(χmol) | +3449,0×10−6cm3/mol (293 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lịch sử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phát hiện | Michael Sendivogius Carl Wilhelm Scheele(1604, 1771) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đặt tên chính bởi | Antoine Lavoisier(1777) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính:Đồng vị của Oxy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oxy(tiếng Anh:oxygen/ˈɒksɪdʒən/;bắt nguồn từ từ tiếng Phápoxygène[ɔsiʒɛn][4]), haydưỡng khí,là mộtnguyên tố hóa họccóký hiệuOvàsố hiệu nguyên tử8. Nó là một thành viên củanhómchalcogentrongbảng tuần hoàn,mộtphi kimphản ứng mạnhvà là mộtchất oxy hóadễ tạooxidevới hầu hết các nguyên tố cũng như với cáchợp chấtkhác. Sauhydrovàheli,oxy lànguyên tố phong phúthứ ba trong vũ trụ tính theo khối lượng.
Oxy là nguyên tốphi kimhoạt động rất mạnh. Nó có thể tạo thành hợp chấtoxidevới hầu hết các nguyên tố khác.[5]Ở điều kiệnnhiệt độ và áp suất tiêu chuẩnhai nguyên tử oxy kết hợp với nhau tạo thành phân tử oxy không màu, không mùi, không vị có công thức làO
2.Khí oxy hóa lỏng ởnhiệt độ-183oC, màu xanh nhạt. Oxyphân tử(O2,thường được gọi là oxy tự do) trênTrái Đấtlà không ổn định về mặtnhiệt động lực học.Sự xuất hiện trong thời kỳ đầu tiên của nó trênTrái Đấtlà do các hoạt độngquang hợpcủavi khuẩnkỵ khí (vi khuẩn cổ vàvi khuẩn). Sự phổ biến của nó từ sau đó đến ngày nay là do hoạt độngquang hợpcủatảo biển.Oxy là nguyên tố phổ biến xếp hàng thứ 3 trongvũ trụtheo khối lượng sauhydrovàheli[6]và lànguyên tốphổ biến nhất theo khối lượng trongvỏ Trái Đất,[7]chiếm gần một nửavỏ Trái đấtở dạng oxide.[8]Khí oxy chiếm 20,9% vềthể tíchtrongkhông khí.[9]
Oxy phân tử cung cấp năng lượng được giải phóng trongquá trình đốt cháy[10]vàhô hấp tế bàohiếu khí,[11]và nhiều lớpphân tử hữu cơ chínhtrongcơ thể sốngchứa các nguyên tử oxy, chẳng hạn nhưprotein,acid nucleic,carbohydratevàchất béo,cũng như thành phần chínhvô cơ hợp chấtcủa vỏ, răng và xương động vật. Phần lớn khối lượng của các sinh vật sống là oxy như một thành phần củanước,thành phần chính của các dạng sống. Oxy liên tục được bổ sung trong bầu khí quyển của Trái đất bằngquá trình quang hợp,sử dụng năng lượng của ánh sáng mặt trời để tạo ra oxy từ nước và carbon dioxide. Oxy quá phản ứng hóa học để vẫn là một phần tử tự do trong không khí mà không được bổ sung liên tục bởi hoạt động quang hợp của các sinh vật sống. Một dạng khác (dạngallotrope) của oxy, ozon (O
3) hấp thụ mạnh mẽ bức xạ tia cực tímUVBvàtầng ozonở độ cao giúp bảo vệsinh quyểnkhỏibức xạ cực tím.Tuy nhiên,ozonhiện diện trên bề mặt là sản phẩm phụ củakhóivà do đó là chất ô nhiễm.[12]
Oxy đượcMichael Sendivogiusphân lập trước năm 1604, nhưng người ta thường tin rằngnguyên tốnày được phát hiện độc lập bởiCarl Wilhelm Scheele,ởUppsala,vào năm 1773 hoặc sớm hơn, vàJoseph PriestleyởWiltshire,vào năm 1774. Người ta thường ưu tiên cho Priestley vì tác phẩm của ông được xuất bản trước. Tuy nhiên, Priestley gọi oxy là "không khí khử khoáng chất" và không công nhận nó là một nguyên tố hóa học. Tên gọioxyđược đặt ra vào năm 1777 bởiAntoine Lavoisier,người đầu tiên công nhận oxy như một nguyên tố hóa học và mô tả chính xác vai trò của nó trong quá trình cháy.[13]
Các ứng dụng phổ biến của oxy bao gồm sản xuấtthép,nhựavàhàng dệt,hàn và cắtthép và cáckim loạikhác,đẩy tên lửa,liệu pháp oxyvàcác hệ thống hỗ trợ sự sốngtrongmáy bay,tàu ngầm,tàuvũ trụvàlặn dưới nước.
Lịch sử
Các thí nghiệm ban đầu
Một trong những thí nghiệm đầu tiên được biết về mối quan hệ giữađốt cháyvà không khí đã được thực hiện vào thế kỷ thứ 2 TCN. Tác giảngười Hy Lạpvề cơ học, Philo của Byzantium. Trong tác phẩmPneumaticacủa mình, Philo đã quan sát thấy rằng việc đảo một ống nghiệm qua một ngọn nến đang cháy và bao quanh cổ của ống bằng nước dẫn đến một số nước dâng lên.[14]Philo phỏng đoán không chính xác rằng các phần của không khí trong ống đã được chuyển thành nguyên tố cổ điển lửa và do đó có thể thoát ra qua các lỗ của ống thủy tinh. Nhiều thế kỷ sauLeonardo da Vinciđã phát triển dựa trên công trình củaPhilobằng cách quan sát rằng một phần không khí được tiêu thụ trong quá trình đốt cháy vàhô hấp.[15]
Vào cuối thế kỷ 17,Robert Boyleđã chứng minh rằng không khí là cần thiết cho quá trình đốt cháy. Nhà hóa học người AnhJohn Mayow(1641-1679) đã tinh chỉnh công trình này bằng cách chỉ ra rằng lửa chỉ cần một phần không khí mà ông gọi làSpiritus nitroaereus.Trong một thí nghiệm, ông đã phát hiện ra rằng việc đặt một con chuột hoặc một ngọn nến sáng trong một hộp kín trên mặt nước đã khiến nước dâng lên và thay thế một phần mười bốn thể tích không khí trước khi dập tắt lửa.[16]Từ đó, ông phỏng đoán rằng oxygen được tiêu thụ trong cả hai quá trình hô hấp và đốt cháy.
Mayow quan sát thấyantimonsẽ tăng trọng lượng khi được đun nóng và suy ra rằng nitroaereus phải kết hợp với nó. Ông cũng cho rằng phổi tách nitroaereus khỏi không khí và truyền nó vào máu và nhiệt trong động vật và chuyển động cơ bắp là do phản ứng của nitroaereus với một số chất trong cơ thể. Các ghi chép về những suy xét này và các thí nghiệm và ý tưởng khác đã được xuất bản năm 1668 trong tác phẩmTractatuscủa ông trong phần "Hô hấp".[16]
Lý thuyết phlogiston
Robert Hooke,Ole Borch,Mikhail LomonosovvàPierre Bayenđều tạo ra oxy trong các thí nghiệm vào thế kỷ 17 và 18 nhưng không ai trong số họ công nhận nó là mộtnguyên tố hóa học.[17]Điều này có thể một phần là do sự phổ biến của học thuyết về đốt cháy vàăn mònđược gọi làlý thuyết phlogiston,khi đó là lời giải thích được ưa chuộng của các quá trình trên.[18]
Được nhà giả kim người ĐứcJJ Becherthành lập vào năm 1667, và được nhà hóa họcGeorg Ernst Stahlsửa đổi vào năm 1731,[19]lý thuyết phlogiston tuyên bố rằng tất cả các vật liệu dễ cháy được làm từ hai phần. Một phần, được gọi là phlogiston, đã bị loại bỏ khi chất chứa nó bị đốt cháy, trong khi phần không bị loại bỏ được cho là dạng thật của nó, với tên khác làcalx.[15]
Các vật liệu dễ cháy mà để lại ít cặn, như gỗ hoặc than, được cho là được làm chủ yếu từ phlogiston; các chất không cháy mà có thể bị ăn mòn, như sắt, được cho là chứa rất ít phlogiston. Không khí không đóng một vai trò trong lý thuyết phlogiston, cũng không có bất kỳ thí nghiệm định lượng ban đầu nào được thực hiện để kiểm tra ý tưởng; thay vào đó, nó dựa trên các quan sát về những gì xảy ra khi một thứ gì đó cháy, rằng hầu hết các vật thể thông thường dường như trở nên nhẹ hơn và dường như mất đi thứ gì đó trong quá trình cháy.[15]
Khám phá

Nhàgiả kim,nhà triết họcvàbác sĩngười Ba LanMichael Sendivogius(Michał Sędziwój) trong tác phẩm của mìnhDe Lapide Philosophorum Tractatus duodecim e naturae fonte et Manuali experientia depromti(1604) đã mô tả một chất có trong không khí.[20]), và chất này giống hệt với oxy.[21]Sendivogius,trong các thí nghiệm được thực hiện từ năm 1598 đến 1604, đã nhận ra một cách đúng đắn rằng chất này tương đương với sản phẩm phụ dạng khí được giải phóng do sựphân hủy nhiệtcủakali nitrat.Theo quan điểm của Bugaj, sự cô lập oxy và sự liên kết thích hợp của chất này với phần không khí cần thiết cho sự sống, tạo ra đủ bằng chứng cho việc Sendivogius đã phát hiện ra oxy.[21]Tuy nhiên, phát hiện này của Sendivogius thường bị các thế hệ các nhà khoa học và nhà hóa học từ chối.[20]
Người ta cũng thường cho rằng oxy được phát hiện lần đầu tiên bởi dược sĩ Thụy ĐiểnCarl Wilhelm Scheele.Ông đã tạo ra khí oxy bằng cách đun nóngoxide thủy ngân(HgO) và cácnitratkhác nhau vào năm 1771–2.[15][22][23]Scheele gọi khí là "không khí lửa" vì khi đó nó làtác nhânduy nhất được biết đến để hỗ trợ quá trình đốt cháy. Ông đã viết một tường thuật về khám phá này trong một bản thảo có tựa đềLuận về không khí và lửa,mà ông đã gửi cho nhà xuất bản của mình vào năm 1775. Tài liệu đó được xuất bản năm 1777.[24]
Cùng lúc đó, vào ngày 1 tháng 8 năm 1774, một thí nghiệm do giáo sĩ người AnhJoseph Priestleytiến hành đã tập trung ánh sáng mặt trời vào oxide thủy ngân chứa trong một ống thủy tinh, nó giải phóng một loại khí mà ông đặt tên là "không khí khử chất độc".[23]Ông lưu ý rằng nến cháy sáng hơn trong khí và một con chuột hoạt động nhiều hơn và sống lâu hơn khihít thởnó. Sau khi tự mình hít thở khí, Priestley viết: "Cảm giác của nó đối với phổi của tôi không khác nhiều so vớikhông khí thông thường,nhưng tôi tưởng tượng rằng vú của tôi cảm thấy nhẹ và dễ dàng một cách kỳ lạ trong một thời gian sau đó. "[17]Priestley công bố những phát hiện của mình vào năm 1775 trong một bài báo có tiêu đề "Ghi chép về những khám phá sâu hơn trong không khí", nằm trong tập thứ hai của cuốn sách của ông có tựa đềThí nghiệm và quan sát về các loại không khí khác nhau.[15][25]Vì ông đã công bố những phát hiện của mình trước, nên Priestley thường được ưu tiên trong việc xác định ai khám phá ra oxy.
Nhà hóa học người PhápAntoine Laurent Lavoisiersau đó tuyên bố đã phát hiện ra chất mới một cách độc lập. Priestley đến thăm Lavoisier vào tháng 10 năm 1774 và nói với anh ta về thí nghiệm của mình và cách anh ta giải phóng khí mới. Scheele cũng đã gửi một bức thư cho Lavoisier vào ngày 30 tháng 9 năm 1774, trong đó mô tả việc ông đã khám phá ra chất trước đây chưa từng được biết đến, nhưng Lavoisier không bao giờ thừa nhận đã nhận nó. (Một bản sao của bức thư được tìm thấy trong đồ đạc của Scheele sau khi ông qua đời.)[24]
Đóng góp của Lavoisier

Lavoisierđã tiến hành các thí nghiệm định lượng đầy đủ đầu tiên vềquá trình oxy hóavà đưa ra lời giải thích chính xác đầu tiên về cách thức hoạt động của quá trình đốt cháy.[23]Ông đã sử dụng những thí nghiệm này và những thí nghiệm tương tự, tất cả đều bắt đầu vào năm 1774, để làm mất uy tín của thuyết phlogiston và để chứng minh rằng chất được phát hiện bởiPriestleyvàScheelelà mộtnguyên tố hóa học.
Trong một thí nghiệm,Lavoisierđã quan sát thấy rằng không có sự gia tăng tổng thể về trọng lượng khithiếcvà không khí được đốt nóng trong một thùng kín.[23]Ông lưu ý rằng không khí tràn vào khi ông mở thùng chứa, điều này cho thấy một phần không khí bị mắc kẹt đã được tiêu thụ. Ông cũng lưu ý rằng khối lượngthiếcđã tăng lên và sự gia tăng đó cũng giống nhưtrọng lượngcủakhông khílao vào. Điều này và các thí nghiệm khác về quá trình đốt cháy đã được ông ghi lại trong cuốn sáchSur la combustion en général,được xuất bản năm 1777.[23]Trong công trình đó, ông đã chứng minh rằngkhông khílàhỗn hợpcủa hai chất khí; 'không khí quan trọng', cần thiết cho quá trìnhđốt cháyvàhô hấp,vàazote(Gk.ἄζωτον"vô hồn" ), cũng không hỗ trợ.Azotesau đó trở thànhnitơtrong tiếng Anh, mặc dù nó vẫn giữ tên trước đó trongtiếng Phápvà một số ngôn ngữ châu Âu khác.[23]
Lavoisier đổi tên 'không khí quan trọng' thànhoxygènevào năm 1777 từ gốcHy Lạpὀξύς(oxys)(acid,theo nghĩa đen là "sắc", từ mùi vị của acid) và-γενής (-genēs)(người sản xuất, nghĩa đen là người sinh ra), bởi vì ông ấy đã nhầm tưởng rằng oxy là thành phần của tất cả các acid.[26]Các nhà hóa học (chẳng hạn như SirHumphry Davyvào năm 1812) cuối cùng xác định rằng Lavoisier đã sai trong vấn đề này (hydro tạo cơ sở cho hóa học acid), nhưng khi đó cái tên này đã quá nổi tiếng.[27]
Oxygenđã đi vào ngôn ngữ tiếng Anh bất chấp sự phản đối của các nhà khoa học Anh và thực tế làPriestleyngười Anh đã đầu tiên cô lập chất khí này và viết về nó. Điều này một phần là do một bài thơ ca ngợi khí có tựa đề "Oxygen" trong cuốn sách nổi tiếngThe Botanic Garden(1791) củaErasmus Darwin,ông nội củaCharles Darwin.[24]
Lịch sử sau này

Giả thuyết nguyên tửban đầu củaJohn Daltoncho rằng tất cả các nguyên tố đều là nguyên tố cấu tạo và cácnguyên tửtrong các hợp chất thông thường sẽ có tỷ lệ nguyên tử đơn giản nhất so với nhau. Ví dụ, Dalton giả định rằng công thức của nước là HO, dẫn đến kết luận rằngkhối lượng nguyên tửcủa oxy gấp 8 lầnkhối lượngcủa hydro, thay vì giá trị hiện đại là khoảng 16.[28]Năm 1805,Joseph Louis Gay-LussacvàAlexander von Humboldtđã chỉ ra rằng nước được tạo thành từ hai thể tích hydro và một thể tích oxy; và đến năm 1811Amedeo Avogadrođã đưa ra cách giải thích chính xác về thành phần của nước, dựa trên cái mà ngày nay gọi làđịnh luật Avogadrovà các phân tử nguyên tố gồm hai nguyên tử trong các khí đó.[29][a]
Vào cuối thế kỷ 19, cácnhà khoa họcnhận ra rằngkhông khícó thể được hóa lỏng và các thành phần của nó được cô lập bằng cách nén và làm mát nó. Sử dụng phương phápphân tầng,nhà hóa học và vật lý người Thụy SĩRaoul Pierre Pictet đãlàm bay hơilưu huỳnh dioxidelỏng để hóa lỏng carbon dioxide, sau đó được làm bay hơi để làm lạnh khí oxy đủ để hóa lỏng nó. Ông đã gửi một bức điện vào ngày 22 tháng 12 năm 1877 choViện Hàn lâm Khoa học Phápở Paris thông báo về phát hiện của ông vềoxy lỏng.[30]Chỉ hai ngày sau, nhà vật lý người PhápLouis Paul Cailletetđã công bố phương pháp hóa lỏng oxy phân tử của riêng mình.[30]Chỉ một vài giọt chất lỏng được tạo ra trong mỗi trường hợp và không thể tiến hành phân tích có ý nghĩa. Oxy được hóa lỏng ở trạng thái ổn định lần đầu tiên vào ngày 29 tháng 3 năm 1883 bởi các nhà khoa học Ba Lan từĐại học Jagiellonian,Zygmunt WróblewskivàKarol Olszewski.[31]

Năm 1891, nhà hóa học ngườiScotlandJames Dewarđã có thể sản xuất đủoxy lỏngcho nghiên cứu.[32]Quy trình sản xuấtoxy lỏngđầu tiên có tính khả thi về mặt thương mại được phát triển độc lập vào năm 1895 bởi kỹ sư ngườiĐứcCarl von Lindevà kỹ sư người Anh WilliamHampson.Cả hai người đều hạ nhiệt độ của không khí cho đến khi nó hóa lỏng và sau đóchưng cấtcác khí thành phần bằng cách đun sôi từng chất một và thu giữ chúng riêng biệt.[33]Sau đó, vào năm 1901,hànoxyacetylene lần đầu tiên được chứng minh bằng cách đốt cháyhỗn hợpacetylenevàO
2nén. Phương pháp hàn và cắt kim loại này sau đó trở nên phổ biến.[33]
Năm 1923, nhà khoa học người MỹRobert H. Goddardtrở thành người đầu tiên phát triểnđộng cơ tên lửađốt nhiên liệulỏng;động cơ sử dụngxăngđể làm nhiên liệu và oxy lỏng làmchất oxy hóa.Goddard đã bay thành công một tên lửa nhỏ chạy bằng nhiên liệu lỏng 56 m ở 97 km/h vào ngày 16 tháng 3 năm 1926 tạiAuburn, Massachusetts,Hoa Kỳ.[33][34]
Trong cácphòng thí nghiệmhàn lâm, oxy có thể được điều chế bằng cách đun nóngkali chlorattrộn với một tỷ lệ nhỏmangan đioxide.[35]
Mức độ oxy trong khí quyển đang có xu hướng giảm nhẹ trên toàn cầu, có thể do quá trình đốt cháynhiên liệuhóa thạch.[36]
Đặc điểm
Cấu trúc

Ởnhiệt độ và áp suất tiêu chuẩn,oxy là chất khí khôngmàu,không mùi, khôngvị,cócông thức phân tửO
2,được gọi là dioxygen.[38][39]
Làdioxygen,hai nguyên tử oxyliên kết hóa họcvới nhau. Liên kết có thể được mô tả khác nhau dựa trên mức độ lý thuyết, nhưng được mô tả một cách hợp lý và đơn giản là một liên kếtđôicộng hóa trị là kết quả của việc lấp đầy cácorbital phân tửđược hình thành từ cácorbital nguyên tửcủa các nguyên tử oxy riêng lẻ, việc lấp đầy chúng dẫn đếnliên kết thứ tựcủa hai. Cụ thể hơn, liên kết đôi là kết quả của sự lấp đầy liên tục, năng lượng từ thấp đến cao, hayAufbau,lấp đầy các orbital, và kết quả là sự hủy bỏ các đóng góp từ các electron 2s, sau khi lấp đầy liên tiếp các orbital σ và σ* thấp;Sự xen phủ σ của hai orbital nguyên tử 2p nằm dọc theo trục phân tử OO và sự xen phủπcủa hai cặp orbital nguyên tử 2p vuông góc với trục phân tử OO, và sau đó loại bỏ sự đóng góp của hai trong số sáu electron 2p còn lại sau khi chúng lấp đầy một phần của các orbitalπvàπ*thấp nhất.[37]
Sự kết hợp của hủy và σ và chồng chéo kết quảπtrong nhân vật dioxy của đôi trái phiếu và độ phản ứng, và một bộ ba điện tửtrạng thái cơ bản.Cấu hình electroncó hai electron chưa ghép đôi, như được tìm thấy trong các orbital dioxygen (xem các orbitalπ* được điền đầy trong sơ đồ) có năng lượng bằng nhau - tức làsuy biến- là cấu hình được gọi làtrạng thái bộ ba spin.Do đó, trạng thái cơ bản củaO
2phân tử được gọi làoxy bộ ba.[40][b]Các orbital có năng lượng cao nhất, được lấp đầy một phần làphản liên kết,và do đó sự lấp đầy của chúng làm suy yếu thứ tự liên kết từ ba thành hai. Do các điện tử chưa ghép đôi của nó, oxy bộ ba chỉ phản ứng chậm với hầu hết các phân tử hữu cơ có spin điện tử đã ghép đôi; điều này ngăn cản quá trình đốt cháy tự phát.[10]

Ở dạng bộ ba,O
2phân tử đềuthuận từ.Có nghĩa là, chúng truyền đặc tính từ cho oxy khi nó có mặt từ trường, domômen từspincủa cácelectronchưa ghép đôi trong phân tử vànăng lượng trao đổiâm giữa các phân tửO
2lân cận.[32]Oxy lỏng cótừ tínhđến mức, trong các cuộc thử nghiệm trong phòng thí nghiệm, một cầu nối oxy lỏng có thể chống lại trọng lượng của chính nó giữa các cực của một nam châm mạnh.[41][c]
Oxy đơnlà tên được đặt cho một số loại phân tửO
2có năng lượng cao hơnO
2trong đó tất cả các spin điện tử đều được ghép đôi. Nó phản ứng nhiều hơn vớicác phân tử hữu cơthông thường hơn là oxy phân tử. Trong tự nhiên, oxy đơn thường được hình thành từ nước trong quá trình quang hợp, sử dụng năng lượng của ánh sáng mặt trời.[42]Nó cũng được tạo ra trongtầng đối lưubằng quá trình quang phân ozon bằng ánh sáng có bước sóng ngắn[43]và bởihệ thống miễn dịchnhư một nguồn oxy hoạt tính.[44]Carotenoidtrong các sinh vật quang hợp (và có thể cả động vật) đóng một vai trò chính trong việc hấp thụ năng lượng từoxy đơnvà chuyển nó về trạng thái cơ bản chưa được kích thích trước khi nó có thể gây hại cho các tế bào.[45]
Oxy mức 3 (không phảiozon,O
3) mà là trạng thái năng lượng cơ bản của phân tửO
2.[46]Cấu hìnhelectroncủa phân tử này có 2electronkhông tạo cặp mà tách ra riêng lẻ chiếm 2orbital phân tửsuy biến.[47]Các orbital này được xếp vào nhómphản liên kết(làm suy giảm bậc liên kết từ 3 xuống còn 2), vì vậy liên kết oxy 2 nguyên tử yếu hơn liên kết 3 của 2 nguyên tửnitơ,theo đó tất cả các orbital nguyên tử liên kết đều được lấp đầy còn các orbital phản liên kết thì không đầy.[46]
Các dạng thù hình
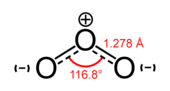
Dạngthù hìnhchung của nguyên tố oxy trên Trái đất được gọi làdioxygen,O
2,phần chính của oxy trong khí quyển của Trái đất. O2có độ dài liên kết là 121pmvà năng lượng liên kết là 498kJ / mol,[48]nhỏ hơn năng lượng của các liên kết đôi hoặc các cặp liên kết đơn khác trongsinh quyểnvà gây raphảnứngtỏa nhiệtcủa O2với bất kỳ phân tử hữu cơ nào.[10][49]Do hàm lượng năng lượng của nó, O2được sử dụng bởi các dạng sống phức tạp, chẳng hạn nhưđộng vật,tronghô hấp tế bào.Các khía cạnh khác củaO
2được đề cập trong phần còn lại của bài viết này.
Trioxygen (O
3) thường được gọi làozonvà là một dạng phản ứng rất mạnh của oxy gây tổn hại đến mô phổi.[50]Ozon được tạo ra trongtầng khí quyển trênkhiO
2kết hợp với oxy nguyên tử được tạo ra bởi sự phân tách củaO
2bằng bức xạtia cực tím(UV).[26]Do ozon hấp thụ mạnh trong vùng UV củaquang phổ,nêntầng ozoncủa tầng trên khí quyển có chức năng như một lá chắn bức xạ bảo vệ hành tinh.[26]Gần bề mặt Trái đất, nó là mộtchất ô nhiễmđược hình thành như một sản phẩm phụ củakhí thải ô tô.[50]Ở độ caoquỹ đạo trái đất thấp,lượng oxy nguyên tử đủ để gây rasự ăn mòn tàu vũ trụ.[51]
Các dạng phân tửoxozonO
4) được phát hiện vào năm 2001,[52][53]và được cho là tồn tại ở một trong sáu pha củaoxy rắn.Năm 2006, nó đã được chứng minh rằng giai đoạn này, được tạo ra bằng cách điều ápO
2đến 20GPa,trên thực tế là một khốitứ diệnO
8.[54]Cụm này có khả năng trở thành mộtchất oxy hóamạnh hơn nhiều so vớiO
2hoặcO
3và do đó có thể được sử dụng trongnhiên liệu tên lửa.[52][53]Một pha kim loại được phát hiện vào năm 1990 khi oxy rắn chịu áp suất trên 96 GPa[55]và năm 1998 nó được chứng minh rằng ở nhiệt độ rất thấp, pha này trở thànhsiêu dẫn.[56]
Tính chất vật lý

Oxy hòa tan trong nước nhiều hơn so với nitơ; nước chứa khoảng một phân tửO
2cho mỗi 2 phân tửN
2,so với tỉ số trong không khí là 1:4. Độ hòa tan của oxy trong nước phụ thuộc vào nhiệt độ, và ở0 °Cthì lượng hòa tan tăng gấp đôi (14,6 mg·L−1) so với ở 20 °C (7,6 mg·L−1).[57][58]Ở nhiệt động không khí 25 °C và 1 atm, nước ngọt chứa khoảng 6,04mililit(mL) oxy trong mộtlít,trong khi đó,nước biểnchứa khoảng 4,95 mL/L.[59]Ở 5 °C, độ hòa tan tăng đến 9,0 mL/L (tăng 50% so với ở 25 °C) trong nước ngọt và 7,2 mL/L (tăng hơn 45%) đối với nước biển.
Oxyngưng tụở 90,20K(−182.95 °C, −297.31 °F), và đóng băng ở 54,36 K (−218.79 °C, −361.82 °F).[60]Cả hai dạnglỏngvàrắnO
2là những chất trong suốt với màuxanh da trờinhạt do gây ra bởi sự hấp thụ ánh sáng đỏ (ngược lại với màu xanh da trời là do sựtán xạ Rayleighcủa ánh sáng xanh).O
2tinh khiết cao thường đượcchưng cất phân đoạntừ không khí lỏng;[61]Oxy lỏng cũng có thể được sản xuất từ sự ngưng tụ không khí bằng cách sử dụng chất làm lạnh lànitơ lỏng.
Oxy là một chất dễ phản ứng và phải được cất giữ cách xa các vật liệu dễ cháy.[62]
Quang phổcủa oxy phân tử có liên quan đến các quá trìnhcực quangvàphát sángtrong khí quyển.[63]Sự hấp thụ trong dảiliên tục Herzbergvàdải Schumann – Rungetrong tia cực tím tạo ra oxy nguyên tử quan trọng tronghóa họccủa tầng giữakhí quyển.[64]Oxy phân tử đơn ở trạng thái bị kích thích chịu trách nhiệm cho sự phát quang hóa học màu đỏ trongdung dịch.[65]
Đồng vị và nguồn gốc sao

Oxy có mặt trong tự nhiên là hỗn hợp của 3đồng vịbền gồm,16O,17O,và18O,với16O chiếm nhiều nhất (99,762%).[66]
Hầu hết16O được tổng hợp ở giai đoạn cuối của quá trình phản ứng tổng hợp heli trong các sao lớn nhưng một số hình thành trong quá trình đốt cháyneon.[67]17O chủ yếu được hình thanh trong quá trìn đốt cháy hydro thành heli trong chu trình CNO, do vậy nó là đồng vị phổ biến trong các đới đốt cháyhydrocủa các sao.[67]Hầu hết18O được tạo ra khi14N(hình thành phổ biến trong quá trình đốt cháy CNO) bắt các hạt nhân4He,nên18O phổ biến trong các đới giàu heli của quá trìnhtiến hóa saolớn.[67]
14 đồng vị phóng xạ của oxy đã được xác định. Đồng vị bền nhất là15O với chu kỳ bán rã 122,24 giây và14O có chu kỳ bán rã 70,606 giây.[66]Tất cả các đồng vị phóng xạ còn là có chu kỳ bán rã dưới 27 s và phổ biến là dưới 83milli giây.[66]Cơ chế phân rã phổ biến nhất của các đồng vị nhẹ hơn16O làphân rã β+[68][69][70]để tạo ra nitơ, và cơ chế phân rã phổ biến nhất của các đồng vị nặng hơn18O là phân rã beta để tạo rafluor.[66]
Sự phổ biến
Oxy lànguyên tố hóa họcphong phú nhất theo khối lượng trongsinh quyển,không khí,biểnvà đất liền củaTrái Đất.Oxy là nguyên tố hóa học phong phú thứ ba trong vũ trụ, sauhydrovàheli.[71]Khoảng 0,9% khối lượng củaMặt trờilà oxy.[23]Oxy chiếm 49,2% khối lượngcủa vỏ Trái đất[72]như một phần của cáchợp chấtoxidenhưsilic dioxidevà là nguyên tố có nhiều nhất theo khối lượng trongvỏ Trái đất.Nó cũng là thành phần chính của các đại dương trên thế giới (88,8% khối lượng).[23]Khí oxy là thành phần phổ biến thứ haicủa bầu khí quyển Trái đất,chiếm 20,8% thể tích và 23,1% khối lượng của nó (khoảng 1015tấn).[23][73][d]Trái đất khác thường trong số các hành tinh củaHệ Mặt trờikhi có nồng độ khí oxy cao như vậy trong bầu khí quyển của nó:Sao Hỏa(với 0,1%O
2theo khối lượng) vàsao Kimcó ít hơn nhiều. LượngO
2xung quanh những hành tinh đó chỉ được tạo ra bởi tác động của bức xạ tia cực tím lên các phân tử chứa oxy nhưcarbon dioxide.

2hơn.
Nồng độ khí oxy cao bất thường trênTrái Đấtlà kết quả củachu trình oxy.Chu trình sinh địa hóanày mô tả sự di chuyển của oxy bên trong và giữa ba hồ chứa chính của nó trên Trái đất: khí quyển, sinh quyển vàthạch quyển.Yếu tố thúc đẩy chính của chu trình oxy làquang hợp,nguyên nhân tạo nên bầu khí quyển của Trái đất hiện đại. Quá trình quang hợp giải phóng oxy vào khí quyển, trong khi quá trìnhhô hấp,phân hủyvà đốt cháy loại bỏ nó khỏi khí quyển. Ở trạng thái cân bằng hiện tại, sản xuất và tiêu dùng oxy diễn ra với tốc độ như nhau.[27]
Oxy tự do cũng xuất hiện trong dung dịch trong các thủy vực trên thế giới. Sự hòa tan tăng dần củaO
2ở nhiệt độ thấp hơn (xem Đặc tính vật lý) có ý nghĩa quan trọng đối với sự sống của đại dương, vì các đại dương ở vùng cực có mật độ sự sống cao hơn nhiều do hàm lượng oxy cao hơn.[74]Nước bị ô nhiễmbởi các chất dinh dưỡng thực vật nhưnitrathoặcphosphatcó thể kích thích sự phát triển của tảo bằng một quá trình gọi làhiện tượng phú dưỡngvà sự phân hủy của các sinh vật này và các vật liệu sinh học khác có thể làm giảmO
2nội dung trong thủy vực phú dưỡng. Cácnhà khoa họcđánh giá khía cạnh này của chất lượng nước bằng cách đonhu cầu oxy sinh hóacủa nước, hoặc lượngO
2cần thiết để khôi phục nó về nồng độ bình thường.[75]
Phân tích
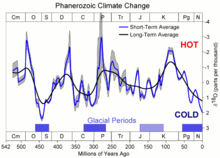
Các nhà cổ sinh vật họcđo tỷ lệ oxy-18 và oxy-16 trongvỏvàxươngcủa các sinh vật biển để xác định khí hậu hàng triệu năm trước (xemchu kỳ tỷ lệ đồng vị oxy). Các phân tửnước biểncó chứađồng vịnhẹ hơn, oxy-16, bay hơi với tốc độ nhanh hơn một chút so với các phân tử nước có chứa 12% oxy-18 nặng hơn, và sự chênh lệch này tăng lên ở nhiệt độ thấp hơn.[76]Trong thời gian nhiệt độ toàn cầu thấp hơn, tuyết và mưa từ đó nước bốc hơi có xu hướng cao hơn ở oxy-16, và nước biển bị bỏ lại có xu hướng cao hơn ở oxy-18. Các sinh vật biển sau đó kết hợp nhiều oxy-18 vào bộ xương và vỏ của chúng hơn là khi chúng ở trong môi trường khí hậu ấm hơn.[76]Các nhà cổ sinh vật học cũng trực tiếp đo tỷ lệ này trong phân tử nước của các mẫulõi băngcó tuổi đời hàng trăm nghìn năm.
Vai trò sinh học
Quang hợp và hô hấp

2tự do và cố địnhCO
2thành đường theochu trình Calvin.
Trong tự nhiên, oxy tự do được sinh ra từ việc phân giải nước trong quá trìnhquang hợp oxydưới tác động của ánh sáng. Theo một vài ước tính,tảo lụcvàcyanobacteriatrong các môi trường biển cung cấp khoảng 70% oxy tự do được tạo ra trên Trái Đất và phần còn lại là từthực vậttrên đất liền.[77]Các tính toán khác về sự đóng góp từ đại dương vào oxy trong khí quyển cao hơn, trong khi một vài ước tính thì thấp hơn, đề xuất rằng các đại dương tạo ra khoảng 45% oxy trong khí quyển mỗi năm.[78]
Công thức tính đơn giản từ quá trình quang hợp là:[79]
- 6 CO2+ 6H
2O+photon→C
6H
12O
6+ 6O
2
- 6 CO2+ 6H
Tiến hóa oxy Photolytic xảy ra trong màng thylakoid của các sinh vật quang hợp và cần năng lượng của 4photon.[e]Mặc dù trải qua nhiều công đoạn, nhưng kết quả là tạo thành sự chênh lệchprotonquamàng thylakoid,nó được sử dụng để tổng hợpATPquaphotophosphoryl hóa.[80]Phân tửO
2còn lại sau khi oxy hóa phân tử nước được giải phóng vào khí quyển.[f]
Phân tửO
2là cần thiết cho việchô hấp của tế bàotrong tất cả cácsinh vật hiếu khí.Oxy được sử dụng trongmitochondriađể giúp tạo ra adenosine triphosphate (ATP) trong quá trìnhphosphoryl hóa oxy hóa.Phản ứng của hô hấp hiếu khí là quá trình ngược lại với quang hợp::
- C
6H
12O
6+ 6O
2→ 6 CO2+ 6H
2O+ 2880 kJ·mol−1
- C
Ởđộng vật có xương sống,O
2khuếch tán qua các màng trong phổi và đi vào các tế bào máu đỏ.Hemoglobinkết hợp vớiO
2,làm thay đổi màu sắc của nó từ đỏ thẩm sang đỏ tươi[81](CO
2được giải phóng từ phần khác của hemoglobin tuahiệu ứng Bohr). Các động vật khác sử dụnghemocyanin(Molluscavà một sốarthropoda) hoặchemerythrin(nhệnvàtôm hùm).[82]Một lít máu có thể hòa tan 200 cm³O
2.[82]
Các loại oxy phản ứng như ionsuperoxide(O−
2) vàhydrogen peroxide(H
2O
2), là các sản phẩm phụ nguy hiểm của oxy sử dụng trong sinh vật.[82]Tuy nhiên, các bộ phận của hệ miễn dịch của các sinh vật bậc cao, tạo ra peroxide, superoxide, và oxy nguyên tử để phá hủy các vi sinh vật xâm nhập. Loại oxy phản ứng cũng có vai trò quan trọng trongphản ứng siêu nhạy cảmcủa thực vật chống lại các tác nhân gây bệnh.[80]
Một người trưởng thành hít 1,8-2,4 gam chất oxy mỗi phút.[83]Lượng này tương đương 6 triệu tấn oxy được hít vào do con người mỗi năm.[g]
Hàm lượng trong cơ thể
| Đơn vị | Áp suất khí phế nang phổi |
Oxy động mạch | Khí máu tĩnh mạch |
|---|---|---|---|
| kPa | 14,2 | 11[84]-13[84] | 4.0[84]-5.3[84] |
| mmHg | 107 | 75[85]-100[85] | 30[86]-40[86] |
Áp suất riêng phần của oxy tự do trong cơ thể của động vật cóxương sốngcòn sống là cao nhất tronghệ hô hấp,và giảm dọc theohệ động mạch,mô ngoại vi và hệ tĩnh mạch..[87]
Tạo nên khí quyển

2tạo nên khí quyển Trái Đất: 1)O
2không được tạo ra; 2)O
2được tạo ra, nhưng bị hấp thụ trong đại dương và đá dưới đáy biển; 3)O
2bắt đầu hình thành ở dạng khí thoát ra khỏi đại dương, nhưng được hấp thụ trong các bề mặt đất và hình thành tầng ozon; 4–5)O
2lắng đọng dưới biển đầy và tích tục ở dạng khí trong khí quyển
Khí oxy tự do hầu như không tồn tại trongkhí quyển Trái Đấttrước khiarchaeavàvi khuẩntiến hóa, có lẽ vào khoảng 3,5 tỉ năm trước. Oxy tự do xuất hiện đầu tiên với một lượng lớn trong suốtđại cổ sinh(giữa 3,0 và 2,3 tỉ năm trước).[88]Trong 1 tỉ năm đầu, bất kỳ dạng oxy tự do được sinh ra từ các sinh vật này đã kết hợp với sắt hòa tan trong các đại dương để hình thành nên các tầng sắt tạo dãi. Khi oxy này chìm xuống trở nên bão hòa, oxy tự do bắt đầu thoát ra ở dạng khí từ các đại dương cách nay 3–2,7 tỉ năm, đạt đến 10% với mức như hiện nay vào khoảng 1,7 tỉ năm trước.[88][89]
Sự có mặt của một lượng lớn oxy hòa tan và oxy tự do trong các đại dương và trong khí quyển có thể đã thúc đẩy các sinh vật yếm khí đang sống đến bờ vực tuyệt chủng trong suốtthảm họa Oxycách nay khoảng 2,4 tỉ năm. Tuy nhiên, việc hô hấp của tế bào sử dụngO
2cho phép các sinh vật hiếu khí tạo ra nhiều ATP hơn sinh vật yếm khí, giúp cho sinh vật hiếu khí chiếm phần lớn trong sinh quyển Trái Đất.[90]
Từ khi bắt đầukỷ Cambricách nay 540 triệu năm, hàmO
2dao động trong khoảng 15% và 30% theo thể tích.[91]Càng về cuốikỷ Cacbon(300 triệu năm trước) mứcO
2khí quyển đạt đến giá trị lớn nhất chiếm 35% thể tích,[91]điều này đã góp phần làm cho côn trùng và lưỡng cư có kích thước lớn vào thời điểm đó.[92]Hoạt động của con người như đốt 7 tỉ tấnnhiên liệu hóa thạchmỗi năm đã có ảnh hưởng rất ít đến hàm lượng oxy tự do trong khí quyển.[93]Với tốc độ quang hợp hiện nay, có thể sẽ mất khoảng 2.000 năm để tạo ra toàn bộO
2trong khí quyển hiện tại.[94]
Ứng dụng
Oxy được sử dụng làm chất oxy hóa, chỉ cófluorcóđộ âm điệncao hơn nó. Oxy lỏng được sử dụng làm chất oxy hóa trong tên lửa đẩy. Oxy là chất duy trì sự hô hấp, vì thế việc cung cấp bổ sung oxy được thấy rộng rãi trongy tế.Những người leonúihoặc đi trênmáy bayđôi khi cũng được cung cấp bổ sung oxy. Oxy được sử dụng trong công nghệhàncũng như trong sản xuấtthépvà rượumethanol.
Oxy, như là mộtchất kích thíchnhẹ, có lịch sử trong việc sử dụng trong giải trí mà hiện nay vẫn còn sử dụng. Các cột chứa oxy có thể nhìn thấy trong các buổi lễ hội ngày nay. Trongthế kỷ XIX,oxy thường được trộn vớinitơ oxideđể làm cácthuốc giảm đau.
Hợp chất
Vìđộ âm điệncao của nó, oxy tạo thành cácliên kết hóa họcvới phần lớn các nguyên tố khác (đây chính là nguồn gốc của định nghĩa nguyên thủy của từoxy hóa). Các nguyên tố duy nhất có thể tránh không bị oxy hóa chỉ là một sốkhí trơ.Phổ biến nhất trong số các oxide tất nhiên là hydro oxide, haynước(H2O). Các chất khác cũng được nhắc đến nhiều là hợp chất củacarbonvà oxy, nhưcarbon dioxide(CO2), các chất nhưrượu(R-OH),aldehyde(R-CHO), vàacid carboxylic(R-COOH). Cácgốc oxy hóanhưchlorat(ClO3−),perchlorat(ClO4−),chromat(CrO42−),dichromat(Cr2O72−),permanganat(MnO4−), vànitrat(NO3−) là những chất oxy hóa rất mạnh. Rất nhiều kim loại nhưsắtchẳng hạn liên kết với các nguyên tử oxy, tạo thànhoxide sắt (III)(Fe2O3). Ozon (O3) được tạo thành trong quá trìnhphóng tĩnh điệnvới sự có mặt của oxy phân tử. Oxy phân tử đôi (O2)2hiện nay đã biết và tìm thấy như là một phần nhỏ trong oxy lỏng. Cácêpoxidelà cácêtetrong đó nguyên tử oxy là một phần của vòng gồm ba nguyên tử.
Phòng ngừa
Oxy có thể là mộtchất độckhi nó cóáp suất thành phầnđược nâng cao. Để dễ hiểu có thể giải thích nôm na là thông thường oxy chiếm khoảng 21% thể tích của không khí. Nếu có thể tăng lượng oxy này lên thành 50% thì không khí khi đó sẽ không tốt cho sự hô hấp.
Một vàidẫn xuấtcủa oxy, như ozon (O3),hydro peroxideH2O2(nước oxy già), các gốc hiđroxyl và superoxide, cũng là những chất độc mạnh. Cơ thể động vật nói chung và con người nói riêng có cơ chế để tự bảo vệ chống lại các chất độc này. Ví dụ,glutathioncó nguồn gốc tự nhiên có thể phản ứng như mộtchất chống oxy hóa,cũng giống nhưbilirubinlà chất tách ra được từhemoglobin.Các nguồn có chứa nhiều oxy xúc tiến sự cháy nhanh và vì vậy là vật nguy hiểm về cháy nổ với sự có mặt của các nhiên liệu. Điều này cũng đúng với các hợp chất của oxy nhưchlorat,perchlorat,dichromat,v.v. Các hợp chất với khả năng oxy hóa cao thông thường có thể gây rabỏng hóa học.
Đám cháy đã giết chết phi hành đoàn của tàuApollo 1trong khi phóng thử, đã lan quá nhanh vì áp suất của oxy nguyên chất được sử dụng khi đó là bằng áp suất khí quyển bình thường thay vì chỉ là một phần ba lẽ ra được sử dụng cho phóng thật. (Xem thêmáp suất thành phần.)
Điều chế
Trong phòng thí nghiệm
Trong phòng thí nghiệm, O2được điều chế bằng cách phân hủy những hợp chất giàu oxy và ít bền đối với nhiệt nhưKMnO4(rắn) hayKClO3(rắn)[95]
Ví dụ:
2KMnO4→ K2MnO4+ MnO2+ O2
6CO2+ 6H2O → C6H12O6+ 6O2
2KClO3→ 2KCl + 3O2
2H2O2→ 2H2O + O2
2H2O → 2H2+ O2
Ag2O + H2O2→ 2Ag + H2O + O2
2KI + O3+ H2O → I2+ 2KOH + O2
5H2O2+ 2KMnO4+ 3H2SO4→ 2MnSO4+ 5O2+ K2SO4+ 8H2O
Trong công nghiệp
Hai phương pháp chính được ứng dụng để sản xuất 100 triệu tấnO
2từ không khí dùng cho công nghiệp hàng năm.[96]Phương pháp phổ biến nhất là chưng cất phân đoạn không khí lỏng thành nhiều thành phần khác nhau nhưN
2ở dạng hơi trong khiO
2thì ở dạng lỏng.[96]

Phương pháp thứ hai sản xuất khíO
2liên quan đến dòng khí khô, sạch đi qua một cặp sàng phân tử giống nhau, chúng hấp thụnitơvà giải phóng một dòng khí có từ 90% đến 93%O
2.[96]Đồng thời khí nitơ được giải phóng khỏi lớp zeolit bão hòa nitơ bằng cách giảm áp suất vận hành của bồng và chuyển một phần khí oxy từ lớp sản xuất đi qua nó, theo chiều dòng ngược lại. Sau một thời gian thiết lập chu kỳ hoạt động, sự vật hành của hai lớp được thay đổi cho nhau, từ đó cho phép cung cấp liên tục khí oxy, được bơn qua đường ống. Khí oxy thu được càng tăng bằng các công nghệ làm lạnh.[97]
Khí oxy cũng có thể được tạo ra qua quá trìnhđiện phânnước thành phân tử oxy và hydro. Phải dùng dòng điện một chiều, vì nếu dùng dòng hai chiều, khi các khí sinh ra ở một cực sẽ giải phóng đồng thời hydro và oxy, nếu đạt đến tỷ lệ 2:1 sẽ gây nổ. Trái với quan điểm phổ biến, tỉ lệ 2:1 được quan sát trong điện phân dòng điện một chiều củanước acidhóa không chứng minh rằng công thức hóa học thực tế của nước làH2Otrừ khi giả định nào đó được thực hiện về công thức phân tử của chính hydro và oxy. Phương pháp tương tự là nung các oxide vàôxoacidcó xúc tác của dòng điện để tạoO
2.Các chất xúc tác hóa học cũng có thể được dùng như máy tạo oxy hóa học hay oxygen candle là các chất được dùng một phần trong việc hỗ trợ sự sống được trang bị trong các tàu ngầm, và vẫn là một phần của thiết bị chuẩn trên các chuyến bay thương mại trong trường hợp khẩn khi áp suất trong khoang máy bay giảm. Một công nghệ tách khí khác liên quan đến việc làm cho khí hòa tan vào các màng sứ dự trênzirconi dioxidebằng cách hoặc tạo áp suất cao hoặc dùng dòng điện để tạo ra khíO
2gần như tinh khiết.[98]
Với số lượng lớn, giá của oxy lỏng năm 2001 vào khoảng 0,21USD/kg.[99]Vì chi phí cơ bản trong sản xuất chủ yếu là chi phí năng lượng để hóa lỏng khí, nên chi phí sản xuất sẽ thay đổi theo chi phí năng lượng.
Vì các lý do kinh tế, oxy thường được vận chuyển trong các bồn ở dạng lỏng đặc biệt các xe bồn cách nhiệt đặc biệt, do một lít oxy lỏng bằng với 840 lít khí oxy ở áp suất khí quyển và nhiệt độ 20 °C (68 °F).[96]Các xe bồn như thế này được dùng để nạp lại oxy lỏng, đặt nằm ngoài các bệnh viện và các việc khác cần sử dụng một lượng lớnoxy tinh khiết.Oxy lỏng được đi qua bộ trao đổi nhiệt để chuyển dạng lỏng đông lạnh thành khí trước khi đi vào tòa nhà. Oxy cũng được chứa trong các bình hình trụ tròn nhỏ hơn ở dạng khí nén; một dạng chứa hữu ích trong các ứng dụng y khoa gọn nhẹ dễ vận chuyển và trong việc cắt-hàn nguyên liệu/xì hàn.[96]
Xem thêm
- Phương pháp Winklercho oxy hòa tan để xác định lượng oxy hòa tan trong nước sạch
- Sự cháy
- Oxy hóa
Chú thích
- ^Những kết quả này hầu như bị bỏ qua cho đến năm 1860. Một phần của sự bác bỏ này là do niềm tin rằng các nguyên tử của một nguyên tố sẽ không cóái lực hóa họcđối với các nguyên tử của cùng một nguyên tố, và một phần là do những ngoại lệ rõ ràng đối với định luật Avogadro mà mãi sau này mới được giải thích về sự phân ly của các phân tử.
- ^An orbital is a concept fromquantum mechanicsthat models an electron as awave-like particlethat has a spatial distribution about an atom or molecule.
- ^Oxygen's paramagnetism can be used analytically in paramagnetic oxygen gas analysers that determine the purity of gaseous oxygen. (“Company literature of Oxygen analyzers (triplet)”.Servomex.Bản gốclưu trữ ngày 8 tháng 3 năm 2008.Truy cập ngày 15 tháng 12 năm 2007.)
- ^Figures given are for values up to 80 km (50 mi) above the surface
- ^Các màng thylakoid là một phần củachloroplasttrong tảo và thực thực vật trong khi chúng đon giản là một trong nhiều cấu trúc màng ở cyanobacteria. Thực tế, chloroplast được cho là đã tiến hóa từcyanobacteriatừng là đối tác cộng sinh với các yếu tố tiền phát sinh của thực vật và tảo.
- ^Water oxidation is catalyzed by amanganese-containingenzymecomplex known as theoxygen evolving complex(OEC) or water-splitting complex found associated with the lumenal side of thylakoid membranes. Manganese is an importantcofactor,andcalcivàchlorideare also required for the reaction to occur.(Raven 2005)
- ^(1.8 grams/min/person)×(60 min/h)×(24 h/day)×(365 days/year)×(6.6 billion people)/1,000,000 g/t=6.24 billion tonnes
Tham khảo
- ^“Trọng lượng nguyên tử tiêu chuẩn: Oxy”.CIAAW.2009
- ^Magnetic susceptibility of the elements and inorganic compoundsLưu trữ2011-03-03 tạiWayback Machine,in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^Weast, Robert (1984).CRC, Handbook of Chemistry and Physics.Boca Raton, Florida: Chemical Rubber Company Publishing. tr. E110.ISBN0-8493-0464-4.
- ^Đặng Thái Minh, "Dictionnaire vietnamien - français. Les mots vietnamiens d’origine française",Synergies Pays riverains du Mékong,n° spécial, năm 2011. ISSN: 2107-6758. Trang 163.
- ^“WebElements: the periodic table on the web – Oxygen: electronegativities”.WebElements.Truy cập ngày 7 tháng 11 năm 2011.
- ^Emsley 2001,tr.297
- ^ “Oxygen”.Los Alamos National Laboratory.Bản gốclưu trữ ngày 26 tháng 10 năm 2007.Truy cập ngày 16 tháng 12 năm 2007.
- ^Atkins, P.; Jones, L.; Laverman, L. (2016).Chemical Principles,7th edition. Freeman.ISBN978-1-4641-8395-9
- ^Cook & Lauer 1968,p.500
- ^abcWeiss, H. M. (2008).“Appreciating Oxygen”.J. Chem. Educ.85(9): 1218–1219.Bibcode:2008JChEd..85.1218W.doi:10.1021/ed085p1218.
- ^Schmidt-Rohr, K. (2020). "Oxygen Is the High-Energy Molecule Powering Complex Multicellular Life: Fundamental Corrections to Traditional Bioenergetics"ACS Omega5:2221-2233.http://dx.doi.org/10.1021/acs Omega.9b03352
- ^“Atomic oxygen erosion”.Bản gốclưu trữ ngày 13 tháng 6 năm 2007.Truy cập ngày 8 tháng 8 năm 2009.
- ^G. D. Parks & Mellor, J. W. (1939).Mellor's Modern Inorganic Chemistry(ấn bản 6). London: Longmans, Green and Co.Quản lý CS1: sử dụng tham số tác giả (liên kết)
- ^Jastrow, Joseph (1936).Story of Human Error.Ayer Publishing. tr. 171.ISBN978-0-8369-0568-7.
- ^abcdeCook & Lauer 1968,p.499.
- ^abWorld of Chemistrycontributors (2005).“John Mayow”.World of Chemistry.Thomson Gale.ISBN978-0-669-32727-4.Truy cập ngày 16 tháng 12 năm 2007.
- ^abEmsley 2001,p.299
- ^Best, Nicholas W. (2015). “Lavoisier's 'Reflections on Phlogiston' I: Against Phlogiston Theory”.Foundations of Chemistry.17(2): 137–151.doi:10.1007/s10698-015-9220-5.
- ^Morris, Richard (2003).The last sorcerers: The path from alchemy to the periodic table.Washington, D.C.: Joseph Henry Press.ISBN978-0-309-08905-0.
- ^abMarples, Frater James A.“Michael Sendivogius, Rosicrucian, and Father Of Studies of Oxygen”(PDF).Societas Rosicruciana in Civitatibus Foederatis, Nebraska College. tr. 3–4.Truy cập ngày 25 tháng 5 năm 2018.
- ^abBugaj, Roman (1971).“Michał Sędziwój – Traktat o Kamieniu Filozoficznym”.Biblioteka Problemów(bằng tiếng Ba Lan).164:83–84.ISSN0137-5032.
- ^“Oxygen”.RSC.org.Truy cập ngày 12 tháng 12 năm 2016.
- ^abcdefghiCook & Lauer 1968,p. 500
- ^abcEmsley 2001,p. 300
- ^Priestley, Joseph (1775).“An Account of Further Discoveries in Air”.Philosophical Transactions.65:384–94.doi:10.1098/rstl.1775.0039.
- ^abcParks, G. D.; Mellor, J. W. (1939).Mellor's Modern Inorganic Chemistry(ấn bản 6). London: Longmans, Green and Co.
- ^abGreenwood, Norman N.; Earnshaw, A. (1997),Chemistry of the Elements(ấn bản 2), Oxford: Butterworth-Heinemann,ISBN0-7506-3365-4
- ^DeTurck, Dennis; Gladney, Larry; Pietrovito, Anthony (1997).“Do We Take Atoms for Granted?”.The Interactive Textbook of PFP96.University of Pennsylvania.Bản gốclưu trữ ngày 17 tháng 1 năm 2008.Truy cập ngày 28 tháng 1 năm 2008.
- ^Roscoe, Henry Enfield; Schorlemmer, Carl (1883).A Treatise on Chemistry.D. Appleton and Co. tr. 38.
- ^abDaintith, John (1994).Biographical Encyclopedia of Scientists.CRC Press. tr. 707.ISBN978-0-7503-0287-6.
- ^Papanelopoulou, Faidra (2013).“Louis Paul Cailletet: The liquefaction of oxygen and the emergence of low-temperature research”.Notes and Records of the Royal Society of London.67(4): 355–73.doi:10.1098/rsnr.2013.0047.PMC3826198.
- ^abEmsley 2001,p.303
- ^abcHow Products are Madecontributors (2002).“Oxygen”.How Products are Made.The Gale Group, Inc.Truy cập ngày 16 tháng 12 năm 2007.
- ^“Goddard-1926”.NASA.Bản gốclưu trữ ngày 8 tháng 11 năm 2007.Truy cập ngày 18 tháng 11 năm 2007.
- ^Flecker, Oriel Joyce (1924).A school chemistry.MIT Libraries. Oxford, Clarendon press. tr.30.
- ^Scripps Institute.“Atmospheric Oxygen Research”.
- ^abJack Barrett, 2002, "Atomic Structure and Periodicity, (Basic concepts in chemistry, Vol. 9 of Tutorial chemistry texts), Cambridge, U.K.:Royal Society of Chemistry, p. 153,ISBN0854046577,see accessed ngày 31 tháng 1 năm 2015.
- ^“Oxygen Facts”.Science Kids. ngày 6 tháng 2 năm 2015.Truy cập ngày 14 tháng 11 năm 2015.
- ^Pauling, L. (1960).The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry(ấn bản 3). Ithaca, N.Y.: Cornell University Press.
- ^Jakubowski, Henry.“Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen”.Biochemistry Online.Saint John's University.Truy cập ngày 28 tháng 1 năm 2008.
- ^“Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet”.University of Wisconsin-Madison Chemistry Department Demonstration lab.Bản gốclưu trữ ngày 17 tháng 12 năm 2007.Truy cập ngày 15 tháng 12 năm 2007.
- ^Krieger-Liszkay, Anja (ngày 13 tháng 10 năm 2004).“Singlet oxygen production in photosynthesis”.Journal of Experimental Botany.56(411): 337–46.doi:10.1093/jxb/erh237.PMID15310815.
- ^Harrison, Roy M.(1990).Pollution: Causes, Effects & Control(ấn bản 2). Cambridge:Royal Society of Chemistry.ISBN978-0-85186-283-5.
- ^Wentworth, Paul; McDunn, J. E.; Wentworth, A. D.; Takeuchi, C.; Nieva, J.; Jones, T.; Bautista, C.; Ruedi, J. M.; và đồng nghiệp (ngày 13 tháng 12 năm 2002).“Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation”.Science.298(5601): 2195–219.Bibcode:2002Sci...298.2195W.doi:10.1126/science.1077642.PMID12434011.
- ^Hirayama, Osamu; Nakamura, Kyoko; Hamada, Syoko; Kobayasi, Yoko (1994).“Singlet oxygen quenching ability of naturally occurring carotenoids”.Lipids.29(2): 149–50.doi:10.1007/BF02537155.PMID8152349.
- ^abJakubowski, Henry.“Biochemistry Online”.Saint John's University.Truy cập ngày 28 tháng 1 năm 2008.
|chapter=bị bỏ qua (trợ giúp) - ^Orbital là một khái niệm củacơ học lượng tửlập mô hình một electron như là mộthạt tựa như sóngcó phân bố không gian xung quanh một nguyên tử hay một phân tử.
- ^Chieh, Chung.“Bond Lengths and Energies”.University of Waterloo.Bản gốclưu trữ ngày 14 tháng 12 năm 2007.Truy cập ngày 16 tháng 12 năm 2007.
- ^Schmidt-Rohr, K. (2015).“Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2”.J. Chem. Educ.92(12): 2094–2099.Bibcode:2015JChEd..92.2094S.doi:10.1021/acs.jchemed.5b00333.
- ^abStwertka, Albert (1998).Guide to the Elements.Oxford University Press. tr.48–49.ISBN978-0-19-508083-4.
- ^“Atomic oxygen erosion”.Bản gốclưu trữ ngày 13 tháng 6 năm 2007.Truy cập ngày 8 tháng 8 năm 2009.
- ^abCacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). “Experimental Detection of Tetraoxygen”.Angewandte Chemie International Edition.40(21): 4062–65.doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X.PMID12404493.
- ^abBall, Phillip (ngày 16 tháng 9 năm 2001).“New form of oxygen found”.Nature News.Truy cập ngày 9 tháng 1 năm 2008.
- ^Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; và đồng nghiệp (2006). “Observation of anO
8molecular lattice in the phase of solid oxygen”.Nature.443(7108): 201–04.Bibcode:2006Natur.443..201L.doi:10.1038/nature05174.PMID16971946. - ^Desgreniers, S.; Vohra, Y. K.; Ruoff, A. L. (1990). “Optical response of very high density solid oxygen to 132 GPa”.J. Phys. Chem.94(3): 1117–22.doi:10.1021/j100366a020.
- ^Shimizu, K.; Suhara, K.; Ikumo, M.;Eremets, M. I.;và đồng nghiệp (1998). “Superconductivity in oxygen”.Nature.393(6687): 767–69.Bibcode:1998Natur.393..767S.doi:10.1038/31656.
- ^Emsley 2001,p.299
- ^“Air solubility in water”.The Engineering Toolbox.Truy cập ngày 21 tháng 12 năm 2007.
- ^David Hudson Evans & Claiborne, James B. (2006).The Physiology of Fishes.CRC Press. tr.88.ISBN0849320224.Quản lý CS1: sử dụng tham số tác giả (liên kết)
- ^Lide, David R. (2003). “Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements”.CRC Handbook of Chemistry and Physics(ấn bản 84). Boca Raton, fluorrida:CRC Press.ISBN0849305950.
- ^“Overview of Cryogenic Air Separation and Liquefier Systems”.Universal Industrial Gases, Inc.Truy cập ngày 15 tháng 12 năm 2007.
- ^“Liquid Oxygen Material Safety Data Sheet”(PDF).Matheson Tri Gas.Bản gốc(PDF)lưu trữ ngày 27 tháng 2 năm 2008.Truy cập ngày 15 tháng 12 năm 2007.
- ^Krupenie, Paul H. (1972).“The Spectrum of Molecular Oxygen”.Journal of Physical and Chemical Reference Data.1(2): 423–534.Bibcode:1972JPCRD...1..423K.doi:10.1063/1.3253101.
- ^Guy P. Brasseur; Susan Solomon (ngày 15 tháng 1 năm 2006).Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere.Springer Science & Business Media. tr. 220–.ISBN978-1-4020-3824-2.
- ^Kearns, David R. (1971). “Physical and chemical properties of singlet molecular oxygen”.Chemical Reviews.71(4): 395–427.doi:10.1021/cr60272a004.
- ^abcd“Oxygen Nuclides / Isotopes”.EnvironmentalChemistry.Truy cập ngày 17 tháng 12 năm 2007.
- ^abcMeyer, B.S. (September 19–21, 2005).“Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen”(PDF).Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute.Workgroup on Oxygen in the Earliest Solar System.Gatlinburg, Tennessee. 9022.Truy cập ngày 22 tháng 1 năm 2007.
- ^“NUDAT 13O”.Bản gốclưu trữ ngày 4 tháng 10 năm 2018.Truy cập ngày 6 tháng 7 năm 2009.
- ^“NUDAT 14O”.Bản gốclưu trữ ngày 7 tháng 6 năm 2022.Truy cập ngày 6 tháng 7 năm 2009.
- ^“NUDAT 15O”.Bản gốclưu trữ ngày 7 tháng 6 năm 2022.Truy cập ngày 6 tháng 7 năm 2009.
- ^Emsley 2001,p.297
- ^“Oxygen”.Los Alamos National Laboratory.Bản gốclưu trữ ngày 26 tháng 10 năm 2007.Truy cập ngày 16 tháng 12 năm 2007.
- ^Emsley 2001,p.298
- ^From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey notes that according to later articles inNature,the values appear to be about 3% too high.
- ^Emsley 2001,p.301
- ^abEmsley 2001,p.304
- ^Fenical, William (1983). “Marine Plants: A Unique and Unexplored Resource”.Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings).DIANE Publishing. tr. 147.ISBN1-4289-2397-7.
- ^Walker, J. C. G. (1980).The oxygen cycle in the natural environment and the biogeochemical cycles.Berlin: Springer-Verlag.
- ^Theodore L. Brown & LeMay, Burslen (2003).Chemistry: The Central Science.Prentice Hall/Pearson Education. tr. 958.ISBN0-13-048450-4.Quản lý CS1: sử dụng tham số tác giả (liên kết)
- ^abRaven 2005,115–27
- ^Stwertka, Albert (1998).Guide to the Elements.Oxford University Press. tr.48–49.ISBN0-19-508083-1.
- ^abcEmsley 2001,p.298
- ^“"For humans, the normal volume is 6–8 liters per minute."”.Bản gốclưu trữ ngày 6 tháng 9 năm 2010.Truy cập ngày 4 tháng 12 năm 2013.
- ^abcdDerived from mmHg values using 0.133322 kPa/mmHg
- ^abNormal Reference Range TableLưu trữ2011-12-25 tạiWayback Machinefrom The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^abThe Medical Education Division of the Brookside Associates--> ABG (Arterial Blood Gas)Retrieved on ngày 6 tháng 12 năm 2009
- ^Charles Henrickson (2005).Chemistry.Cliffs Notes.ISBN0-7645-7419-1.
- ^abdoi:10.1038/nature12426
Hoàn thành chú thích này - ^Neil A. Campbell & Reece, Jane B. (2005).Biology, 7th Edition.San Francisco: Pearson – Benjamin Cummings. tr. 522–23.ISBN0-8053-7171-0.Quản lý CS1: sử dụng tham số tác giả (liên kết)
- ^Freeman, Scott (2005).Biological Science, 2nd.Upper Saddle River, NJ: Pearson – Prentice Hall. tr. 214, 586.ISBN0-13-140941-7.
- ^abBerner, Robert A. (1999).“Atmospheric oxygen over Phanerozoic time”.Proceedings of the National Academy of Sciences of the USA.96(20): 10955–57.Bibcode:1999PNAS...9610955B.doi:10.1073/pnas.96.20.10955.PMC34224.PMID10500106.
- ^doi:10.1111/j.1472-4669.2009.00188.x
Hoàn thành chú thích này - ^Emsley 2001,p.303
- ^Dole, Malcolm (1965).“The Natural History of Oxygen”(PDF).The Journal of General Physiology.49(1): 5–27.doi:10.1085/jgp.49.1.5.PMC2195461.PMID5859927.Truy cập ngày 16 tháng 12 năm 2007.
- ^Lê, Xuân Trọng (2014).Hóa học 8(ấn bản 10). Nhà xuất bản Giáo dục Việt Nam. tr. 92, 93.
- ^abcdeEmsley 2001,p. 300
- ^“Non-Cryogenic Air Separation Processes”.UIG Inc. 2003.Truy cập ngày 16 tháng 12 năm 2007.
- ^Emsley 2001,p.301
- ^Space Shuttle Use of Propellants and Fluids.National Aeronautics and Space Administration. 2001–09.Bản gốclưu trữ ngày 17 tháng 9 năm 2008.Truy cập ngày 16 tháng 12 năm 2007.
NASAFacts FS-2001-09-015-KSC
Kiểm tra giá trị ngày tháng trong:|date=(trợ giúp)
Sách tham khảo
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải vềOxy. |
- Oxygen (chemical element)tạiEncyclopædia Britannica(tiếng Anh)
- Cook, Gerhard A.; Lauer, Carol M. (1968). “Oxygen”. Trong Clifford A. Hampel (biên tập).The Encyclopedia of the Chemical Elements.New York: Reinhold Book Corporation. tr.499–512.LCCN68-29938.
- Emsley, John (2001). “Oxygen”.Nature's Building Blocks: An A-Z Guide to the Elements.Oxford, England, UK: Oxford University Press. tr. 297–304.ISBN0-19-850340-7.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005).Biology of Plants(ấn bản 7). New York: W.H. Freeman and Company Publishers. tr.115–27.ISBN0-7167-1007-2.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |

