
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Tam muối(3PbO·PbSO4·H2O,Tương đối phần tử chất lượng vì990)Nhưng dùng làm Polyvinyl chloride nhiệt ổn định tề, không hòa tan thủy. Lấy200.0tChì bùn(Chủ yếu thành phần vìPbO,PbCậpPbSO4Chờ)Vì nguyên liệu chế bị tam muối công nghệ lưu trình như đồ sở kỳ:
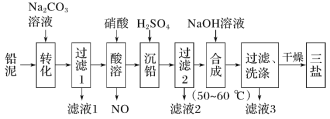
Đã biết:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13.Trả lời dưới đây vấn đề:
(1)ThêmNa2CO3Dung dịch chuyển hóa mục đích là__.
(2)Toan dung khi, không trực tiếp sử dụngH2SO4Dung dịch nguyên nhân có thể là__;Chì cùng axit nitric ở toan dung trong quá trình phát sinh phản ứng ly tử phương trình vì__.
(3)Lưu trình trung nhưng tuần hoàn lợi dụng vật chất là__;Gột rửa thao tác khi, kiểm nghiệm lắng đọng lại hay không gột rửa sạch sẽ yêu cầu thuốc thử là__.
(4)Đương lắng đọng lại chuyển hóa đạt cân bằng khi, chất lỏng đã lọclTrungc(![]() )Cùngc(
)Cùngc(![]() )So giá trị vì__.
)So giá trị vì__.
(5)50~60℃ khi hợp thành tam muối phương trình hoá học vì__;Nếu được đến thuần tịnh khô ráo tam muối99.0t,Giả thiết chì bùn trung chì nguyên tố có80%Chuyển hóa vì tam muối, tắc chì bùn trung chì nguyên tố chất lượng điểm vì__.
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Băng tinh thạch lại danh sáu Flo nhôm toan Natri(Na3AlF6),Màu trắng thể rắn, hơi hòa tan thủy, thường dùng làm điện giải nhôm công nghiệp trợ dung môi. Công nghiệp thượng dùng huỳnh thạch(Chủ yếu thành phần làCaF2),Axit đậm đặc, hydro oxy hoá nhôm cùng soda dung dịch thông qua ướt pháp chế bị băng tinh thạch, mỗ hóa học thực nghiệm tiểu tổ bắt chước công nghiệp thượng chế lấyNa3AlF6Trang bị đồ như đồ(Nên trang bị đều từ tụ bốn Flo Êtilen dụng cụ lắp ráp mà thành).
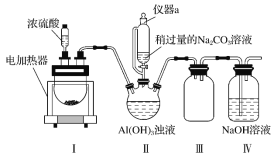
Đã biết:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑
(1)Trang bị Ⅲ tác dụng vì__.
(2)Ở thực nghiệm trong quá trình, trang bị Ⅱ trung cóCO2Khí thể dật ra, đồng thời quan sát đã có màu trắng thể rắn phân ra, thỉnh viết ra nên phản ứng ly tử phương trình:__.
(3)Ở thực nghiệm trong quá trình, trước hướng trang bị Ⅱ trung thông nhậpHFKhí thể, sau đó lại tích thêmNa2CO3Dung dịch, mà không phải trước đemNa2CO3CùngAl(OH)3Hỗn hợp sau lại thông nhậpHFKhí thể, này nguyên nhân là__.
(4)Trang bị Ⅱ phản ứng sau hỗn hợp dịch trải qua lọc có thể được đếnNa3AlF6Tinh thể, ở lọc thao tác trung xác định lắng đọng lại đã gột rửa sạch sẽ phương pháp là__.
(5)Huỳnh thạch trung đựng chút ítFe2O3Tạp chất, nhưng dùng trang bị Ⅰ phản ứng sau dung dịch tới trắc định Flo hóa Canxi hàm lượng. Cụ thể thao tác như sau: Lấy8.0gHuỳnh thạch gia nhập trang bị Ⅰ trung, hoàn toàn phản ứng sau, đem hỗn hợp dịch thêm thủy pha loãng, sau đó gia nhập đủ lượngKIThể rắn, lại lấy tinh bột vì chỉ thị tề, dùng0.1000mol·L-1Na2S2O3Tiêu chuẩn dung dịch chuẩn độ, đương xuất hiện__Hiện tượng khi, tới chuẩn độ chung điểm, tiêu haoNa2S2O3Tiêu chuẩn dung dịch40.00mL,Tắc huỳnh thạch trung Flo hóa Canxi phần trăm hàm lượng vì__.(Đã biết:I2+2![]() =
=![]() +2I-)
+2I-)
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Nhiệt độ bình thường hạ chứa carbon các lốm đốmH2CO3,![]() Cùng
Cùng![]() Tồn tại vớiCO2CùngNaOHDung dịch phản ứng sau dung dịch trung, này vật chất lượng điểm cùng dung dịchpHQuan hệ như đồ sở kỳ, dưới đây cách nói sai lầm chính là( )
Tồn tại vớiCO2CùngNaOHDung dịch phản ứng sau dung dịch trung, này vật chất lượng điểm cùng dung dịchpHQuan hệ như đồ sở kỳ, dưới đây cách nói sai lầm chính là( )

A.pH=10.25Khi,c(Na+)=c(![]() )+c(
)+c(![]() )
)
B.Vì đạt được tận khả năng thuầnNaHCO3,Nghi khống chế dung dịchpHVì7~9Chi gian
C.Căn cứ đồ trung số liệu, có thể tính toán được đếnH2CO3Bước đầu tiên điện ly cân bằng hằng sốK1(H2CO3)=10-6.37
D.Nếu là0.1molNaOHPhản ứng sau đoạt được1LDung dịch,pH=10Khi, dung dịch trung tồn tại dưới quan hệ:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Axit phosphoric thiết Lithium pin là màu xanh lục bảo vệ môi trường hình pin, pin tổng phản ứng vì: Li1-xFePO4+LixC6= LiFePO4+C6.
(1)LiFepO4Trung Fe2+Giới điện tử bài bố đồ ( quỹ đạo biểu đạt thức ) vì___________,Nên pin phản ứng vật trung đề cập đệ nhị chu kỳ nguyên tố đệ nhất điện ly có thể từ lớn đến tiểu nhân trình tự là___________( dùng ký hiệu nguyên tố tỏ vẻ ).
(2)H3PO4Cùng H2CO3Trung P cùng C nguyên tử tạp hóa phương thức_____( điền “Tương đồng” hoặc “Không giống nhau” ). PO43-Không gian kết cấu vì___________.
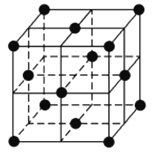
(3) thạch mặc nhưng dùng làm Lithium ly tử pin cực âm tài liệu, Li+Khảm người thạch mặc hai tầng gian, dẫn tới thạch mặc tầng chồng chất phương thức phát sinh thay đổi, hình thành công thức hoá học vì LixC6Khảm nhập hoá chất. Mỗ thạch mặc khảm nhập hoá chất mặt bằng kết cấu như hữu đồ sở kỳ, tắc x=___________;Nếu mỗi cái lục nguyên hoàn đều đối ứng một cái L i+,Tắc công thức hoá học vì___________.

(4) mỗ kim loại Lithium Boron hydro hóa vật là chất lượng tốt thể rắn chất điện phân, cũng có cao trữ hydro mật độ. Dương ly tử vì Li+,I-on âm là từ 12 cái Boron nguyên tử cùng 12 cái hydro nguyên tử sở cấu thành ly tử đoàn. I-on âm ở tinh bào trung vị trí như đồ sở kỳ, này chồng chất phương thức vì___________,Li+Chiếm cứ i-on âm tạo thành sở hữu chính tứ phía thể trung tâm, nên hoá chất công thức hoá học vì___________( dùng nhất giản số nguyên so tỏ vẻ ). Giả thiết tinh bào biên trường vì a nm, tắc hai cái gần nhất Li+Khoảng cách vì___________nm.
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Cu2O rộng khắp dùng làm thuốc màu cùng hóa chất sinh sản chất xúc tác.
Ⅰ. chế bị Cu2O
( 1 ) điện giải pháp: Công nghiệp thượng dùng đồng làm dương cực, thái phiến vì âm cực, điện giải nhất định độ dày NaOH dung dịch nhưng chế bị oxy hoá á đồng, viết ra dương cực điện cực đẳng thức vì_____________________
( 2 ) hơi nhũ dịch - hoàn nguyên pháp: Ở 100℃ Cu ( NO3)2Thủy dung dịch trung gia nhập nhất định thể tích NaOH thủy dung dịch, cũng quấy sử chi hỗn hợp đều đều, lại trục tích gia nhập sự Hy-đrát hoá tỉnh thủy dung dịch, cho đến sinh ra màu đỏ lắng đọng lại, kinh trừu lự, gột rửa cùng chân không khô ráo, được đến Cu2O bột phấn.
Đã biết: N2H4( l ) +O2 (g ) =N2( g ) +2H2O ( l ) △H= -akJ/mol
Cu(OH)2( s ) =CuO ( s ) +H2O ( l ) △H= +bkJ/mol
4CuO ( s ) =2Cu2O ( s ) +O2( g ) △H= +ckJ/mol
Tắc từ N2H4Cùng Cu(OH)2Phản ứng chế bị Cu2O nhiệt hoá học phương trình vì________________________.
Ⅱ. công nghiệp thượng dùng Cu2O cùng ZnO tạo thành chất xúc tác nhưng dùng cho công nghiệp thượng hợp thành metanol: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol, trả lời dưới đây vấn đề:
CH3OH(g) △H = -90.8 kJ/mol, trả lời dưới đây vấn đề:
( 1 ) có thể thuyết minh phản ứng CO(g)+2H2(g)![]() CH3OH(g) đã đạt cân bằng trạng thái chính là(_______)
CH3OH(g) đã đạt cân bằng trạng thái chính là(_______)
A. đương phản ứng nhiệt hiệu ứng △H = -90.8 kJ/mol khi phản ứng đạt tới cân bằng trạng thái
B. Ở nhiệt độ ổn định hằng áp vật chứa trung, hỗn hợp khí thể mật độ bảo trì bất biến
C. Ở tuyệt nhiệt hằng dung vật chứa trung, phản ứng cân bằng hằng số không hề biến hóa
D. ở nhiệt độ ổn định hằng dung vật chứa trung, khí thể bình quân Moore chất lượng không hề biến hóa
( 2 ) ở T1℃ khi, thể tích vì 2 L hằng dung vật chứa trung sung nhập vật chất lượng chi cùng vì 3mol H2Cùng CO, đương lúc đầu n(H2)/n(CO)= 2 khi, trải qua 5min đạt tới cân bằng, CO chuyển hóa suất vì 0.6, tắc 0~5min nội bình quân phản ứng tốc độ v (H2)=___;Nên độ ấm hạ cân bằng hằng số vì__________________;Nếu lúc này lại hướng vật chứa trung gia nhập CO(g) cùng CH3OH(g) các 0.4mol, đạt tân cân bằng khi H2Chuyển hóa suất đem______( điền “Tăng đại”, “Giảm nhỏ” hoặc “Bất biến” );
( 3 ) công nghiệp thực tế hợp thành CH3OH sinh sản trung, chọn dùng hạ đồ M điểm mà không phải N điểm đối ứng phản ứng điều kiện, vận dụng phản ứng hoá học tốc độ cùng cân bằng hoá học tri thức, đồng thời suy xét sinh sản thực tế, thuyết minh lựa chọn nên phản ứng điều kiện lý do:________.

Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Ô tô khói xe tinh lọc nguyên lý vì2NO(g)+2CO(g)N2(g)+2CO2(g)ΔH=-746.5kJ·mol-1,Như đồ vì ở bất đồng mới bắt đầu độ dàyCOCùng bất đồng chất xúc tácⅠ,ⅡDưới tác dụng(Mặt khác điều kiện tương đồng),Thể tích vì2LBịt kín vật chứa trungn(N2)Tùy phản ứng thời gian biến hóa đường cong, dưới đây cách nói chính xác chính là( )

A.aĐiểm khi, chất xúc tácⅠ,ⅡDưới tác dụngCOChuyển hóa suất bằng nhau
B.0~6hNội, chất xúc tácⅠThôi hóa hiệu quả so chất xúc tácⅡHảo
C.0~5hNội, chất xúc tácⅠDưới tác dụngCOPhản ứng tốc độ vì0.32mol·L-1·h-1
D.0~12hNội, chất xúc tácⅡDưới tác dụng phản ứng thả ra nhiệt lượng so chất xúc tácⅠNhiều
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Dưới đây thường thấy phần tử trung liên kết hoá học phán đoán chính xác chính là( )
A.CN-CùngN2Kết cấu tương tự,[Fe(CN)6]3-Trung xứng vị kiện cùngπKiện cái số chi so vì2∶1
B.CH3CH2CH2OHPhần tử trung tính có cực kiện cùng phi tính có cực kiện số lượng chi so vì8∶1
C.![]() Cùng
Cùng![]() Lẫn nhau vì chờ điện tử thể,1mol
Lẫn nhau vì chờ điện tử thể,1mol![]() Trung đựngπKiện số lượng vì2NA
Trung đựngπKiện số lượng vì2NA
D.Đã biết phản ứngN2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),Nếu nên phản ứng trung có4molN—HKiện đứt gãy, tắc hình thànhπKiện số lượng vì6NA
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Như đồ, giáp là lợi dụng vi sinh vật đem nước thải trung phân u-rê[CO(NH2)2]Năng lượng hoá học trực tiếp chuyển hóa vì điện năng,Cũng sinh thành hoàn cảnh hữu hảo vật chất trang bị, đồng thời lợi dụng này trang bị điện năng ở thiết thượng mạ đồng, dưới đây cách nói trungSai lầmChính là ()
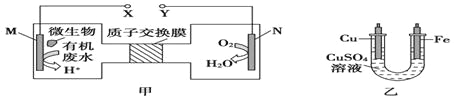
A.Ất trang bị trung dung dịch nhan sắc bất biến
B.Đồng điện cực ứng cùngYTương liên tiếp
C.MĐiện cực đẳng thức:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.ĐươngNĐiện cực tiêu hao0.25molKhí thể khi, đồng điện cực chất lượng giảm bớt16g
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】CuClLà ứng dụng rộng khắp chất tổng hợp hữu cơ chất xúc tác, nhưng từ đồng thau quặng(Chủ yếu thành phần vìCuFeS2)Trung chế lấy.
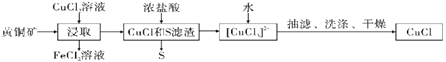
Đã biết:CuClLà một loại màu trắng bột phấn, hơi hòa tan thủy, khó hòa tan etanol, ở trong không khí dễ bị oxy hoá, ở thủy dung dịch trung tồn tại cân bằng:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(Vô sắc dung dịch),Dưới đây tự thuật sai lầm chính là ()
[CuCl3]2-(aq)(Vô sắc dung dịch),Dưới đây tự thuật sai lầm chính là ()
A.Tẩm lấy giai đoạn, tham gia phản ứngCuFeS2CùngCuCl2Vật chất lượng chi so vì3:l
B.Tẩm lấy đoạt được đếnFeCl2Dung dịch, nhưng dùng để ăn mòn phúc ở cách biệt bản thượng đồng bạc chế tạo in ấn bảng mạch điện
C.Thêm thủy có lợi choCuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)Cân bằng nghịch hướng di động, phân raCuCl
[CuCl3]2-(aq)Cân bằng nghịch hướng di động, phân raCuCl
D.Vì đề cao sản suất cùng độ tinh khiết, nhưng chọn dùng etanol gột rửa, chân không khô ráo
Xem xét đáp án giải hòa tích >>
Khoa: Nơi phát ra: Đề hình:
【 đề mục 】Tìm tòi nghiên cứuMg(OH)2Hòa tan cân bằng khi, lợi dụng hạ biểu ba loại thuốc thử tiến hành thí nghiệm, dưới đây cách nói trung không chính xác chính là ()
Đánh số | ① | ② | ③ |
Phân tán chất | Mg(OH)2 | HCl | NH4Cl |
Ghi chú | Dung dịch vẩn đục | 1mol/L | 1mol/L |
A.Hướng ① trung tích nhập vài giọt Phenolphthalein thí dịch sau, dung dịch hiện màu đỏ thuyết minhMg(OH)2Là một loại nhược chất điện phân
B.Vì sửMg(OH)2Dung dịch vẩn đục hòa tan đến càng mau, gia nhập quá liềuNH4ClNùng dung dịch cũng đầy đủ chấn động, hiệu quả càng tốt
C.①, ③ hỗn hợp sau phát sinh phản ứng:![]()
D.Hướng ① trung gia nhập ②,H+CùngOH-Phản ứng sinh thànhH2O,Sửc(OH-)Giảm nhỏ,Mg(OH)2Hòa tan cân bằng hướng hòa tan phương hướng di động
Xem xét đáp án giải hòa tích >>
Baidu tin nổi-Luyện tập sách danh sách-Đề thi danh sách
Hồ Bắc tỉnh internet trái pháp luật cùng bất lương tin tức cử báo ngôi cao|Trên mạng có hại tin tức cử báo chuyên khu|Điện tín lừa dối cử báo chuyên khu|Thiệp lịch sử hư vô chủ nghĩa có hại tin tức cử báo chuyên khu|Thiệp xí xâm quyền cử báo chuyên khu
Trái pháp luật cùng bất lương tin tức cử báo điện thoại: 027-86699610 cử báo hộp thư: 58377363@163