Natri clorua
| Natri clorua | |
|---|---|

| |

| |
| IUPAC danh Sodium chloride | |
| Tiếng Anh danh | Sodium chloride |
| Biệt danh | Muối ăn, thạch muối, muối, dùng ăn muối |
| Phân biệt | |
| CAS hào | 7647-14-5 |
| PubChem | 5234 |
| ChemSpider | 5044 |
| SMILES |
|
| InChI |
|
| InChIKey | FAPWRFPIFSIZLT-REWHXWOFAE |
| Beilstein | 3534976 |
| Gmelin | 13673 |
| EINECS | 231-598-3 |
| ChEBI | 26710 |
| RTECS | VZ4725000 |
| KEGG | D02056 |
| MeSH | Sodium+chloride |
| Tính chất | |
| Công thức hoá học | NaCl |
| Moore chất lượng | 58.44277 g·mol⁻¹ |
| Vẻ ngoài | Màu trắng hoặc vô sắc tinh thể hoặc bột phấn[1] |
| Mật độ | 2.17 g/cm³ ( cố )[1] |
| Điểm nóng chảy | 802.018 °C ( 1075.168 K )[1] |
| Điểm sôi | 1465 °C ( 1738.15 K )[1] |
| Hòa tan tính(Thủy) | 36.0 g/100 g (25 °C)[1] |
| Hòa tan tính | Hơi hòa tanEtanol( tường thấy “Tính chất vật lý” một tiết )[1] |
| Chiết quang độn D |
1.55 ( 500 nm )[2] |
| Kết cấu | |
| Tinh thể kết cấu | Mặt tâm lập phương kết cấu[1] |
| Tinh cách hằng số | a= 564pm[3] |
| Xứng vị bao nhiêu | Khối bát diện |
| Tính nguy hiểm | |
| Cảnh kỳ thuật ngữ | R:R36 |
| An toàn thuật ngữ | S: Vô |
| NFPA 704 | |
| Đến chết lượng hoặc độ dày: | |
LD50(Trung vị liều thuốc)
|
3 g/kg ( khẩu phục, đại chuột )[4] |
| Tương quan vật chất | |
| Mặt khácI-on âm | Flo hóa Natri,Xú hóa Natri, Iốt hóa Natri |
| Mặt khácDương ly tử | Clo hóa Lithium,Clo hóa Kali, Clo hóa như,Clo hóa Xêsi, Clo hóa Magie,Clo hóa Canxi, Clo hóa bối |
| Tương quanMuối | Ất toan Natri |
| Nếu không phải ghi chú rõ, sở hữu số liệu đều xuất từTiêu chuẩn trạng thái ( 25 ℃, 100 kPa )Hạ. | |
Natri clorua(Công thức hoá học:NaCl), tục xưng muối ăn, muối, là một loạiLy tử hoá chất.Natri ly tửCùngClo ly tửNguyên tử chất lượngPhân biệt vì 22.99 cùng 35.45g/mol,Nói cách khác 100g natri clorua trung đựng 39.34 g Natri cùng 60.66 g Clo. Natri clorua làNước biểnTrungMuối phânChủ yếu tạo thành bộ phận, nó tồn tại cũng khiến cho nước biển có này đặc cóVị mặn.Natri clorua cũng làTế bào ngoại dịchChủ yếu muối loại, 0.9% natri clorua thủy dung dịch tục xưng vìNước muối sinh lí.Này nhưng dùng ăn hình thái làMuối ănChủ yếu thành phần, đa dụng vớiĐồ ănGia vị cùng bảo tồn.
Ở công nghiệp trung, chủ yếu dùng cho chế tạoSodium hydroxideCùngCloCùng với ứng dụng vớiPolyvinyl chloride,Plastic,Mái chèo( bột giấy ) chờ rất nhiều mặt khácSản phẩmSinh sản quá trình. Bởi vì nó có thể hạ thấpThủyĐiểm nóng chảy,Ngẫu nhiên cũng dùng cho tuyết tan đóng băng mặt đường.
Natri cloruapHLà 7.
Sinh sản[Biên tập]
Các loại hoá chất sinh sản[Biên tập]
Natri clorua là các loạiPhản ứng hoá họcSinh sản trung ( mặc kệ là trực tiếp vẫn là gián tiếp sử dụng ) không thể thiếuNguyên liệu.
Clo kiềm pháp[Biên tập]
TừĐiện giảiBão hòaMuối ănThủy dung dịchChế lấySodium hydroxide,Khí CloCùngHydroCông nghiệpSinh sản phương pháp, là quan trọng cơ sởCông nghiệp hoá họcChi nhất. Này phản ứng như sau:
Amonia kiềm pháp[Biên tập]
Cũng kêuThor duy pháp,Là công nghiệp sinh sảnSodaChủ yếu phương pháp. Này phản ứng yêu cầuNatri cloruaCùngĐá vôi,Này sản vật làClo hóa CanxiCùngSoda.
Liên hợp chế kiềm pháp[Biên tập]
Cũng kêuHầu thị chế kiềm pháp,Đồng dạng là công nghiệp sinh sảnSodaChủ yếu phương pháp. Này phản ứng yêu cầu natri clorua,CO2CùngNH₃,Này sản vật là phân đạmClo hóa AmoniCùngNatri bicarbonat,Lại kinh đun nóng sử natri bicarbonat phân giải vì soda.
Nước cứng mềm hoá[Biên tập]
Nước cứng( như nước giếng ) đựng đại lượngMagieLy tử cùngCanxiLy tử. Nước cứng có rất nhiều nguy hại, bao gồm hạ thấpNước giặt quần áoHiệu quả cùng tắcThủy quản,Bởi vậy yêu cầu dùngLy tử trao đổi nhựa câyĐem này đổi thành ra tới. Natri clorua dùng cho đổi mới đã mất hiệuLy tử trao đổi nhựa cây,Làm này có thể lặp lại sử dụng.
Tinh thể kết cấu[Biên tập]

Natri clorua tinh thể bên trong kết cấu, là nhân loại thí nghiệm cái thứ nhấtTinh thể kết cấu[5].Natri cloruaTinh thểHình thành lập thể đối xứng, mỗi cáiLy tửCó sáu cái liền nhau ly tử, tạo thành một cái khối bát diện. NàyTinh thể kết cấuTrung, trọng đạiCloLy tử xếp thành lập phươngNhất mật chồng chất( ccp ), nhỏ lạiNatriLy tử tắc bỏ thêm vàoCloLy tử chi gian khối bát diện khe hở. Mỗi cái ly tử chung quanh đều bị sáu cái mặt khác ly tử vây quanh. Loại này kết cấu cũng tồn tại với mặt khác rất nhiều hoá chất trung, xưng là natri clorua hình kết cấu.
| Tên | Tiếng Anh danh | Danh hiệu | Tinh cách kết cấu | Tinh hệ | Xứng vị | Nêu ví dụ | Sơ đồ( điểm đánh nhưng phóng đại ) |
|---|---|---|---|---|---|---|---|
| Natri clorua kết cấu | NaClstructure | B1 hình | Mặt tâm lập phương tinh cách | Lập phương tinh hệ | [a] | [b] | 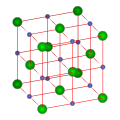
|
Natri clorua tinh thể chủ yếu có mang chínhĐiện tíchNa+Cùng mang điện tích âm Cl−Tạo thành, Na+Cùng Cl−Ở lẫn nhau vuông góc 3 cái phương hướng thượng mặt bằng thượng lấy 1:1 tỉ lệ đều đều phân bố, mỗi cái phương hướng thượng mặt bằng thượng điện tích tổng đại số vì 0, xưng là “Điện tính trung hoà mặt”. “Điện tính trung hoà mặt” nộiTĩnh điện lựcSo cường, nhưng lẫn nhau song song liền nhau “Điện tính trung hoà mặt” chi gian tĩnh điện lực yếu kém, dẫn tới natri clorua tinh thể giải lý dọc theo này 3 cái cho nhau vuông góc phương hướng sinh ra. Bởi vậy, đương natri clorua tinh thể đã chịu ngoại lực phát sinh tan vỡ khi, dễ dàng dọc theo này 3 cái phương hướng tan vỡ khai hình thành một cái vuông góc “Ba mặt lõm giác”.
Tính chất[Biên tập]

Tính chất vật lý[Biên tập]
Natri clorua ở đa số dưới tình huống là màu trắng bột phấn, này kết tinh là nửa trong suốtHình lập phương,Nhưng cũng khả năng sẽ nhân tạp chất mà bày biện ra lam hoặc tím sắc điệu. Natri clorua mạc nhĩ chất lượng là 58.443g/mol, điểm nóng chảy vì 801 °C ( 1,474 °F ), điểm sôi vì 1,465 °C ( 2,669 °F ), mật độ là mỗi lập phương centimet 2.17 khắc.Mạc thị độ cứngVì 2~2.5.[6][7]
Natri clorua dễ hòa tan thủy, nhiệt độ bình thường hạ ở trong nướcĐộ hoà tanLà 359 khắc / thăng. Muối ăn thủy tính chất vật lý cùng nước cất có trọng đại sai biệt. Thường áp xuống, thủy muối hệ thốngThấp cộng điểm nóng chảyVì −21.12 °C ( −6.02 °F ), thấp cộng nóng chảy vật trung muối chất lượng điểm vì 23.31%[c].Nên chất lượng điểm muối ăn nước sôi điểm ước vì 108.7 °C ( 227.7 °F )[8].Natri clorua dung dịch PH giá trị không phải vừa lúc tương đương 7, mà là coi độ dày, độ ấm cập độ tinh khiết mà định, xen vào 5.6 đến 8.4 chi gian[9].
Căn cứ sigma Aldrich vật chất tư liệu biểu: Natri clorua trong nước độ hoà tan vì (25°C) 357 mg/ml, 100°C vì 384 mg/ml. Bão hòa muối ăn thủy chi mật độ vì (25°C) 1.202 g/ml.
Y này đổi 25°C bão hòa muối ăn thủy mỗi một lập phương cm hàm 316.223 mg chi natri clorua.
( võng trên đường chi bão hòa sinh lý muối ăn thủy mật độ sai lầm thật nhiều, đẩy đánh giá vì dạy học hiện trường mật độ khảo đề diễn sinh chi sai lầm )
| Natri clorua ở bất đồngDung dịchTrungĐộ hoà tan g / 1 kg, 25℃[10] | |
|---|---|
| Thủy | 360 |
| Giáp tiên án | 94 |
| Cam du | 83 |
| 1,2- propylene glycol | 71 |
| Axit formic | 52 |
| Amoniac lỏng | 30.2 |
| Metanol | 14 |
| Etanol | 0.65 |
| Nhị nhóm methyl giáp tiên án | 0.4 |
| 1- Bính thuần | 0.124 |
| Hoàn đinh phong | 0.05 |
| 1- đinh thuần | 0.05 |
| Dị Bính thuần | 0.03 |
| 1- mậu thuần | 0.018 |
| Ất kinh | 0.003 |
| Aceton | 0.00042 |
| Độ ấm | °C | 800 | 850 | 900 | 1000 | 1100 |
| Dẫn điện suấtσ | S·m−1 | 3,58 | 3,75 | 3,90 | 4,17 | 4,39 |
Tính chất hoá học[Biên tập]

Natri clorua là một loạiLy tử hoá chất,Công thức hoá họcVì,Đại biểuNatri ly tửCùngClo ly tửTỉ lệ là một so một, chi gian dựaLy tử kiệnKết hợp. Natri nguyên tử đem này3s tháiĐiện tử chuyển dời đến Clo nguyên tử 3d thái thượng, hai người đều đạt tới ổn định điện tử kết cấu. Mang điện dươngNatri ly tửCùng mang điện âmClo ly tửLẫn nhau hấp dẫn, ổn định kết hợp ở bên nhau[13].
Natri clorua dung với thủy khi, hoàn toàn điện ly vì Natri ly tử cùng Clo ly tử[14].Bọn họ sẽ sử nước cất dựaHydro kiệnKiện hợp hình thành bình thường kết cấu ( tứ phía thể sắp hàng ) lọt vào phá hư[15].Na+Cùng thủy phân tử kết hợp lực lớn ước là thủy phân tử gian hydro kiện 4 lần[d].[16]
Từ lãnh dung dịch trung phân ra muối giữa, mỗi cái muối phần tử có chứa hai cáiTinh thể ngậm nước:NaCl·2H2O.
Natri clorua dung dịch kiểm nghiệm nhưng phân hai bước hoàn thành. Đầu tiên, hướng dung dịch trung tích nhậpAxit nitricToan hóa quáAxit nitric bạcDung dịch, có màu trắng lắng đọng lại (Clo hóa bạc) sinh ra, chứng minh có Cl-.Sau đó dùng bạc ti chấm lấy chút ít dung dịch, đặt đèn cồn thượng bỏng cháy, ngọn lửa trình màu vàng, nhưng chứng đựng Na+.[17]
| Chế lấy kim loại Natri | |
| Điện giảiBão hòa muối ăn thủy | |
| CùngAxit nitric bạcPhản ứng | |
| Natri clorua thể rắn trung gia nhậpAxit đậm đặc |
Chế pháp[Biên tập]
Nước biểnCùngHồ nước mặnLà natri clorua chủ yếu nơi phát ra.
- Bốc hơi hàm thủy ( như phơi nắng nước biển ), ở thủy không có hoàn toàn chưng làm trước lự ra natri clorua tinh thể. Thích hợp đại lượng sinh sản.[18]
- Chút ít tinh chế: Đem muối thô hòa tan với trong nước, lọc rớt không dung tính tạp chất, lại thêm tinh chế tề nhưNaOH,Na2CO3CùngCaCl2Chờ, sửSO42−,Ca2+,Mg2+Chờ hòa tan được tính tạp chất chuyển hóa thành lắng đọng lại, cũng lự trừ. Cuối cùng dùngAxit clohidricĐem pH điều tiết đến 7 dưới, chưng làm dung dịch, được đến natri clorua tinh thể.
- Phòng thí nghiệm chế bị phương pháp: Đem quá liềuAxit clohidricCùngSodium hydroxide,Natri bicarbonat,Oxy hoá NatriHoặcSodaChờ Natri muốiThủy dung dịchHỗn hợp, hoặc đem peroxy hóa hydro cùng thứ Clo toan Natri dung dịch hỗn hợp, chưng làm dung dịch, phân ra natri clorua tinh thể.
- HCl(aq)+NaOH(aq)→NaCl(aq)+H₂O(l)
- HCl(aq)+NaHCO₃(aq)→NaCl(aq)+CO₂(g)+H₂O(l)
- 2HCl(aq)+Na₂O(s)→2NaCl(aq)+H₂O(l)
- 4HCl(aq)+2Na₂O₂(s)→4NaCl(aq)+O₂(g)+2H₂O(l)
- 2HCl(aq)+Na₂CO₃(aq)→2NaCl(aq)+CO₂(g)+H₂O
- H₂O₂(aq)+NaClO(aq)→NaCl(aq)+O₂(g)+H₂O(l)
- Đem kim loại Natri bỏ vào axit clohidric, chưng càn dung dịch, được đến natri clorua tinh thể.
- 2HCl(aq)+2Na(s)→2NaCl(aq)+H₂(g)
- Nhưng đây là nổ mạnh tính phản ứng, giống nhau sẽ không sử dụng.
- Đem kim loại Natri đun nóng, để cạnh nhau tiến khí Clo trung hỗn hợp, được đến natri clorua tinh thể.
- 2Na(s)+Cl₂(g)→2NaCl(s)
Sử dụng[Biên tập]
Này điều mụcYêu cầu đổi mới.(2024 năm 3 nguyệt 19 ngày) |
Natri clorua sử dụng thực quảng, sử dụng lượng cũng đại. Căn cứ 1974 năm thống kê số liệu, nước Mỹ sinh sản natri clorua trung chỉ có 2.7% làm gia dụng muối ăn bán ra, 16.6% dùng cho mặt đườngTrừ băng[19],4.2% dùng cho động vật thức ăn chăn nuôi, 1.8% dùng choNước cứng mềm hoá,Còn thừa 60% trở lên đều bị dùng cho công nghiệp sinh sản[20].

Ăn uống[Biên tập]
Natri clorua có thể sinh ra nhân loại có thể cảm giácVị mặn,Là một loại thường thấyGia vị liêu.Muối ăn trung giống nhau đựng 97 đến 99% natri clorua[21][22].Ngoài ra,Muối biểnCập mới mẻ khai thác thạch muối ( đa số đến từ tiền sử hải dương ) cũng đựng vi lượngNguyên tố hiếm,Này đó nguyên tố hiếm thông thường đốiKhỏe mạnhHữu ích.
Muối ăn trungNatriLà nhân thể thiết yếu chất dinh dưỡng chi nhất, nhưng thu lấy quá liều muối ăn dễ đếnCao huyết áp[23],Hoặc cái khácTâm huyết quản bệnh tật[24].Tổ chức Y tế Thế giới (WHO)Kiến nghị, người trưởng thành mỗi ngày ứng thu lấy thiếu với 2 khắc Natri, tương đương với 5 trợ tiêu muối[25].
Y học[Biên tập]
Natri clorua đối với trên địa cầuSinh mệnhTrọng yếu phi thường. Đại bộ phậnSinh vậtTổ chức trung đựng nhiều loạiMuốiLoại. Natri ly tử ở trong cơ thể phụ trách điều tiếtThần kinh xúc độngTruyền.MáuTrungNatriLy tử độ dày trực tiếp quan hệ đếnThể dịchAn toàn trình độ điều tiết, độ dày thất thường sẽ dẫn tớiCao Natri huyết chứngHoặcThấp huyết Natri chứng.[26]
0.9% natri clorua thủy dung dịch xưng làNước muối sinh lí,Bởi vì nó cùngHuyết tươngCó tương đồngÁp lực thẩm thấu.Nước muối sinh líLà chủ yếu thể dịch thay thế vật, rộng khắp dùng cho trị liệu cập dự phòngMất nước[e],Cũng dùng cho tiêm tĩnh mạch trị liệu cập dự phòng huyết lượng giảm bớt tính cơn sốc.
Công nghiệp[Biên tập]
Natri clorua là vô cơ trọng hóa chất nghiệp cơ sở, ở vô cơ hóa chất trung, sử dụng muối ăn so mặt khác bất luận cái gì nguyên liệu đều phải nhiều[27].Trong đó, tiêu hao muối ăn nhiều nhất công nghệ làClo kiềm pháp,Nên công nghệ thông quaĐiện giảiMuối ăn thủy chế bịSodium hydroxide,Khí CloCùngHydro,Thông qua điện giải nóng chảy muối đạt được kim loạiNatriCùng khí Clo. Khí Clo chủ yếu bị dùng cho hợp thành hàm Clo hợp chất hữu cơ ( nhưClo Flo hydrocarbon,Polyvinyl chloride) cùng tiêu độc tẩy trắng, sodium hydroxide tắc bị rộng khắp vận dụng với vô cơ hóa chất cùngBột giấyXử lý. Một loại khác tiêu hao muối ăn lượng khá lớn công nghệ làAmonia kiềm pháp,Nên pháp thông qua hướng muối ăn trong nước rót vàoAmoniaCùngCO2Tới chế bịNatri bicarbonat,Tiến tới chế bịSoda.Đại bộ phận soda bị dùng cho chế tạoPha lê.[28]
- Clo kiềm công nghiệpTrung,Điện giảiNatri clorua thủy dung dịch, sinh raHydro,Khí CloCùng sodium hydroxide.
- Điện giải nóng chảy natri clorua chế bị kim loạiNatri.Nhưng gia nhậpTrợ dung môi( nhưClo hóa Canxi) hạ thấp điểm nóng chảy.
- Amonia kiềm pháp,Liên hợp chế kiềm phápTrung, natri clorua cùng CO2, NH₃ cùng nhau chế bị soda.
Con đường[Biên tập]
Dùng cho mặt đườngTrừ băngLà trừ bỏ công nghiệp sinh sản ở ngoài muối chủ yếu sử dụng.
Chú thích[Biên tập]
- ^Na+CùngCl−Ly tửChung quanh đều từ 6 cái dị hàoLy tửẤnKhối bát diệnPhương thứcXứng vị.
- ^Hàng trămHai nguyên tố hoá chất,NhưKho hóa vật,Oxy hoá vật,Sunfua,Selen hóa vật,Nitro hóa vậtCùngChưng khô vậtTrung, rất nhiều đều là B1 hình.
- ^Thấp cộng điểm nóng chảy là nước muối có thể đạt tới thấp nhất độ ấm. Chất lượng điểm lớn hơn 23.31% nước muối ở làm lạnh đến nên độ ấm phía trước sẽ phân ra muối ( hoặc này vật thuỷ hoá ), chất lượng điểm nhỏ hơn 23.31% nước muối ở làm lạnh đến nên độ ấm phía trước tắc sẽ phân ra băng.
- ^Nhưng loại này tác dụng thấp hơn cộng giới kiện cường độ.
- ^Nhân loạiCùng mặt khácLinh trưởng loạiBất đồng, nhân loại thông qua ra mồ hôi phân bố đại lượng natri clorua.
Tham khảo tư liệu[Biên tập]
- ^1.01.11.21.31.41.51.6CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–85.ISBN1-4987-5428-7( tiếng Anh ).
- ^RefractiveIndex.INFO:Refractive index of NaCl (Sodium chloride)(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- ^W.T.Barrett, W.E.Wallace:Studies of NaCl-KCI Solid Solutions. I. Heats of Formation, Lattice Spacings, Densities, Schottky Defects and Mutual Solubilities.In:Journal of the American Chemical Society76(2),1954,S. 366–369,doi:10.1021/ja01631a014
- ^Tucker, R. K.; Haegele, M. A. Comparative acute oral toxicity of pesticides to six species of birds. Toxicology and Applied Pharmacology. 1971,20(1): 57–65.ISSN 0041-008X.PMID 5110827.doi:10.1016/0041-008x(71)90088-3.
- ^Natri clorua tinh thể kết cấu.Trung Quốc con số khoa học kỹ thuật quán.[2017-10-23].( nguyên thủy nội dungLưu trữVới 2020-05-02 ).
- ^Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G.Alkali halides: a handbook of physical properties.Springer. 2001: 65, 68[2017-10-23].ISBN3-540-42180-7.( nguyên thủy nội dungLưu trữVới 2016-09-04 ).
- ^Natri clorua ( NaCl ) tinh thể.Cát Lâm quang chính tinh thể công ty hữu hạn.[2017-10-23].(Nguyên thủy nội dungLưu trữ với 2017-10-24 ).
- ^Elvers, B.et al.(ed.) (1991) Ullmann's Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319,ISBN 978-3-527-20124-2.
- ^L Shu, IJ Obagbemi, S Liyanaarachchi, D Navaratna, R Parthasarathy, V Jegatheesan (2016) Why does pH increase with CaCl2 as draw solution during forward osmosis filtration,Process Safety and Environmental Protection 104, 465–471
- ^Burgess, J.Metal Ions in Solution.New York: Ellis Horwood. 1978.ISBN0-85312-027-7.
- ^G. Westphal, G. Kristen, W. Wegener, P. Ambatiello, H. Geyer, B. Epron, C. Bonal, G. Steinhauser, F. Götzfried:Sodium Chloride,in:Ullmanns Enzyklopädie der Technischen Chemie,Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012;doi:10.1002/14356007.a24_317.pub4.
- ^Klewe, B.; Pedersen, B. The crystal structure of sodium chloride dihydrate. Acta Cryst. 1974,B30:2363–2371.doi:10.1107/S0567740874007138.
- ^Vương côn lâm. Tài liệu công trình cơ sở. Đại học Thanh Hoa nhà xuất bản.: 44.ISBN7302070644.
- ^Wood, Frank Osborne.Salt (NaCl).Encyclopædia Britannica online.[2013-10-09].( nguyên thủy nội dungLưu trữVới 2015-05-02 ).
- ^Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) "Metal Aqua Ions" Comprehensive Coordination Chemistry II Volume 1, pp. 515–555.doi:10.1016/B0-08-043748-6/01055-0
- ^Đoạn chấn hoa. Trường cao đẳng nghiên cứu sinh giáo tài · cao cấp thực phẩm hóa học. Trung Quốc công nghiệp nhẹ nhà xuất bản. 2012.ISBN7501983844.
- ^Natri clorua.Giang Tây hoa hừ sinh vật khoa học kỹ thuật công ty hữu hạn.[2017-10-23].(Nguyên thủy nội dungLưu trữ với 2017-10-23 ).
- ^Salt(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), U.S. Geological Survey
- ^Rastogi, Nina (16 February 2010)Does road salt harm the environment?(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) slate.
- ^Westphal, Gisbertet al.(2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheimdoi:10.1002/14356007.a24_317.pub4.
- ^Tesco Table Salt 750g.Tesco.[2010-12-05].(Nguyên thủy nội dungLưu trữ với 2009-05-11 ).
Nutritional analysis provided with Tesco Table Salt states 38.9 percent sodium by weight which equals 97.3 percent sodium chloride
- ^The international Codex Alimentarius Standard for Food Grade Salt(PDF).[2011-07-07].( nguyên thủy nội dungLưu trữ(PDF)Với 2012-03-14 ).
The content of NaCl shall not be less than 97% on a dry matter basis, exclusive of additives.
- ^Khoa học sinh hoạt: Phòng khống cao huyết áp vì cái gì muốn “Ăn ít muối”?.Trung ương chính phủ môn hộ trang web. Khoa học kỹ thuật nhật báo. 2009-10-12[2017-10-23].( nguyên thủy nội dungLưu trữVới 2017-10-24 ).
- ^McCarron, David A.Dietary sodium and cardiovascular and renal disease risk factors: dark horse or phantom entry?.Nephrol Dial Transplant. 2008,23(7): 2133–7.PMC 2441768
 .PMID 18587159.doi:10.1093/ndt/gfn312.
.PMID 18587159.doi:10.1093/ndt/gfn312.
- ^WHO issues new guidance on dietary salt and potassium.Tổ chức Y tế Thế giới (WHO).2013-01-31. ( nguyên thủy nội dungLưu trữVới 2016-07-20 )( tiếng Anh ).
- ^Osanai T, Fujiwara N, Saitoh M, et al. Relationship between salt intake, nitric oxide and asymmetric dimethylarginine and its relevance to patients with end-stage renal disease. Blood Purif. 2002,20(5): 466–8.PMID 12207094.doi:10.1159/000063555.
- ^Dennis S. KostickSalt(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), U.S. Geological Survey, 2008 Minerals Yearbook
- ^N.N.Greenwood, A.Earnshaw, tào đình lễ đám người dịch. Nguyên tố hóa học. Giáo dục cao đẳng nhà xuất bản. 1997: Thượng sách 108-112, 144, trung sách 603-604.
Tham khảo văn hiến[Biên tập]
- Haynes, William M. ( biên ).CRC Handbook of Chemistry and Physics92nd.CRC Press.2011.ISBN978-1439855119.
Tham kiến[Biên tập]
Phần ngoài liên kết[Biên tập]
- Salt(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)United States Geological SurveyStatistics and Information
- Using Salt and Sand for Winter Road Maintenance.Road Management Journal. December 1997[2020-02-14].(Nguyên thủy nội dungLưu trữ với 2016-09-21 ).
- Calculators:surface tensions(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), anddensities, molarities and molalities(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) of aqueous NaCl (and other salts)
- JtBaker MSDS
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||











