Thổ
Sở hữu đã biếtThổ chất đồng vịToàn không ổn định, nhất ổn định232Th thời kỳ bán phân rã dài đến 140 trăm triệu năm, cùngVũ trụ tuổi tácTương đương. Nó thong thả mà đi quaα suy biếnBắt đầu tên làThổ suy biến hệSuy biến liên,Cuối cùng ngăn với ổn định208Pb.Bởi vì có thọ mệnh cực dài chất đồng vị, thổ cùngUraniCập鉍Là vũ trụ chấm đất cầu trung duy tam tồn lượng thượng caoNguyên thủy nguyên tố phóng xạ.[a]Ngoài ra, thổ cũng là trên địa cầu số lượng dự trữ phong phú nhấtNguyên tố phóng xạ,Phỏng chừng này trên mặt đất xác trungPhong độVì Urani gấp ba nhiều, sinh sản nơi phát ra chủ yếu làSống một mình thạchSa trung lấy raNguyên tố đất hiếmPhó sản vật.
Na UyNghiệp dưKhoáng vật họcGia Morten Thrane Esmark ở 1829 năm phát hiện thổ, Thuỵ Điển nhà hóa họcVĩnh tư · bối cát tưỞ giam định sau, lấyBắc Âu thần thoạiTrung Lôi ThầnThor( Thor ) mệnh danh. Thổ ở cuối thế kỷ 19 bắt đầu có điều ứng dụng, mà này tính phóng xạ ở 1900 niên đại bị quảng vì nhận tri. Ở hai mươi thế kỷ phần sau nhân lo lắng thổ tính phóng xạ, này rất nhiều sử dụng đều bị thay thế được.
Thổ là鎢 cực khí thể bảo hộ hồ quang hạnTrung, điện cực hợp kim nguyên tố, nhưng này sử dụng dần dần bị thay thế được. Thổ cũng bị ứng dụng ở khoa học dụng cụ trung cao giai quang học thiết bị, cùng vớiĐèn bân-sânCái lồng khí,Nhưng này đó dùng lượng đều rất nhỏ. Bởi vì số lượng dự trữ đầy đủ, có người kiến nghị dùng thổ thay thế được Urani làmPhản ứng hạt nhân lòNhiên liệu, đã có mấy cáiThổ phản ứng lòBị kiến tạo.
Chỉnh thể tính chất
[Biên tập]ThổĐộ cứngGiống nhau, cụThuận từ tính,Vì lượng màu bạc tính phóng xạ kim loại nguyên tố. ỞBảng chu kỳTrung, nằm ở錒Chi hữu,鏷Chi tả,CeriumDưới. Thuần thổCó thể kéo dài và dát mỏngTương đương hảo, Cùng giống nhau kim loại giống nhau, nhưng bịLãnh cán,Tễ rèn cập kéo chế.[4]Ở nhiệt độ phòng hạ, thổ kim loại vìMặt tâm lập phương chồng chất,Nó có cái khác hai loại hình thái, một cái ở cực nóng ( vượt qua 1360 °C,Thể tâm lập phương chồng chất), một cái ở cao áp ( ước 100 GPa,Thể tâm tứ phương chồng chất).[4]
Thổ kim loạiThể tích mô số( một loại vật chất có bao nhiêu khó áp súc độ lượng ) vì 54GPa,CùngTíchMời đi cùng ( 58.2 GPa ).NhômVì ( 75.2 GPa ),ĐồngVì 137.8 GPa, thép mềm ( thấp than cương ) tắc vì 160–169 GPa.[5]Thổ độ cứng cùng thép mềm không sai biệt lắm, cho nên đun nóng sau nhưng bị lăn thành phiến cập kéo chế thành tuyến.[6]
Thổ mật độ ước vìUraniCập鈽Một nửa, nhưng độ cứng so hai người cao.[6]Độ ấm ở 1.4KDưới lúc ấy biến thànhChất siêu dẫn.[4]Thổ điểm nóng chảy vì 1,750 °C, so錒( 1,227 °C ) cập 鏷 đều tới cao ( 1,568 °C ). ỞThứ bảy chu kỳTrước đoạn, từ鍅Đến thổ, điểm nóng chảy dần dần bay lên ( cùng với nó chu kỳ tương đồng ), đây là bởi vì nguyên tử trung phi định vực điện tử số lượng từ 鍅 một viên gia tăng đến thổ bốn viên, này dẫn tới kim loại điện tích từ +1 gia tăng đến +4, mà điện tử cùng kim loại ly tử lực hấp dẫn cũng bởi vậy bay lên. Ở thổ lúc sau thẳng đến 鈽, điểm nóng chảy bắt đầu giảm xuống, f điện tử số lượng cũng từ 0.4 tả hữu gia tăng đến 6 tả hữu, đây là bởi vì 5f quỹ vực cập 6d quỹ vực hỗn thành tỉ lệ gia tăng, ở càng phức tạp tinh thể kết cấu trung hình thành có phương hướng liên kết hoá học mà nhược hóa kim loại kiện.[6][7]( thổ bên trong f điện tử số lượng đều không phải là số nguyên, bởi vì 5f cập 6d chi gian có trùng điệp )[7]Ở 錒 hệ nguyên tố, ở鉲Phía trước cũng nhưng ở mg cấp bậc hạ làm phân tích nguyên tố trung, thổ tắc có tối cao điểm nóng chảy điểm sôi, cùng với đệ nhị thấp mật độ, chỉ có 錒 so thổ nhẹ. Thổ điểm sôi vì 4,788 °C, ở sở hữu đã biết điểm sôi nguyên tố trung là thứ năm cao.[b]
Thổ tính chất sẽ nhân hàng mẫu trung tạp chất hàm lượng bất đồng mà có trên diện rộng biến hóa, chủ yếu tạp chất thông thường làNhị oxy hoá thổ( ThO2), cho dù là nhất thuần thổ hàng mẫu, thông thường cũng đựng ước chừng một phần ngàn oxy hoá vật.[4]Thực nghiệm đo lường ra mật độ giới với 11.5 cập 11.66 g/cm3Chi gian, lược tiểu với lý luận đoán trước giá trị 11.7 g/cm3,Này có lẽ là bởi vì ở chế thành kim loại khi hình thành vi mô lỗ trống.[4]Này đó giá trị nằm ở sát vách 錒 ( 10.1 g/cm3) cập 鏷 ( 15.4 g/cm3) chi gian, cũng phù hợp 錒 hệ trước đoạn nguyên tố xu thế.[4]
Thổ nhưng cùng rất nhiều kim loại hình thànhHợp kim.Gia nhập chút ít thổ có thể gia tăngMagieMáy móc cường độ, thổ nhôm hợp kim bị cho rằng là một loại trong tương lai thổ phản ứng hạt nhân lò tới chứa đựng thổ phương pháp. Thổ cùng 鉻 cập Urani hình thànhCộng nóng chảy chất hỗn hợp,Cũng cùng so nhẹ cùng tộc nguyên tố Cerium ở trạng thái dịch cập trạng thái cố định đềuHoàn toàn hoà tan.[4]
Tính chất hoá học
[Biên tập]Thổ nguyên tử có 90 cái điện tử, trong đó bốn cái điện tử vìGiới điện tử.Lý luận thượng giới điện tử có ba cáiNguyên tử quỹ vựcCó thể điền: 5f, 6d cập 7s.[9]Cứ việc thổ nằm ở bảng chu kỳ trungf khu khối,Nó cơ thái có dị thường [Rn]6d27s2Điện tử hình thể. 5f cập 6d tử xác tầng ở lúc đầu 錒 hệ nguyên tố trung năng lượng tương đương tiếp cận, thậm chí so lan hệ nguyên tố trung 4f cùng 5d tử xác tầng còn gần, mà thổ 6d tử xác tầng so 5f tử xác tầng năng lượng thấp, bởi vì nó 5f tử xác tầng vẫn chưa bị hoàn toàn lấp đầy 6s cập 6p tử xác tầng tốt đẹp che đậy, cho nên so không ổn định. Đây là bởi vìThuyết tương đối hiệu ứng,Càng chính xác nói làSự quay tròn - quỹ đạo tác dụng,Ở bảng chu kỳ cái đáy trở nên càng vì quan trọng. Thổ nguyên tử 5f, 6d cập 7s năng lượng gần, dẫn tới thổ cơ hồ tổng hội mất đi nó bốn cái giới điện tử, cũng bị vây nó tối cao khả năng oxy hoá thái +4. Này cùng thổ cùng tộc lan hệ nguyên tố Cerium bất đồng, Cerium tối cao oxy hoá thái cũng là +4, nhưng là +3 oxy hoá thái càng vì quan trọng cũng càng vì ổn định. So với Cerium, thổ tự do có thể cùng oxy hoá hoàn nguyên điện vị càng như là quá độ kim loại 鋯 cập 鉿, cho nên thổ tính chất hoá học cũng là giống 鋯 cập 鉿. Loại này cùng loại với quá độ kim loại tính chất là nửa đoạn trước 錒 hệ nguyên tố thông tính.[10][11]
Th4+:__/ O2−:__
Tuy rằng trạng thái khí thổ nguyên tử có dị thường điện tử hình thể, 5f ở thổ kim loại sắm vai quan trọng nhân vật. Này đầu tiên ở 1995 năm bị nhận thức đến, nếu thổ điện tử hình thể là [Rn]6d27s2,Thả 5f quỹ vực ởPhí mễ có thể giaiPhía trên, như vậy thổ tinh thể kết cấu sẽ như là4 tộc nguyên tốThái, 鋯 cập 鉿 giống nhau, làSáu phương nhất mật chồng chất,Mà không phải trên thực tế mặt tâm lập phương chồng chất. Chỉ có ở suy xét 5f lúc sau, mới có thể giải thích chân thật tinh thể kết cấu. Thổ +3 oxy hoá thái điện tử hình thể [Rn]5f1,5f ở này hi hữu cùng cực không ổn định sắm vai nhân vật cũng rất rõ ràng.[12]
Bốn giới thổ hoá chất nhan sắc thông thường là vô sắc hoặc là màu vàng, như làBạcHoặc chì giống nhau, bởi vì Th4+Cũng không có 5f hoặc là 6d điện tử.[6]Cho nên thổ hóa học nội dung, đại bộ phận là dễ mang điện dương kim loại, hình thành một cáiPhản từ tínhThả có ổn định khí trơ hình thể ly tử, này ám chỉ thổ cập s khu khốiChủ tộc nguyên tốTương tự tính.[13][c]Thổ cùng Urani là nhất thường bị tham thảo nguyên tố phóng xạ, bởi vì chúng nó tính phóng xạ cũng đủ thấp, không cần đặc biệt xử lý.[14]
Phản ứng tính
[Biên tập]Thổ phản ứng tính cực cao, hơn nữa là dễ mang điện dương kim loại. Th4+/Th tiêu chuẩn hoàn nguyên điện vị vì −1.90 V, thổ điện chính độ so鋯CậpNhômCàng cao.[15]Cắt thành tế khối thổ kim loại sẽTự cháy.[4]Đương ở trong không khí bị đun nóng khi, thổ tiết sẽ bị bậc lửa, diễm sắc vì lượng bạch quang cũng sinh ra nhị oxy hoá thổ. Khối trạng thuần thổ cùng không khí phản ứng tắc tương đối thong thả, tuy rằng ở mấy tháng sau có khả năng phát sinh ăn mòn hiện tượng. Phần lớn thổ hàng mẫu đều đựng bất đồng trình độ nhị oxy hoá thổ, mà nhanh hơn ăn mòn quá trình.[4]Này đó hàng mẫu sẽ dần dần mất đi ánh sáng, mặt ngoài biến hôi cuối cùng biến thành màu đen.[4]
ỞTiêu chuẩn trạng huốngHạ, thổ sẽ dần dần bị thủy ăn mòn, nhưng sẽ không nhanh chóng dung với phần lớn thường thấy toan trung, trừ bỏHydro Clo toanBên ngoài, thổ sẽ dung với trong đó, cũng lưu lại màu đen không thể dung tàn lưu vật ThO(OH,Cl)H.[4][16]Thổ sẽ dung với đựng chút ítFlo ly tửHoặcFlo tịch toanNùngAxit nitricTrung,[4][17]Nếu không chứa này hai người, tắc sẽ giống Urani, 鈽 giống nhau bị axit nitricĐộn hóa.[4][18][19]

Th4+:__/ F−:__
Vô cơ hoá chất
[Biên tập]Phần lớn thổ cùng phi kim loại hai nguyên tố hoá chất, nhưng dùng đun nóng chất hỗn hợp phương thức chế bị.[20]Ở trong không khí, thổ sẽ thiêu đốt hình thành ThO2,Tinh thể kết cấu vìHuỳnh thạchKết cấu.[21]Nhị oxy hoá thổ làVật liệu chịu lửa,Ở sở hữu oxy hoá vật trung có tối cao điểm nóng chảy ( 3390 °C ).[22]Nó sẽTan,Cũng sẽ cùng thủy cùng rất nhiều khí thể nhanh chóng phản ứng,[23]Cũng dễ dung với hàm Flo ly tử nùng axit nitric trung.[24]
Đương đun nóng khi, nhị oxy hoá thổ sẽ thả ra cường lam quang, cùng với so nhẹ cùng tộc hoá chấtNhị oxy hoá CeriumHỗn hợp khi, quang sẽ biến thành màu trắng. Đây là qua đi thổ nhất thường thấy ứng dụng, cũng chính là bị dùng với khí than võng tráo nguyên lý.[23]Này hiệu quả không cần ngọn lửa, ở 1901 năm, mọi người phát hiện Welsbach khí than võng tráo ( từ ThO2Cùng 1% CeO2Tạo thành ), ở bại lộ ở lãnh chưa gas thể[ cái nào / này đó? ]Cùng không khí bên trong khi, sẽ duy trì ở toàn quang trạng thái.[25]Nhị oxy hoá thổ phát ra quang bước sóng, so cùng ôn hạBạch síVật phát raThể chữ đậm nét phóng xạĐoản, này hiện tượng gọi vìCường nhiệt sáng lên.Đây là bởi vì nhị oxy hoá thổ cùng Cerium ở trong ngọn lửa cao độ dàyTự do cơMột lần nữa kết hợp trung sắm vai chất xúc tác nhân vật, cái này kết hợp sẽ thả ra đại lượng năng lượng. 1% nhị oxy hoá Cerium gia nhập, tăng mạnh ánh sáng mắt thường nhìn thấy được khu phóng ra suất. Ngoài ra Cerium không giống thổ, nó có thể bị vây nhiều oxy hoá thái, nó giới số cập ánh sáng mắt thường nhìn thấy được phóng ra suất sẽ cùng ngọn lửa phát sinh khu vực có quan hệ ( khu vực bất đồng, hóa học tạo thành bất đồng, giới số cũng bất đồng ).[25]Đã phát hiện mấy cái thổ cùng oxy tộc ( lưu, selen cập đế ) hoá chất, cùng với cùng oxy tộc ( lưu, selen cập đế ) cập oxy kết hợp hoá chất.[26]
Sở hữu bốn loại bốn kho hóa thổ hoá chất đều tồn tại, cũng có một ít giá thấp số xú hóa vật cập lođua.[27]Bốn kho hoá chất đều là tám xứng vị cũng đều nhưng tan, dễ dung với như là thủy tính có cực dung môi.[28]Rất nhiều tương quan nhiều kho hóa vật ly tử cũng đã bị phát hiện.[27]Bốn Flo hóa thổ có đơn nghiêng tinh hệ tinh thể kết cấu, cùngBốn Flo hóa 鋯Cập bốn Flo hóa 鉿 tương đồng, trong đó Th4+Ly tử cùng F−Ly tử lấy vặn vẹoTứ giác phản hình lăng trụPhương thức kết hợp.[27]Cái khác bốn kho hóa vật tắc có mười hai mặt thể bao nhiêu hình dạng.[28]So giá thấp số lođua như là ThI3( màu đen ) cùng ThI2( kim sắc ) có thể dùng thổ kim loại đi hoàn nguyên bốn iốt hóa thổ tới đến, chúng nó chỉ đựng Th4+Mà không chứa có Th(III) cùng Th(II), có thểĐiện tử muốiHình thức càng rõ ràng viết xuống công thức hoá học.[27]Rất nhiều Flo hóa thổ, Clo hóa thổ cập xú hóa thổ có thể cùng kiềm kim loại,Bối,鉈 cập 銨 hình thành đa nguyên kho hóa vật.[27]Chẳng hạn như, lấyFlo hóa KaliCậpAxit flohydricXử lý sau, Th4+Hình thành sai i-on âmThF2−
6,Cũng hình thành Thẩm điến vật K2ThF6.[17]
Cùng đối ứng Urani hoá chất cập 鈽 hoá chất giống nhau, Boron hóa thổ, chưng khô thổ, tịch hóa thổ, nitro hóa thổ đều là phòng cháy tài liệu. Này đó hoá chất nhân khả năng trở thànhNhiên liệu hạt nhânMà khiến cho chú ý.[20]Sở hữu bốn cái càng trọng họ ni-tơ hóa vật (Lân,Thân,ĐễCập 鉍 ) toàn lấy hai nguyên tố thổ hoá chất phương thức tồn tại. 鍺 hóa thổ cũng có bị phát hiện.[29]Thổ sẽ cùng hydro phản ứng hình thành hydro hóa thổ như là ThH2Cập Th4H15,Người sau ở độ ấm thấp với 7.5–8 K hình thành chất siêu dẫn, nhiệt độ bình thường thường áp xuống dẫn điện tính chất tắc như là kim loại.[30]Chúng nó ở nhiệt lực học thượng không ổn định, bại lộ ở không khí hoặc hơi ẩm sau sẽ thực mau phân giải.[31]
Nitro hóa thổ(Th3N4) từ nóng cháy thổ cùng trong không khíNitroPhản ứng mà thành, có đồng thau ánh sáng. Ở trong không khí nó cùng hơi nước phản ứng ở số giờ nội phân giải.[ nơi phát ra thỉnh cầu ]Thổ có ba loạiChưng khô vật,Phân biệt làThC2,Th2C3,ThC,Đều nhưng từ thổ hoặc nhị oxy hoá thổ cùng chưng khô hợp chế đến. ThC cùng ThC2Đều là phòng cháy tài liệu, điểm nóng chảy vượt qua 2600 °C.[32]

Xứng vị hoá chất
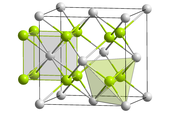
[Biên tập]Ở toan tính thủy dung dịch trung, thổ lấy bốn giới thủy ly tử [Th(H2O)9]4+Phương thức tồn tại, hình dạng vìTam sườn trùy tam giác trụ,[33][34]Ở pH < 3 khi, thổ muối dung dịch trung dương ly tử phần lớn là này hình thức.[33]Th4+Ly tử là lớn nhất bốn giới 錒 hệ nguyên tố ly tử, theo xứng vị số bất đồng, này bán kính phạm vi vì 0.95 đến 1.14 Å.[33]Nhân này cao điện tích nó tương đương toan, soÁ axítHơi cường, cho nên nó khuynh hướng tiến hành thuỷ phân cập tụ hợp ( trình độ soFe3+Nhẹ ), ở pH vì 3 hoặc càng thấp dung dịch trung, chủ yếu hình thành [Th2(OH)2]6+.Ở kiềm tính so cao dung dịch trung, sẽ tiếp tục tụ hợp thành ngưng keo trạng Th(OH)4Thẩm điến ra tới ( tuy rằng cân bằng khả năng cần số cuối tuần mới có thể đạt thành, bởi vì tụ hợp phản ứng thông thường ở Thẩm điến phía trước liền sẽ chậm lại ).[35]Thân là một cáiNgạnh Louis sĩ toan,Th4+Yêu thích Lấy oxy nguyên tử vì thi thể ngạnh xứng cơ, cùng lấy lưu nguyên tử vì thi hình thể thành sai hợp vật so không ổn định, cũng càng dễ dàng thuỷ phân.[10]
Nhân thổ kích cỡ trọng đại, cao xứng vị số vì này chủ yếu quy tắc. Năm thủy axit nitric thổ là cái thứ nhất phát hiện xứng vị số vì 11 hoá chất, bốn thủy thảo toan hóa vật xứng vị số vì 10, Boron hydro hóa vật ( ởManhattan kế hoạchLần đầu tiên chế bị ) xứng vị số tắc vì 14.[35]Này đó thổ muối lấy ở thủy cập tính có cực hữu cơ dung môi trung cao độ hoà tan mà nổi danh.[6]
Đã phát hiện rất nhiều cái khác cùng nhiều nguyên tử i-on âm hình thành vô cơ thổ hoá chất, như làQuá Clo toan muối,Axít muối,Á axít muối, axit nitric muối, than toan muối,Axit phosphoric muối,釩 toan muối,鉬 toan muối,鉻 toan muốiCập chúng nó hydro hóa hình thức.[36]Chúng nó ở thổ thuần hóa quá trình cập xử lý hạch phế liệu trung rất quan trọng, nhưng chúng nó đại đa số tính chất đều không bị toàn diện hiểu biết, đặc biệt là chúng nó kết cấu tính chất.[36]Chẳng hạn như, axit nitric thổ là đi qua hydro oxy hoá thổ cùng axit nitric phản ứng mà thành, dung với thủy cập cồn trung, ở thổ và hoá chất thuần hóa trung là quan trọng trung gian vật.[36]Thổ cùng hữu cơ xứng cơ hình thành sai hợp vật, như làAxit oxalic,Chanh chuaCùngEDTAỔn định đến nhiều. Ở tự nhiên hàm thổ trong nước, hữu cơ thổ sai hợp vật độ dày thông thường so vô cơ thổ sai hợp vật lớn hơn mấy cái số lượng cấp, cho dù vô cơ xứng cơ độ dày so hữu cơ xứng cơ cao đến lâu ngày cũng là như thế.[33]

Hữu cơ thổ hoá chất
[Biên tập]Phần lớn có quan hệ hữu cơ thổ hoá chất chuyên chú ởHoàn mậu nhị hi cơCập hoàn tân bốn hi cơ thượng. Tựa như rất nhiều trước trung đoạn 錒 hệ nguyên tố ( mãi cho đến鋂,鋦Cũng có khả năng ), thổ sẽ hình thành hoàn tân bốn hi sai hợp vật, màu vàng song ( hoàn tân bốn hi ) hợp thổ Th(C8H8)2,Nó kết cấu cùng càng nổi danh song ( hoàn tân bốn hi ) hợp Urani tương đồng.[37]Nó có thể dùng bốn Clo thổ cùng K2C8H8,ỞTHFDung môi cậpCàn băngĐộ ấm hạ phản ứng mà chế đến, cũng có thể dùng bốn Flo hóa thổ cùng MgC8H8Phản ứng.[37]Nó ở trong không khí không ổn định, cũng ở trong nước hoặc 190 °C hạ phân giải.[37]Cũng có phát hiện nửa sandwich hoá chất, như là (η8-C8H8)ThCl2(THF)2,Có dương cầm ghế kết cấu, nhưng kinh song ( hoàn tân bốn hi ) hợp thổ cập bốn Clo hóa thổ ở bốn hydro fu-ran phản ứng mà đến.[10]
Đơn giản nhất hoàn mậu nhị hi hoá chất là Th(C5H5)3Cập Th(C5H5)4,Có rất nhiều đã biết hợp chất diễn sinh. Người trước ( có hai loại hình thái, màu tím cùng màu xanh lục ) là một cái thổ hình thức oxy hoá thái vì +3 hi hữu ví dụ,[37][38]Ở mỗ hợp chất diễn sinh trung cũng tồn tại +2 hình thức oxy hoá thái.[39]Clo hợp chất diễn sinh [Th(C5H5)3Cl] nhưng kinh đun nóng bốn Clo hóa thổ cùng hạn lượng K(C5H5) ( cũng có thể sử dụng cái khác đơn giá hoàn mậu nhị hi kim loại hoá chất ) chế đến.Hoàn cơCậpPhương cơHợp chất diễn sinh nhưng từ Clo hợp chất diễn sinh được đến, cũng từng bị dùng để nghiên cứu thổ thanσ kiện.[38]
Cái khác hữu cơ thổ hoá chất vẫn chưa bị kỹ càng tỉ mỉ nghiên cứu. Đã phát hiện bốn ben-zyn thổ ( Th(CH2C6H5) ) cập bốn Propylene cơ thổ ( Th(C3H5)4), nhưng này kết cấu vẫn chưa xác định. Chúng nó ở nhiệt độ phòng hạ thong thả phân giải. Thổ sẽ hình thànhSườn trùy tam giác trụHình bảy nhóm methyl thổ căn ly tử ( [Th(CH3)7]3−), này ly tử sẽ hình thành muối loại [Li(tmeda)]3[ThMe7] ( tmeda= Me2NCH2CH2NMe2). Tuy rằng chỉ có một cái nhóm methyl chỉ nhận được thổ nguyên tử thượng ( thổ than khoảng cách vì 257.1 pm ), cái khác sáu cái cùng thổ 鋰 nguyên tử tương tiếp ( thổ than khoảng cách vì 265.5–276.5 pm ), chúng nó ở dung dịch trung tính chất biểu hiện là giống nhau. Bốn nhóm methyl thổ Th(CH3)4Vẫn chưa bị phát hiện, nhưng nóThêm hợp vậtBị膦Loại xứng thể sở ổn định.[10]
Chất đồng vị
[Biên tập]Ở鉍( 83 hào nguyên tố ) phía trước sở hữu nguyên tố, cơ hồ đều có một loại cơ hồ ở bất luận cái gì dưới tình huống đều ổn định chất đồng vị ( cổ điển ổn định ), duyĐápCập鉕( 43 hào nguyên tố cập 61 hào nguyên tố ) ngoại trừ. Mà sở hữu từ釙( 84 hào nguyên tố ) bắt đầu nguyên tố sở hữu chất đồng vị, đều có nhưng trắcTính phóng xạ.Thổ -232 là ở鉍-209Lúc sau, ba loạiThời kỳ bán phân rãLấy trăm triệu năm kế hạch loại chi nhất ( khác hai cái hạch loại làUrani -235CậpUrani -238), thổ -232 thời kỳ bán phân rã vì 140.5 trăm triệu năm, vìĐịa cầu tuổi tácGấp ba, cùngVũ trụ tuổi tácTương đương. Địa cầu ra đời khi sinh ra thổ có bốn phần năm bảo tồn đến nay.[40][41][42]232Th là duy nhất ở tự nhiên trung đại lượng tồn tại thổ chất đồng vị,[40]Này ổn định tính cùng với bếHạch xác tầngTrung 142 viênNơ-tronPhơ phất tương quan.[43][44]Thổ có riêng địa cầu chất đồng vị tỉ lệ, nàyNguyên tử lượngVì 232.0377(4). Ở trên địa cầu có cũng đủ tồn lượng mà có thể xác định tiêu chuẩn nguyên tử lượng nguyên tố phóng xạ có bốn cái, thổ vì một trong số đó ( khác ba cái vì鉍,鏷CậpUrani).[45]
Thổ hạt nhân nguyên tử sẽ bởi vì cường hạch tác dụng lực vô pháp khắc phục hạt nhân gian điện từ bài xích lực, mà phát sinhα suy biến.[46]232Th α suy biến là một 4nSuy biến liênBắt đầu, này suy biến liên trung hạch loạiHạch nhân sốĐều có thể bị 4 chia hết ( đây cũng là vì cái gì bị đặt tên vì 4n suy biến liên, này suy biến liên cũng nhân khải thủy vật vì thổ -232 mà bị gọi là thổ suy biến liên ). Này một loạt α cậpβ suy biếnLấy232Th suy biến đến228Ra vì thủy, ngăn với ổn định208Pb.[40] Bất luận cái gì thổ và hoá chất hàng mẫu, đều đựng này đó kế tiếp hạch loại dấu vết, bao gồm thổ,鉈,Chì,鉍,釙,Đông,LôiCập錒Chất đồng vị.[40]Tự nhiên thổ hàng mẫu nhưng dùng hóa học phương thức nhắc tới thuần hữu dụng kế tiếp hạch loại, như là nhưng bị dùng làmHạch y họcTrungUng thưTrị liệu212Pb, cùng với đồng dạng nhưng dùng cho α hạt tiêu bia trị liệu227Th ( sẽ lấy 18.68 thiên thời kỳ bán phân rã phóng ra ra α hạt ).[47][48][49]Ở phi thường ngẫu nhiên mà dưới tình huống,232Th sẽ tiến hànhTự phát tách raMà phi α suy biến, ở này khoáng vật trung để lại này phản ứng chứng cứ ( cũng chính là bị nguy trong đó phản ứng sản vậtTiên khí), nhưng này bộ phận thời kỳ bán phân rã dài đến 1021Năm, cho nên α suy biến chiếm tuyệt đại đa số.[50][51]

Thổ không cóỔn định chất đồng vị,Trước mắt đã giam đừng ra 32 loạiTính phóng xạ chất đồng vị,Hạch nhân số từ 207[52]Đến 238.[50]Kế trường thọ nhất232Th sau, nhất ổn định chất đồng vị phân biệt vì230Th ( 75,380 năm ),229Th ( 7,340 năm ),228Th ( 1.92 năm ),234Th ( 24.10 thiên ) cập227Th ( 18.68 thiên ). Này đó chất đồng vị đều làThổ suy biến liên,錒 suy biến liên,Urani suy biến liênHoặc錼 suy biến liênMột bộ phận, bởi vậy có thể ngân lượng tồn với thiên nhiên bên trong. Trong đó 錼 suy biến liên mới bắt đầu chất đồng vị237Np nhân này thời kỳ bán phân rã vì 214 vạn năm, xa thiếu với địa cầu tuổi tác, bởi vậy nên điều liên ở trong giới tự nhiên sớm đã suy biến hầu như không còn, nhưng hiện giờ237Np vẫn liên tục nhân Urani quặngBổ bắt nơ-tronMà ngân lượng sinh ra. Sở hữu còn thừa thổ chất đồng vị toàn làm người công hợp thành, thời kỳ bán phân rã đều đoản với 30 thiên, trong đó đại bộ phận thời kỳ bán phân rã thiếu với mười phút.[40]
Ở thâmHảiTrung, chất đồng vị230Th chiếm tự nhiên thổ 0.04%.[45]Đây là bởi vì này mẫu hạch loại238U hòa tan được với thủy, nhưng230Th không dung thả sẽ Thẩm điến. Đựng thấp độ dày thổ Urani quặng, có thể thuần hóa ra số khắc thổ hàng mẫu, trong đó230Th chiếm một phần tư, bởi vì230Th là238U kế tiếp hạch loại.[50]Quốc tế thuần hóa học cùng ứng dụng hóa học liên hợp sẽ( IUPAC ) ở 2013 năm một lần nữa ở thổ phân loại thành đôi chất đồng vị nguyên tố, thổ ở qua đi từng bị cho rằng làChỉ một chất đồng vị nguyên tố.[45]
Thổ có ba cáiCùng hạch dị cấu thể( hoặc xưng làÁ trạng thái ổn định), phân biệt là216m1Th,216m2Th cập229mTh.229mTh kích phát có thể ởCùng hạch dị cấu thểTrung là thấp nhất,[53]Ước vì7.6±0.5 eV.Này kích phát có thể là như thế chi thấp, đến nỗi với nó tiến hành dị cấu thể quá độ khi thả raγ xạ tuyếnDừng ởTử ngoại tuyếnPhạm vi.[54][55][d]
Thổ bất đồng chất đồng vị tính chất hoá học tương đồng, nhưng tính chất vật lý có nhỏ bé sai biệt. Chẳng hạn như,228
Th
,229
Th
,230
Th
Cập232
Th
Mật độ phân biệt vì 11.5, 11.6, 11.6 cập 11.7 g/cm3.[57]Chất đồng vị229
Th
Bị đoán trước nhưng tiến hànhHạch tách ra,Này lỏaTới hạn chất lượngVì 2839 kg, ở vận dụng cương phản xạ bản nhưng giáng đến 994 kg.[57][e]232
Th
Không thể hạch phân liệt, nhưng nó làMọc thêm tính tài liệu,
Ở bổ hoạch nơ-tron sau nhưng đi qua β suy biến thay đổi thành dễ phân liệt233U.[57][58]
Tính phóng xạ định năm pháp
[Biên tập]Có hai loại tính phóng xạ định năm pháp liên lụy tới thổ chất đồng vị, phân biệt là kiến cơ ở234U suy biến đến230Th Urani thổ định năm pháp, cập đo lường232Th cập230Th tỉ lệ ionium- thổ định năm pháp,[f]Này hai cái phương pháp thành lập là bởi vì232Th là nguyên sơ nguyên tố phóng xạ,230Th chỉ là238U suy biến liên trung gian sản vật.[59]Urani thổ định năm pháp là tương đối ngắn hạn phương pháp, bởi vì234U cập230Th thời kỳ bán phân rã so địa cầu tuổi tác tới đoản. Nó cùng với một cái tỷ muội quá trình, liên lụy tới235U đến231Th α suy biến, sau đó thực mau biến thành trường thọ231Pa, này quá trình thường dùng tới nghiệm chứng Urani thổ định năm pháp kết quả. Urani thổ định năm pháp thường bị dùng để phán định hàmCanxi cacbonatVật chất niên đại, như làThạch nhũCậpSan hô.Bởi vì Urani so thổ cập 鏷 càng dung với thủy, cho nên thổ cập 鏷 so sẽ Thẩm điến đến nền đại dương thượng, này tỉ lệ liền nhưng bị trắc định. Này phương pháp áp dụng phạm vi có mấy chục vạn năm.[59][60]Ionium- thổ định năm pháp là tương quan quá trình, lợi dụng thổ không dung với thủy (232Th cập230Th đều không dung với thủy ) đặc tính, cho nên nhưng đo lường trong biểnThẩm tích vậtTrung232Th cập230Th tỉ lệ, tới phán định Thẩm tích vật niên đại.[61][62]Này hai loại phương pháp đều giả thiết,232Th cập230Th tỉ lệ ở Thẩm tích vật tầng hình thành khi là cố định, Thẩm tích vật trung không chứa từ Urani suy biến ra thổ, thổ cũng sẽ không ở Thẩm tích vật tầng gian di động.[61][62]
Tồn lượng
[Biên tập]Sinh thành phương thức
[Biên tập]232Th là nguyên sơ hạch loại, đã lấy hiện hữu hình thức tồn tại mấy trăm trăm triệu năm. Nó ở mất đi trung hằng tinh hạch, đi quaR- quá trìnhMà hình thành, cũng từSiêu tân tinhCậpSao neutron va chạmRải rác đến hệ Ngân Hà trung.[63][64]Chữ cái R đại biểu nhanh chóng (rapid) nơ-tron bổ hoạch, phát sinh với trung tâm than súc siêu tân tinh trung, khởi động lại thủy hạch loại như là56Fe nhanh chóng bổ hoạch nơ-tron, dọc theoNơ-tron tích tuyếnBay lên, nhân nơ-tron bổ hoạch quá trình so β suy biến trở lại càng ổn định hạch loại mau đến nhiều. Nơ-tron bổ hoạch là hằng tinh duy nhất hợp thành siêu thiết nguyên tố phương pháp, bởi vì ở cao nguyên tử số thứ tự hạ,Coulom chướng váchBay lên khiến cho mang điện hạt gian lẫn nhau giao dùng càng thêm khó khăn, trên thực tế ở56Fe sau hạch dung hợp vìHút nhiệt phản ứng.[65]Bởi vì ở209Bi sau ổn định gấp gáp xúc giảm xuống, R- quá trình là duy nhất có thể ở tinh hệ hạch loại hợp thành trung có thể sản xuất thổ cập Urani quá trình, sở hữu cái khác quá trình đều quá chậm, trung gian sản vật ở bổ hoạch đến cũng đủ nơ-tron trước liền phát sinh α suy biến, vô pháp tiếp tục phản ứng sinh ra này đó nguyên tố.[63][66][67]

Ở trong vũ trụ, thổ là nhất hi hữu nguyên sơ nguyên tố chi nhất, bởi vì nó là hai cái chỉ có thể đi qua R- quá trình sinh ra nguyên tố chi nhất ( một cái khác vì Urani ), cũng bởi vì nó tự sinh thành thời khắc đó khởi liền không ngừng thong thả suy biến. So thổ hi hữu nguyên sơ nguyên tố cóĐu,鎦,鉭, 錸, ở r quá trình phong độ đồ đệ tam căn phong cũng chính là trọng bạc hệ kim loại nguyên tố trước, mang kỳ nguyên tử số hạch loại, cuối cùng còn có Urani.[63][65][g]Ở xa xôi quá khứ, 鈽 cập 鋦 chất đồng vị suy biến sẽ gia tăng thổ cập Urani phong độ; mà thổ tương đối với Urani phong độ, sẽ nhân236U suy biến đến232Th cùng với235U tự nhiên khô kiệt mà gia tăng, nhưng này đó nơi phát ra sớm đã suy biến hầu như không còn thả không hề tạo thành ảnh hưởng.[68]
Trên mặt đất xác trung, thổ tồn lượng tắc cao đến nhiều, ước chừng chiếm 8.1ppm,Nó là tồn lượng nhiều nhất nguyên tố nặng chi nhất, cơ hồ cùng chì giống nhau nhiều ( 13 ppm ) thả so tích ( 2.1 ppm ) nhiều.[69]Đây là bởi vì thổ thích hình thành sẽ không Thẩm xuống đất tâm oxy hoá khoáng vật, nó bị phân loại thành thân nham nguyên tố. Thường thấy thổ hoá chất cũng khó dung với thủy, cho nên cho dùKhó nóng chảy kim loạiỞ trên địa cầu cùng toàn bộ Thái Dương hệ tồn lượng không sai biệt lắm, vỏ quả đất trung nhưng thu thập thổ cũng so cái khác trọng bạc hệ kim loại nhiều.[70]

Địa cầu tồn lượng
[Biên tập]Tự nhiên thổ cơ hồ đều là thuần232Th, nó có dài nhất sinh mệnh thả là thổ nhất ổn định chất đồng vị, này thời kỳ bán phân rã cùng vũ trụ tuổi tác tương đương.[50]Nó phóng xạ suy biến nhiệt làĐịa nhiệtChủ yếu nơi phát ra, địa nhiệt cái khác chủ yếu cống hiến đến từ với đoản mệnh nguyên sơ phóng xạ hạch loại, y cống hiến từ nhiều đến thiếu sắp hàng có238U,40K, cùng với235U. ( ở địa cầu hình thành chi sơ,40K cập235U cống hiến càng nhiều bởi vì chúng nó suy biến đến càng mau thả ra càng nhiều nhiệt, cũng nhân suy biến đến mau cho nên tồn lượng giảm bớt, hiện nay chủ yếu cống hiến giả vì232Th cập238U. )[75]Nó suy biến khiến cho trên địa cầu thổ tồn lượng thong thả giảm bớt, địa cầu hiện có thổ tồn lượng là hình thành chi sơ 85%.[22]Cái khác tự nhiên thổ chất đồng vị thọ mệnh đoản đến nhiều, trong đó thông thường chỉ có230Th nhưng bị kiểm tra đo lường được đến, nó cùng với mẫu hạch loại238U đạt thành trường kỳ cân bằng, nhiều nhất nhưng chiếm tự nhiên thổ tồn lượng 0.04%.[50][h]
Chỉ có thể ở đại đa số khoáng vật chút ít thành phần trung phát hiện thổ, cho nên thổ ở trước kia bị coi là hi hữu.[77]Thổ nhưỡng bình thường đựng 6 ppm thổ.[78]
Trong giới tự nhiên, thổ lấy +4 oxy hoá thái tồn tại, cùng Urani (IV),鋯(IV), 鉿(IV), Cerium (IV),Kháng,釔Cùng với cái khác tam giới lan hệ nguyên tố có không sai biệt lắmLy tử bán kính.[77]Bởi vì thổ có tính phóng xạ, hàm thổ khoáng vật thông thường là phóng xạ biến tinh ( phi tinh hình thể rắn ), chúng nó tinh thể kết cấu bị thổ α xạ tuyến sở phá hư.[79]Tịch Canxi Urani thổ quặng ( (Ca,Fe,Pb)2(Th,U)Si8O20) là một cái cực đoan ví dụ, nhân này đựng thổ mà chưa bao giờ bị phát hiện không phải phóng xạ biến tinh tình hình.[80]
Bởi vì tại thế giới các nơi có đại hình hầm mỏ,Sống một mình thạch( chủ yếu là bất đồng nguyên tố đất hiếm axit phosphoric muối ) là thổ quan trọng nhất thương nghiệp nơi phát ra, chủ yếu sản khu có Ấn Độ, Nam Phi, Brazil, Úc Châu cậpMalaysia.Nó thổ hàm lượng bình quân có 2.5%, ở nào đó hầm mỏ tắc nhưng cao tới 20%.[77][81]Sống một mình thạch vì hoàng hoặc màu nâu, thành sa trạng; hóa học ổn định tính cao, cho nên khó có thể từ giữa trích ra thổ.[77]Nâu liêm thạch ( chủ yếu là bất đồng kim loại hydro oxy tịch toan muối ) nhưng đựng 0.1–2% thổ,鋯 thạch( chủ yếu là tịch toan 鋯 ) nhưng đựng 0.4% thổ.[77]
Oxy hoá thổ tồn tại với hi hữu khoáng vật phương thổ thạch quặng trung, bởi vì này cùngNhị oxy hoá UraniVì cùng hình khoáng vật, này hai loại thường thấy 錒 hệ nguyên tố oxy hoá vật có thể hình thành trạng thái cố định dung dịch, kỳ danh xưng tắc nhân ThO2Hàm lượng mà có điều bất đồng.[77][i]Thổ thạch ( chủ yếu là tịch toan thổ, ThSiO4) thổ hàm lượng cũng rất cao, cũng là lần đầu phát hiện thổ khoáng vật.[77]Ở tịch toan thổ quặng, Th4+CậpSiO4−
4Ly tử thường bị M3+( M= Sc, Y, or Ln ) cập axit phosphoric căn (PO3−
4) sở thay thế được.[77]Nhân nhị oxy hoá thổ cực kỳ khó dung, ở phóng thích khi, thổ thông thường vô pháp thực mau mà rải rác với hoàn cảnh bên trong. Th4+Ly tử hòa tan được, đặc biệt ở toan tính thổ nhưỡng bên trong, ở toan tính điều kiện hạ thổ ly tử độ dày nhưng cao tới 40 ppm.[22]
Lịch sử
[Biên tập]
Sai lầm báo cáo
[Biên tập]Ở 1815 năm, Thuỵ Điển nhà hóa họcVĩnh tư · bối cát tưPhân tích từ Thuỵ Điển trung bộ thành thịPháp luânMỏ đồng trung được đến không tầm thườngTịch phi 釔 quặngHàng mẫu, hắn chú ý tới một cái màu trắng khoáng vật ngâm dấu vết, cũng cẩn thận mà giả thiết này vì nào đó không biết nguyên tố oxy hoá vật. Bối cát tư đã phát hiện hai loại nguyên tố, Cerium cập selen. Nhưng hắn cũng từng sai lầm mà công khai phát biểu một cái tân nguyên tốgahnium,Sau lại phát hiện kỳ thật làOxy hoá kẽm.[83]Ở 1817 năm, bối cát tư trong lén lút lấyBắc Âu thần thoạiLôi ThầnThor,Phân biệt đem này giả định nguyên tố và đề cử oxy hoá vật vì mệnh danh là thorium cập thorina.[84][85]Ở 1824 năm, ở cười nhạo uyTây a cách Del quậnPhát hiện càng nhiều tương đồng khoáng vật hầm mỏ sau, hắn rút về hắn phát hiện, bởi vì cái này khoáng vật ( sau bị mệnh vìLân 釔 quặng) bị chứng minh phần lớn làChính axit phosphoric 釔.[58][83][86][87]
Phát hiện
[Biên tập]Ở 1828 năm, Morten Thrane Esmark ở Na UyTaylor Mark quậnLøvøya trên đảo phát hiện một loại màu đen khoáng vật. Hắn là Na Uy thần phụ, cũng là một cái nghiệp dưKhoáng vật học giả,Ở Taylor Mark quận nghiên cứu khoáng vật, cũng ở địa phương đảm nhiệm nhân viên thần chức. Hắn thường đem nhất có ý tứ tiêu bản, như là cái này, gửi cho hắn phụ thân Jens Esmark. Phụ thân hắn là nổi danh khoáng vật học giả, cũng là Christian ni á ( nayOslo)Hoàng gia Friedrich đại họcKhoáng vật học chấm đất chất học giáo thụ.[88]Lão Esmark phán định này không phải đã biết khoáng vật, cũng gửi phân hàng mẫu cấp bối cát tư tìm kiếm giam định. Bối cát tư phán định này đựng một loại tân nguyên tố.[58]Ở 1829 năm, ở lợi dụngKaliKim loại hoàn nguyên KThF5,Tách ra không thuần hàng mẫu sau, hắn phát biểu hắn phát hiện.[89][90][91]Bối cát tư trọng dụng phía trước ngộ phán tân nguyên tố tên[89][92],Đem cái này khoáng vật mệnh danh là thorite.[58]

Bối cát tư đối này tân kim loại nguyên tố và hóa học hoá chất làm bước đầu giam định, hắn chính xác mà được đến oxy hoá thổ trung thổ oxy chất lượng so 7.5 ( chân thật giá trị ước vì 7.3 ), nhưng hắn giả thiết này tân nguyên tố là nhị giới mà phi bốn giới, cho nên tính ra nguyên tử lượng vì oxy nguyên tử lượng 7.5 lần ( 120amu), trên thực tế lượng ứng vì oxy 15 lần.[j]Hắn phán định thổ là một loạiĐiện chính độRất cao kim loại, này điện chính độ so Cerium cao nhưng so 鋯 thấp.[93]Kim loại hình thái thổ ở 1917 năm lần đầu tiên bị Hà Lan doanh nhân Dirk Lely Jr. Cập Lodewijk Hamburger tách ra tới.[k]
Lúc đầu hóa học phân loại
[Biên tập]Ở 1869 năm từMôn đến liệt phuPhát biểu bảng chu kỳ trung, thổ cập nguyên tố đất hiếm bị đặt ở bảng chu kỳ chủ thể ở ngoài, cũng chính là ở mỗi cái vuông góc chu kỳ cái đáy,Kiềm thổ kim loạiMặt sau. Này phản ánh ra lúc ấy cho rằng thổ cập nguyên tố đất hiếm là nhị giới. Lúc sau biết được thổ cập đại bộ phận nguyên tố đất hiếm là bốn giới, môn đến liệt phu ở 1871 năm đem Cerium cập thổ chuyển qua đệ tứ tộc, nên tộc cũng bao hàm hiện đại than tộc ( đệ thập tứ tộc ) cập thái tộc ( đệ tứ tộc ), bởi vì chúng nó lớn nhất oxy hoá thái là +4.[96][97]Cerium thực mau mà từ bảng chu kỳ chủ thể trung di trừ, sửa phóng tới tách ra lan hệ nguyên tố trung; thổ còn lại là bởi vì cùng với nó so nhẹ đệ tứ tộc nguyên tố, như là thái cập 鋯, có cùng loại tính chất, mà lưu tại đệ tứ trong tộc.[98][l]
Lúc đầu ứng dụng
[Biên tập]Thổ ở 1828 năm bị phát hiện, đương tới rồi 1885 năm mới bắt đầu bị ứng dụng Áo nhà hóa học Carl Auer von Welsbach phát minh khí than võng tráo, một loại nhưng mang theo nguồn sáng, ở thiêu đốt nhưng gas thể đun nóng lúc ấy nhân oxy hoá thổ bạch sí hiện tượng mà tỏa ánh sáng.[58]Lúc sau phát hiện rất nhiều thổ và hoá chất ứng dụng, bao gồm gốm sứ, than đèn hồ quang, kháng nhiệt nồi nấu quặng cập công nghiệp hoá học phản ứng chất xúc tác, như là đem Amonia oxy hoá thành axit nitric.

Tính phóng xạ
[Biên tập]Ở 1898 năm, thổ lần đầu tiên bị nước Đức nhà hóa học Gerhard Carl Schmidt quan trắc đến có tính phóng xạ, lúc sau sóng duệ nước Pháp vật lý học giaMary · cư lễCũng độc lập phát hiện việc này. Ở 1896 năm nước Pháp vật lý học giaHenry · Baker lặcPhát hiện Urani có tính phóng xạ sau, thổ là cái thứ hai bị phát hiện có tính phóng xạ nguyên tố.[99][100][101]Từ 1899 năm bắt đầu, New Zealand vật lý học giaÂu Nice đặc · kéo tắc phúcCập nước Mỹ điện tử kỹ sư Robert Bowie Owens nghiên cứu thổ tia phóng xạ, lúc đầu quan sát biểu hiện nó biến hóa biên độ thật lớn. Sau lại bọn họ xác định này đó biến hóa đến từ với một cái thổ đoản mệnh trạng thái khí tử hạch loại, hơn nữa phát hiện đây là một cái tân nguyên tố. Này nguyên tố hiện bị mệnh danh làĐông,Trừ bỏ Urani bên ngoài, là duy nhất một cái ở tự nhiên trung lấy thổ tử hạch loại bị phát hiện nguyên tố phóng xạ.[102]
Ở đưa vào đông cống hiến sau, kéo tắc phúc, hiện cùng Anh quốc vật lý học giaFrederic · tác địchHợp tác, ở 1900 năm đến 1903 năm công tác trung, chứng minh rồi thổ là như thế nào theo thời gian lấy ổn định tốc độ, suy biến thành một loạt cái khác nguyên tố. Này quan sát khiến choThời kỳ bán phân rãGiam định, cũng chính làα hạtThực nghiệm thành quả chi nhất, mà này lại dẫn tớiTính phóng xạLột xác lý luận.[103]Tính phóng xạ sinh vật hiệu ứng phát hiện với 1903 năm.[104]Này tân phát hiện tính phóng xạ hiện tượng khích lệ nhà khoa học cập giống nhau đại chúng. Ở 1920 niên đại, thổ tính phóng xạ bị tuyên truyền vìPhong thấp,Bệnh tiểu đườngCậpTính vô năngGiải dược. 1932 năm, ở Liên Bang điều tra tính phóng xạ khỏe mạnh ảnh hưởng sau, loại này sử dụng phần lớn ở nước Mỹ bị cấm.[105]Ở nước Mỹ, ước một vạn người ở X quang chẩn bệnh khi bị tiêm vào thổ, bọn họ lúc sau bị phát hiện khỏe mạnh xảy ra vấn đề, như là bệnh bạch cầu cập dị thường nhiễm sắc thể.[22]Đại chúng đối với tính phóng xạ hứng thú ở 1930 năm mạt đã biến mất.[105]

Tiến thêm một bước phân loại
[Biên tập]Thẳng đến cuối thế kỷ 19, nhà hóa học nhất trí cho rằng thổ cập Urani tựa như 鉿 cập 鎢 tương tự, thứ sáu bài lan hệ nguyên tố bị cho rằng là chỉ có một lần ngoài ý muốn. Ở 1892 năm, Anh quốc nhà hóa học Henry Bassett giả thiết cái thứ hai thêm vào bảng chu kỳ trường bài, lấy cất chứa đã biết cập chưa phát hiện nguyên tố, cũng đem thổ cập Urani tương tự thành lan hệ nguyên hệ. 1913 năm, Đan Mạch vật lý học giaNiels · sóng nhĩPhát hiện nguyên tử cập điện tử quỹ vực lý luận mô hình, sau mau được đến rộng khắp nhận đồng. Này mô hình chỉ ra bảng chu kỳ thứ bảy bài quá độ kim loại, ở điền d xác tầng phía trước ứng trước điền tiến f xác tầng, tựa như thứ sáu bài trung lan hệ nguyên tố nằm ở 5d quá độ kim loại phía trước.[96]Cái thứ hai nội quá độ hệ liệt lấy 錒 hệ nguyên tố hình thức tồn tại, vẫn chưa bị tiếp thu, thẳng đến lan hệ nguyên hệ điện tử kết cấu tương tự tính bị thành lập lúc sau, mới có sở thay đổi.[106]Sóng nhĩ kiến nghị 5f quỹ vực có khả năng duyên đến Urani lúc sau mới bị điền nhập.[96]
Thẳng đến phát hiện nhóm đầu tiênSiêu Urani nguyên tốTrung từ 鈽 lúc sau oxy hoá thái như là lan hệ nguyên tố giống nhau chủ yếu vì +3 cập +4 sau, mới lý giải đến 錒 hệ nguyên hệ thật là trước điền nhập f quỹ vực mà cũng không là d quỹ vực, mà trước đoạn 錒 hệ nguyên tố có cùng loại với quá độ kim loại tính chất hoá học chỉ là ngoại lệ mà phi quy tắc.[107]Ở 1975 năm, ở nước Mỹ vật lý học giaCách luân · Theodore · tây bác cáchCùng hắn đoàn đội phát hiện siêu Urani nguyên tố 鋂 cập 鋦 sau, hắn lý giải đến thổ là 錒 hệ nguyên tố cái thứ hai thành viên, cũng nằm ở f khu khối trung, mà cũng không là nằm ở đệ tứ d khu khối,鉿So trọng cùng tộc nguyên tố.[98][m]
Từng bước đào thải
[Biên tập]Ở 1990 niên đại, bởi vì an toàn tính cập bảo vệ môi trường suy tính, theo phát hiện càng an toàn thích hợp thay thế vật sau, phần lớn cùng thổ tính phóng xạ không quan hệ ứng dụng cũng nhanh chóng giảm bớt.[58][110]Cứ việc thổ có tính phóng xạ, ở vô pháp tìm được thích hợp thay thế vật khi, thổ vẫn như cũ bị sử dụng. 1981 năm, một phần từ nước MỹCây sồi lĩnh quốc gia phòng thí nghiệmNghiên cứu phỏng chừng, ở mỗi cuối tuần sử dụng thổ khí than võng tráo, đối một người tới nói là an toàn,[110]Nhưng này không thích hợp với chế tạo võng tráo công nhân cập một ít nhà xưởng phụ cận thổ nhưỡng.[111]Có chút chế tạo thương đã sửa dùng cái khác tài liệu, như là 釔.[112]Thẳng đến 2007 năm, một ít công ty vẫn liên tục chế tạo buôn bán thổ võng tráo, thả chưa cung cấp cùng với tính phóng xạ tương quan thích hợp tin tức, có chút công ty càng ngụy xưng chúng nó không có tính phóng xạ.[110][113]
Năng lượng hạt nhân phát điện
[Biên tập]
Thổ ở nguyên hình tầng cấp thượng đã bị dùng làm điện lực nơi phát ra. Sớm nhất thổ phản ứng 爈 kiến với 1962 năm, nằm ở nước Mỹ New York châu Indian Point nguồn năng lượng trung tâm.[114]Ấn Độ có trên thế giới lớn nhất thổ cung ứng mà chi nhất, nhưng Ấn Độ Urani tồn lượng cũng không nhiều. Ở 1950 niên đại, Ấn Độ tìm kiếm nguồn năng lượng độc lập, đẩy lập tam giai đoạn năng lượng hạt nhân kế hoạch.[115][116]Ở đại đa số quốc gia, Urani tồn lượng tương đối đến nhiều, mà thổ lò phản ứng tiến độ thong thả; ở hai mươi thế kỷ, có ba cái lò phản ứng kiến với Ấn Độ, mười hai cái kiến với hắn chỗ.[117] 1996 năm,Quốc tế năng lượng nguyên tử tổng thựBắt đầu rồi thổ lò phản ứng đại quy mô nghiên cứu; một năm sau,Nước Mỹ nguồn năng lượng bộCũng bắt đầu nghiên cứu. IsraelĐài kéo duy phu đại họcAlvin Radkowsky là bang PennsylvaniaBến tàu thị nhà máy năng lượng nguyên tửThủ tịch thiết kế sư, cái thứ nhất nước Mỹ dân dụng thổ nảy sinh lò phản ứng. Hắn thành lập một cái tập đoàn tới nghiên cứu phát minh thổ lò phản ứng, bao gồm cái khác phòng thí nghiệm: Raytheon Nuclear Inc., nước MỹBrook hắc văn quốc gia phòng thí nghiệmCập NgaKohl đúng lúc thác phu viện nghiên cứu.[118]Ở thế kỷ 21, thổ tiềm tàng giảm thấp hạch khuếch tán năng lực cập nóPhế liệuĐặc tính một lần nữa khiến cho thổ nhiên liệu tuần hoàn hứng thú.[119][120][121]
Vũ khí hạt nhân
[Biên tập]ỞRùng mình thời kỳ,Nước Mỹ nghiên cứu lợi dụng232Th tới làm233U nơi phát ra lấy chế tạoĐạn hạt nhânKhả năng tính, bọn họ ở 1955 năm phóng ra một cái thí nghiệm đạn.[122]Bọn họ tổng kết233U đạn hạt nhân là phi thường cường lực vũ khí, nhưng là cùng đồng thời Urani 鈽 đạn hạt nhân so sánh với, nó chỉ có chút ít nhưng liên tục kỹ thuật ưu thế,[123]Đặc biệt là thuần chất đồng vị233U khó có thể lấy được.[122]
Sinh sản
[Biên tập]| Quốc gia | Số lượng dự trữ |
|---|---|
| 846 | |
| 632 | |
| 595 | |
| 595 | |
| 380 | |
| 374 | |
| 300 | |
| 172 | |
| 155 | |
| 148 | |
| 100 | |
| 87 | |
| 86 | |
| 60 | |
| 50 | |
| 50 | |
| Cái khác quốc gia | 1,725 |
| Thế giới tổng số lượng dự trữ | 6,355 |
Thổ nhu cầu lượng không cao, chỉ từ khoáng thạch đề liên thổ cũng không có lời, cho nên thổ cơ hồ đều là theo nguyên tố đất hiếm cùng nhau bị đề liên, nguyên tố đất hiếm tắc có khả năng là cái khác khoáng vật sinh sản khi phó sản vật.[124]Hiện tại dựa vàoSống một mình thạchTới làm sinh sản nơi phát ra, là bởi vì thổ chủ yếu là lấy sản phẩm phụ tới sinh sản; nếu là thổ nhu cầu lượng bay lên, có thể dễ dàng mà chọn dùng cái khác hàm thổ lượng càng nhiều nơi phát ra, như làThổ thạch.[125]Bởi vì trước mắt đối với thổ nhu cầu không lớn, đối với khoáng sản phân bố khu vực thăm dò rất ít, bởi vậy thổ tài nguyên phân bố không phải rất rõ ràng.[126]Ở 2014 năm, nhưng dùng để trích thổ áp súc sống một mình thạch thế giới sản lượng ước chừng có 2700 tấn.[127]
Thường thấy thổ sinh sản quá trình bao gồm từ áp súc vật trung trích cùng với thuần hóa, kế tiếp có thể lựa chọn chuyển Thành Hoá hợp vật, như là oxy hoá thổ.[128]
Áp súc
[Biên tập]Nhưng dùng để trích thổ thổ khoáng vật nhưng phân hai đại loại: Nguyên sinh hầm mỏ cập tái sinh hầm mỏ. Nguyên sinh hầm mỏ phát với toan tính đá hoa cương dung nham cập pecmatit trung, độ dày cao nhưng kích cỡ tiểu; tái sinh hầm mỏ tắc phát với đá hoa cương vùng núi cửa sông chỗ. Ở này đó hầm mỏ trung, thổ cùng với nó trọng khoáng vật cùng nhau bị áp súc.[15]Mới bắt đầu độ dày theo hầm mỏ chủng loại mà có điều bất đồng.[128]
Ở nguyên sinh hầm mỏ, thông thường từ lấy quặng được đến pecmatit sau, phân thành tiểu khối lại tiến hành phù tuyển. Than toan kiềm thổ kim loại muối nhưng dùngHydro Clo toanPhản ứng mà di trừ, kế tiếp tiến hành trù hóa, lọc cập rèn thiêu, nhưng đến nguyên tố đất hiếm hàm lượng thượng đạt 90% áp súc vật.[128]Khoáng tái sinh ( như là hải sa ) tắc trước tiến hành trọng lực chia lìa, lại lấy một loạt tiệm cường nam châm tiến hành từ lực chia lìa. Lấy này pháp được đến sống một mình thạch độ tinh khiết có thể đạt tới 98%.[128]
Nhập thế kỷ công nghiệp sinh sản pháp, là trước tiên ở gang vật chứa lấy nhiệt axit đậm đặc xử lý, lại lấy thủy pha loãng cũng tiến hành lựa chọn lắng đọng lại. Này pháp ỷ lại với kỹ thuật thượng chi tiết cập áp súc vật hạt lớn nhỏ. Từng có rất nhiều thay thế phương pháp bị đưa ra, nhưng chỉ có một loại bị chứng minh có lợi và thực tế: Lấy nhiệt sodium hydroxide tiến hành kiềm tiêu hóa. Này so nguyên pháp càng quý, nhưng sản xuất càng thuần thổ, đặc biệt chính là này pháp nhưng từ áp súc vật trung di trừ axit phosphoric muối.[128]
Toan tiêu hóa xử lý
[Biên tập]Toan tiêu hóa xử lý bao gồm hai quá trình, cùng sử dụng tới rồi độ ấm 210–230°C, độ dày độ cao 93%Axít.Đầu tiên gia nhập 60% axít, trù hóa phản ứng vật. Lại đến gia nhập phát yên axít, cũng bảo trì định ôn năm giờ lấy hạ thấp pha loãng sau thể tích. Axít độ dày y phản ứng tốc độ cập độ dính mà định, hai người toàn theo độ dày bay lên mà gia tăng, nhưng độ dính gia tăng sẽ sử phản ứng biến chậm. Thăng ôn cũng sẽ gia tốc phản ứng, nhưng cần tránh cho vượt qua 300°C, bởi vì này sẽ sinh ra không thể dung tiêu axit phosphoric thổ. Bởi vì hòa tan sẽ thả ra rất nhiều nhiệt, sống một mình thạch sa không thể quá nhanh gia nhập toan. Tương phản ở độ ấm thấp với 200°C khi, phản ứng sẽ quá chậm đến nỗi với không thực tế. Vì bảo đảm không có Thẩm điến vật sẽ phân ra với sống một mình thạch mặt ngoài mà trở ngại phản ứng, toan lượng cần thiết là thạch sa gấp hai, mà không phải hóa học đo đến ra 60%. Lúc sau đem chất hỗn hợp lại đến 70°C, cũng lấy gấp mười lần thể tích nước lạnh pha loãng, kể từ đó sở hữu còn thừa sống một mình thạch sẽ Thẩm với cái đáy, mà nguyên tố đất hiếm cập thổ sẽ lưu tại dung dịch trung. Lúc sau thổ có thể ở pH 1.3 hạ lấy axit phosphoric muối Thẩm điến mà chia lìa, Bởi vì nguyên tố đất hiếm thẳng đến pH 2 mới có thể Thẩm điến.[128]
Kiềm tiêu hóa xử lý
[Biên tập]Kiềm tiêu hóa này đây 30–45% sodium hydroxide dung dịch ở 140°C xử lý ước tam giờ. Quá cực nóng sẽ sản xuất khó dung oxy hoá thổ, lưu lại quá liều Urani ở chất lỏng đã lọc; kiềm dịch độ dày quá thấp tắc sẽ sử phản ứng phi thường thong thả. Này đó phản ứng điều kiện tương đương ôn hòa, yêu cầu sống một mình thạch sa lớn nhỏ ở 45 μm dưới. Ở lọc lúc sau, lự bánh sẽ đựng lấy hydro oxy hoá vật hình thức tồn tại thổ cập nguyên tố đất hiếm, lấyTrọng Urani toan NatriHình thức tồn tại Urani cùng lấyAxit phosphoric NatriHình thức tồn tại axit phosphoric. Hạ nhiệt độ đến 60 °C dưới khi, này lự bánh sẽ phân ra mười thủy axit phosphoric Natri tinh thể; phản ứng vật trung cóNhị oxy hoá tịchKhi, Urani không thuần vật lượng sẽ bay lên, ở thương nghiệp sử dụng trước cần một lần nữa kết tinh. Hydro oxy hoá vật sẽ ở 80°C hòa tan với 37% hydro Clo toan. Lọc còn thừa Thẩm điến vật sau, lại gia nhập 47% sodium hydroxide, sẽ ở ước pH 5.8 tả hữu Thẩm điến ra thổ cập Urani. Cần tránh cho làm khô Thẩm điến vật, bởi vì không khí sẽ oxy hoá Cerium đến +3 hoặc +4 oxy hoá thái, mà Cerium (IV) có thể từ hydro Clo toan trung phóng xuất ra Clo. Nguyên tố đất hiếm sẽ ở cao pH giá trị khi lại lần nữa Thẩm điến, Thẩm điến vật sẽ bị vốn có sodium hydroxide dung dịch trung hoà, tuy rằng đại bộ phận axit phosphoric trước hết cần di trừ để tránh miễn nguyên tố đất hiếm axit phosphoric muối Thẩm điến. Cũng có thể trước đem lự bánh dung với axit nitric sau, lại dùngDung môi tríchRa thổ cập Urani. Hydro oxy hoá thổ sẽ trói chặt thổ mà gây trở ngại này hoàn toàn hòa tan.[128]
Thuần hóa
[Biên tập]Hạch tương quan ứng dụng yêu cầu cao độ dày thổ, đặc biệt chính là, nơ-tron bổ hoạchMặt cắt tíchRất cao nguyên tử, độ dày cần thiết rất thấp ( tỷ như釓Trọng lượng độ dày cần thấp với trăm vạn phần có một ). Phía trước, cao độ tinh khiết là dùng phản phúc hòa tan cập lại kết tinh tới đạt thành. Hiện nay là sử dụng trạng thái dịch dung môi trích, này liên lụy tới lựa chọn tính Th4+Sai hợp phản ứng,Tỷ như ở kiềm tiêu hóa xử lý di trừ axit phosphoric sau, dư lại thổ, Urani cập nguyên tố đất hiếm chờ axit nitric sai hợp vật nhưng ởDầu hoảTrung lấyAxit phosphoric tam chính đinh chỉTrích tới chia lìa.[128]
Kim loại thổ lấy ra
[Biên tập]Chương nàyThượng vô tham khảo nơi phát ra,Nội dung có lẽVô pháp kiểm chứng.(2024 năm 3 nguyệt 24 ngày) |
Kim loại thổ là ởArgon khíTrung hoặc là ở chân không trung oxy hoá thổ bịCanxiỞ cực nóng hạ hoàn nguyên lấy ra ra tới. Bởi vì thổ sẽ cùngHydroTạo thành hoá chất bởi vậy vô pháp sử dụng hydro tới hoàn nguyên. Hoàn nguyên sau sử dụngFlo hóa hydroSúc rửa, sau đó thổ bị lọc ra tới.
Ứng dụng
[Biên tập]Tự 1950 niên đại khởi,[129]Nhân thổ và suy biến sản vật tính phóng xạ dẫn tới hoàn cảnh thượng suy tính, cùng tính phóng xạ không quan hệ ứng dụng đã dần dần trượt xuống.[58][110]
Đại đa số thổ ứng dụng, sử dụng nó oxy hoá vật ( ở công nghiệp giới có khi xưng là thoria ) mà phi thổ kim loại. Này hoá chất điểm nóng chảy cao tới 3300°C ( 6000°F ), là sở hữu đã biết oxy hoá vật trung tối cao, chỉ có số ít vật chất điểm nóng chảy so nó cao.[22]Này có trợ với hoá chất ở trong ngọn lửa bảo trì trạng thái cố định, hơn nữa nó rõ ràng gia tăng rồi ngọn lửa độ sáng, đây là thổ bị dùng ở khí than võng tráo nguyên nhân chủ yếu.[130]Sở hữu vật chất ở cực nóng khi đều sẽ thả ra năng lượng ( sáng lên ), nhưng thổ thả ra quang cơ hồ tất cả đều làÁnh sáng mắt thường nhìn thấy được,Cho nên thổ chế võng tráo mới có thể như thế lượng.[25]Đương thổ bại lộ ở năng lượng nơi phát ra trung khi, thổ sẽ tản mát ra năng lượng, trong đó có chút năng lượng này đây ánh sáng mắt thường nhìn thấy được hình thức phóng thích, năng lượng nơi phát ra tắc có khả năng là tia âm cực, nguồn nhiệt hoặc làTử ngoại tuyến.Oxy hoá Cerium cũng có này hiệu ứng, cũng ở đem tử ngoại tuyến chuyển thành ánh sáng mắt thường nhìn thấy được khi có càng cao hiệu suất, nhưng là oxy hoá thổ có càng cao ngọn lửa độ ấm, cũng thả ra ítTia hồng ngoại.[130]Thổ vẫn thường bị dùng ở võng tráo trung, nhưng tự 1990 niên đại hậu kỳ đã dần dần bị釔Thay thế được.[131]Một phần từ Anh quốc quốc gia phóng xạ phòng hộ cục ở 2005 năm tuyên bố bình luận chỉ ra, “Tuy rằng ( thổ chế khí than võng tráo ) ở mấy năm trước còn phi thường dễ dàng lấy được, nhưng hiện nay đã không hề là như thế.”[132]
Từ 1931 năm đến 1940 niên đại mạt một loại ổn định, keo chất nhị oxy hoá thổHỗn huyền tềỞMạch máu nhiếp ảnhBị làmTạo ảnh tềSử dụng. Nhưng là cái này dùng tề hội tụ tập ởVi huyết quảnTrung, dẫn tới bộ phận tính phóng xạ quá cao cùng ung thư. Gan ung thư rõ ràng cùng thổ tạo ảnh tề có quan hệ, thổ tạo ảnh tề còn có thể dẫn phát giống nhau phi thường hiếm thấy ác tính gan ung thư ganMạch máu bướu thịt.Ngoài ra còn có thổ tạo ảnh tề dẫn tới xoang mũi ung thư kỷ lục. Giống nhau bệnh phát phát sinh ở sử dụng 30 đến 35 năm sau. Hôm nay mọi người sử dụngAxít bốiCùng iốt hoá chất thay thế được thổ tạo ảnh tề.[ nơi phát ra thỉnh cầu ]
Ở chế tạoBạch síDây tóc khi, ở rút ra dây tóc trước, ở 鎢Luyện cụcBột phấn gia nhập chút ít nhị oxy hoá thổ, nhưng hữu hiệu hạ thấp 鎢Lại kết tinh.[129]Ở 鎢 chế nhiệt âm cực trung gia nhập chút ít thổ, nhưng hữu hiệu hạ thấp điện tửCông hàm số,Cho nên điện tử nhưng ở thấp đến nhiều độ ấm bị bắn ra.[58]Thổ sẽ ở 鎢 mặt ngoài hình thành một nguyên tử hậu thổ tầng. Thổ mặt ngoài công hàm số sở dĩ sẽ hạ thấp, có khả năng là bởi vì thổ trọng đại điện chính tính mà ở thổ cùng 鎢 chi gian hình thành điện trường sở dẫn tới.[133]Tự 1920 niên đại khởi, hàm thổ 鎢 tuyến bị dùng ở chân không quản, X xạ tuyến quản âm cực cùng đối âm cực, cùng với máy chỉnh lưu. Bởi vì thổ cùng đại khí trung oxy cập nitro phản ứng tính, thổ cũng dùng làm chân không quản trung hút khí tề. 1950 niên đại tiến cử điện tinh thể sau, này loại nhu cầu trên diện rộng giảm bớt, nhưng vẫn chưa hoàn toàn biến mất.[129]Ở鎢 cực khí thể bảo hộ hồ quang hạnTrung, nhị oxy hoá thổ bị dùng để gia tăng 鎢 điện cực cực nóng cường độ cùng với hồ quang ổn định tính.[58]Tại đây hạng ứng dụng trung, oxy hoá thổ đang bị cái khác oxy hoá vật, như là 鋯, Cerium cập lan oxy hoá vật sở thay thế được.[134][135]
Nhị oxy hoá thổ bị dùng ở nại cực nóng gốm sứ trung, như là phòng thí nghiệm cực nóngNồi nấu quặng,[58],Hoặc là chủ yếu thành phần, hoặc là làmNhị oxy hoá 鋯Tăng thêm vật. Từ 90%BạcCập 10% thổ hợp kim, là đemAmoniaOxy hoá thành nitro oxy hoá vật chất xúc tác, nhưng này đã bị 95% bạc cập 5%銠Hợp kim sở thay thế được, nhân này có càng tốt máy móc tính chất cập càng cao dùng bền độ.[129]

LàmPha lêTăng thêm vật, nhị oxy hoá thổ nhưng gia tăngChiết xạ suấtCập hạ thấpSự tán sắc.Loại này pha lê nhưng dùng với máy quay phim cập khoa học thiết bị cao phẩm chấtThấu kính.[16]Này đó thấu kính tia phóng xạ sẽ làm thấu kính trở tối, cũng sẽ trong mấy năm nay làm thấu kính chậm rãi biến hoàng, cũng tổn hại phim ảnh, nhưng khỏe mạnh nguy hiểm không lớn.[136]Phát hoàng thấu kính ở trường kỳ bại lộ ở cường tử ngoại tuyến hạ sau, có thể hồi phục trong suốt vô sắc. Tại đây ứng dụng trung, nhị oxy hoá thổ đã bị đất hiếm oxy hoá vật thay thế được, bởi vì chúng nó cung cấp cùng loại hiệu quả nhưng vô tính phóng xạ.[129]
Bốn Flo hóa thổ ở nhiều tầng quang học đồ màng trung nhưng dùng làm kháng phản xạ tài liệu, nó ở sóng điện từ đoạn 0.35–12 µm phạm vi là trong suốt, ước chừng đối ứng đến gần tử ngoại tuyến, ánh sáng mắt thường nhìn thấy được cập trung tia hồng ngoại. Nó tia phóng xạ chủ yếu là α hạt, nhưng bị một khác tầng lá mỏng dễ dàng chặn lại.[137]Tự 2010 niên đại sau, bốn Flo hóa thổ thay thế được vật đang ở nghiên cứu phát minh trung.[138]
Mag-Thor hợp kim ( cũng bị xưng là hàm thổ Magie ) bị dùng với hàng quá ứng dụng trung, nhưng này đó ứng dụng nhân này tính phóng xạ mà dần dần đạm ra.
Năng lượng hạt nhân chi tiềm tàng ứng dụng
[Biên tập]| 237Np | ||||||||||||||
| ↑ | ||||||||||||||
| 231U | ← | 232U | ↔ | 233U | ↔ | 234U | ↔ | 235U | ↔ | 236U | → | 237U | ||
| ↓ | ↑ | ↑ | ↑ | |||||||||||
| 231Pa | → | 232Pa | ← | 233Pa | → | 234Pa | ||||||||
| ↑ | ↑ | |||||||||||||
| 230Th | → | 231Th | ← | 232Th | → | 233Th | ||||||||
| ||||||||||||||
Phản ứng hạt nhân lò chủ yếu năng lượng nơi phát ra là nơ-tron dẫn phát hạch phân liệt. Tự nhiên tồn tại232Th cập238U bổ hoạch nơ-tron sau, nhưng phân biệtMọc thêmNhân tạo dễ phân liệt[e]Hạch loại233U cập239Pu. Tồn tại với thiên nhiên235U cũng là dễ phân liệt hạch loại.[139][140][n]Ở thổ nhiên liệu tuần hoàn trung,Mọc thêm tính tài liệu232Th bịChậm nơ-tronSở oanh tạc, bổ hoạch nơ-tron sau biến thành233Th, sau đó liên tục β suy biến hai lần, trước biến thành233PaLại biến thành dễ phân liệt233U:[58]
- 232
90Th
+ n →233
90Th
+γ233
91Pa
233
92U
233U là dễ phân liệt hạch loại, có thể dùng cùng235U cập239PuGiống nhau phương thức coi như nhiên liệu hạt nhân.233U hạch phân liệt khi phóng ra ra nơ-tron có thể tiến thêm một bước va chạm232Th hạch loại kéo dài tuần hoàn.[58]Này cùngMau nơ-tron mọc thêm phản ứng lòTrung Urani nhiên liệu tuần hoàn đồng thời tiến hành, trong đó238U bổ hoạch nơ-tron biến thành239U, β suy biến thành239Np sau, lại β suy biến thành dễ phân liệt hạch loại239Pu.[141]
Ưu điểm
[Biên tập]Bởi vì thổ so Urani thường thấy đến nhiều, bởi vậy nhưng vì thế giới cung năng càng lâu.[142]
232Th so238U càng dễ bắt được nơ-tron, thả so với235U cùng239Pu, thổ sinh ra233U hấp thu nơ-tron sau càng dễ tách ra[143],Phóng thích nơ-tron càng nhiều.[142]238U chỉ cần bắt được một cái nơ-tron liền sẽ sinh ra239Pu cập các loại siêu Urani nguyên tố phế liệu, nhưng232Th yêu cầu bắt được năm cái nơ-tron mới có thể sinh ra siêu Urani nguyên tố phế liệu237Np.232Th bắt được nơ-tron trong quá trình sinh ra233U cập235U ở bắt được nơ-tron sau đều dễ dàng tách ra, bởi vậy chỉ có số ít232Th có thể bắt được nơ-tron đến sinh ra siêu Urani nguyên tố. Này cũng khiến cho thổ có tiềm lực thay thếHỗn hợp oxy hoá vật nhiên liệu hạt nhânTrung Urani, giảm bớt siêu Urani nguyên tố sinh ra, còn có thể tiêu hao rớt nhiên liệu trungBất.[144]
Nhị oxy hoá thổ điểm nóng chảy cao,Nhiệt đạo suấtCao,Nhiệt hệ số giãn nởThấp, bởi vậy thổ nhiên liệu có thể sửLò phản ứng đôi tâmCàng an toàn, càng có hiệu.[58]Nhị oxy hoá thổ tính chất hoá học so nhị oxy hoá Urani ổn định, người sau sẽ bởi vì bị oxy hoá thànhTám oxy hoá tam Urani( U
3O
8) mà hạ thấp mật độ.[145]
Khuyết điểm
[Biên tập]Thổ sinh raMệt nhiên liệu hạt nhânNguy hiểm, khó có thể xử lý, bởi vì trong đó đựng232Th cập233U các loại suy biến sản vật, trong đó không thiếu có sẽ thả ra cường γ xạ tuyến hạch tố.[142]233U sinh sản đều sẽ bởi vì232Th trung230Th tạp chất, hay là là sử hạch tố mất đi một cái nơ-tron phó phản ứng, sinh ra232UTạp chất.[146]
- 230
90Th
+ n →231
90Th
+γ231
91Pa
(227
89Ac
) - 231
91Pa
+ n →232
91Pa
+γ232
92U
232U bản thân không phải rất nguy hiểm, nhưng nó sẽ nhanh chóng suy biến thành cường γ xạ tuyến nguyên208Tl.[147][o]233U trung đựng232U tạp chất sử nó nguy hiểm, thả bởi vì chia lìa cũng không thực tế, khó có thể đem233U dùng choVũ khí hạt nhân khuếch tán.[146]233Pa có so lớn lên thời kỳ bán phân rã, đạt 27 thiên, thả nơ-tron bắt đượcMặt cắtCao, bởi vậy làNơ-tron độc vật.Đại lượng233Pa sẽ không nhanh chóng suy biến vì hữu dụng233U, mà là tiêu hao nơ-tron cũng chuyển hóa vì234U, hạ thấpNơ-tron kinh tế.Vì tránh cho việc này phát sinh, yêu cầu đem233Pa từNóng chảy muối đôiTrung chia lìa, sử nó vô pháp bắt được nơ-tron, chỉ có thể suy biến thành233U.[148]
Nếu muốn thực hiện232Th ưu điểm, liền yêu cầu thành thục kỹ thuật, mà loại này kỹ thuật muốn so Urani, bất nhiên liệu sở cần kỹ thuật càng tiên tiến.[58]Thổ nhiên liệu tuần hoàn thương nghiệp tính khả thi thấp,[149][150][151]Kinh hợp tổ chức năng lượng hạt nhân thựLiền đoán trước ở Urani thượng có thể đại lượng đạt được vài thập niên nội, thổ nhiên liệu tuần hoàn ở thương nghiệp thượng không thể được.[152]Tuy rằng thổ nhiên liệu tuần hoàn sinh ra siêu Urani nguyên tố ít, nhưng không phải siêu Urani nguyên tố231Pa cũng tương đương nguy hiểm. Nó thời kỳ bán phân rã là 32760 năm, là mệt nhiên liệu hạt nhân trường kỳ nguy hại chủ yếu nguồn gốc.[148]
An toàn
[Biên tập]Tính phóng xạ
[Biên tập]Thổ thời kỳ bán phân rã trường, suy biến thả raα hạtVô pháp xuyên thấu làn da, bởi vậyKhí than võng tráoTrung chút ít thổ vẫn là an toàn.[153]Bởi vì α hạt nhưng xuyên thấu trong cơ thể khí quan, bởi vậy bại lộ với hàm thổ khí dung giao hạ sẽ đề caoUng thư phổi,Di dơ ung thư,Bệnh bạch huyếtNguy hiểm.[153]Thổ nội chiếu xạ sẽ đề cao hoạnGanBệnh nguy hiểm.[154]
232Th suy biến sản vật bao gồm so nó bản thân càng nguy hiểm lôi cùng đông. Tuy rằng bởi vì thổ suy biến thong thả, suy biến sản vật hàm lượng ít; nhưng là chân chính đánh giá232Th tính phóng xạ nguy hại yêu cầu suy tính này đó suy biến sản vật.232Th suy biến liên trung không có trường thọ mệnh chất đồng vị, bởi vậy ở232Th suy biến sau, sinh ra suy biến sản vật sẽ nhanh chóng hoàn thành suy biến liên còn thừa bộ phận,[155]Trong đó không thiếu có sẽ thả raγ xạ tuyếnNguy hiểm chất đồng vị.[156]Bởi vì suy biến sản vật điểm nóng chảy đều xa thấp hơn nhị oxy hoá thổ, chúng nó ở khí than võng tráo sử dụng khi đều sẽ phát huy ra tới. Ở sử dụng khí than võng tráo một giờ sau, thổ suy biến sản vật224Ra,228Ra,212Pb,212Bi phần lớn đều sẽ phát huy.[157]Người sử dụng mỗi lần sử dụng khí than võng tráo khi đều sẽ nhân hút vào suy biến sản vật, tiếp thu đến 0.2 hàoTây phấtPhóng xạ, ước vìVú nhiếp ảnh thuậtPhóng xạ một phần ba.[158]
Một ítHạch an toànCơ cấu liền khí than võng tráo sử dụng đưa ra kiến nghị, cũng đưa ra này chế tạo cùng xử trí an toàn vấn đề. Một cái khí than võng tráo sinh ra phóng xạ không phải vấn đề lớn, nhưng nhà xưởng hoặc bãi chôn rác tập trung đại lượng khí than võng tráo sinh ra phóng xạ chính là vấn đề lớn.[154]
Hóa học độc tính
[Biên tập]Thổ vô xú vô vị.[159]Thổ và nhất thường thấy hoá chất nhị oxy hoá thổ đều khó hòa tan thủy,[160]Hòa tan được thổ hoá chất cũng đều sẽ bị chuyển hóa thànhHydro oxy hoá thổLắng đọng lại,[161]Bởi vậy hóa học độc tính so thấp. Ở chanh chua căn chờ nhưng cùng thổ ly tử hình thành hòa tan được phối hợp vật ly tử tồn tại hạ, thổ hoá chất sẽ bởi vì bị nhân thể hấp thu, biểu hiệnĐộc tính.[155]Thổ khó hòa tan thủy ý nghĩa nó thông qua thận cùng phân bài xuất bên ngoài cơ thể tốc độ thong thả.[155]Đương hàm thổ vật thể bị nhấm nuốt, nuốt vào sau, trong đó đựng thổ chỉ có 0.4% tiến vào nhân thể, nhưng thổ nguy hiểm suy biến sản vật sẽ có 90% tiến vào nhân thể.[113]Tiến vào nhân thể thổ có ba phần tư sẽ ởCốt cáchTích lũy. Tuy rằng thổ có khả năng bị làn da hấp thu, nhưng này không quá có thể là chủ yếu bại lộ phương thức.[153]
Bại lộ nguyên
[Biên tập]Thổ ở nơi nào đều có vi lượng tồn tại. Nhân thể nội ước đựng 40Hơi khắcThổ, mỗi ngày đều sẽ thông qua ăn cơm hút vào 3 hơi khắc thổ.[22]Người phần lớn thông qua hút vào bụi tiếp xúc thổ, mà đồ ăn trung thổ bởi vì độ hoà tan so thấp, này hút vào lượng có thể xem nhẹ bất kể.[155]
Ở tại thổ hầm mỏ hoặc tính phóng xạ phế vật xử lý tràng phụ cận người, Urani, axit phosphoric muối, tích xưởng gia công công nhân cùng phụ cận cư dân, cùng với làm khí than võng tráo sinh sản người thổ bại lộ lượng đều sẽ gia tăng.[162]Ấn ĐộThái mễ ngươi nạp đức bangGiàu có thổ, bởi vậy địa phương cư dân được đến đến từ thổ phóng xạ sẽ so cái khác khu vực cao hơn gấp mười lần.[163]BrazilBắc bộ vùng duyên hảiDưa kéo khănCó tính phóng xạ sống một mình thạch bờ cát, bởi vậy địa phương phóng xạ cao tới toàn cầu bình quân giá trị 50 lần.[164]
Thổ nhưng dùng cho chế tạo nào đó đạn đạoChỉ đạo hệ thống,Bởi vậy thổ một khác bại lộ nguyên là vũ khí thí nghiệm giữa sân sinh ra hàm thổ bụi. Này bị cho rằng là ItalyRải đinh đại khuSaar thác địch khuê kéo thí nghiệm tràngBẩm sinh tính chướng ngại cùng ung thư phát bệnh suất cao nguyên nhân.[165]
Chú giải
[Biên tập]- ^鉍-209Tính phóng xạ cực kỳ mỏng manh, thả này thời kỳ bán phân rã ( 1.9×1019Năm ) so địa cầu tuổi tác lớn lên nhiều, cơ hồ có thể coi làỔn định chất đồng vị.
- ^Thấp với鋨,鉭,鎢Cập錸.[4]Đệ 7 chu kỳ quá độ kim loại đoán trước có cao điểm sôi, nhưng này chế lượng quá thiếu khó có thể nghiệm chứng.[8]
- ^ Cùng phía trước 錒 hệ nguyên tố cùng quá độ nguyên tố tương tự tính bất đồng, cùng chủ tộc nguyên tố tương tự tính đại bộ phận ngăn với thổ, mà chưa kéo dài đến 錒 hệ nguyên tố nửa đoạn sau. Bởi vì ở cộng giới kiện trung 5f quỹ vực cống hiến dần dần gia tăng. Ở thường thấy 錒 hệ nguyên tố trung, trừ bỏ thổ chỉ còn lại có Urani. Urani còn sót lại một ít chủ tộc nguyên tố đặc tính. Trừ bỏ Urani nhất thường thấy hai cái oxy hoá thái Urani (VI) cập Urani (IV), Urani hóa học so thổ phức tạp đến nhiều, này hai cái thái cùng với nó càng cao hình thức thượng mất đi sở hữu giới điện tử oxy hoá thái bất đồng, này đó càng cao oxy hoá thái hành vi cùngp khu khốiTrọng chủ tộc nguyên tố cùng loại.[13]
- ^γ xạ tuyến cũng không phải thông qua bước sóng phân chia, mà là chỉ cần là từ hạt nhân nguyên tử thả ra liền kêu γ xạ tuyến, cho nên nguyên tố phóng xạ suy biến ra γ xạ tuyến bước sóng cũng không hạn mức cao nhất.[56]
- ^5.05.1Nhưng hạch phân liệt hạch loại, là chỉ ở bổ hoạch cao năng lượng nơ-tron sau, Có thể tiến hành hạch phân liệt hạch loại ( cho dù cơ suất rất thấp ). Có chút hạch loại nhưng bị năng lực kém lượng mưu cầu danh lợi tử lấy cao cơ suất dẫn phát hạch phân liệt, chúng nó được xưng là “Dễ phân liệt hạch loại”. “Mọc thêm tính tài liệu” là chỉ có thể bị nơ-tron oanh tạc sau sinh ra dễ phân liệt hạch loại hạch loại.Tới hạn chất lượngLà chỉ có thể liên tục tiến hànhHạch phản ứng dây chuyềnCầu hình vật chất chất lượng.
- ^ioniumKỳ thật chính là230Th. Ở lúc đầu bất đồng chất đồng vị không bị cho rằng là cùng loại nguyên tố, cho nên có giả bất đồng tên.
- ^ Mang số chẵn hạt nhân hoặc số chẵn nơ-tron chất đồng vị giống nhau sẽ so mang số lẻ chất đồng vị càng ổn định, kỳ nguyên tử số nguyên tố nhiều nhất chỉ có hai cái ổn định chất đồng vị, ngẫu nhiên nguyên tử số nguyên tố tắc có bao nhiêu cái ổn định chất đồng vị, như là tích ( 50 hào nguyên tố ) có mười cái. [40]
- ^Cái khác chất đồng vị khả năng cùng với232Th mà xuất hiện, nhưng chỉ có ngân lượng lớn nhỏ. Nếu nơi phát ra không chứa Urani, cái khác duy nhất sẽ xuất hiện thổ chất đồng vị là228Th, nó tồn tại với232ThSuy biến liên( thổ hệ liệt ) trung,228Th cùng232Th tỉ lệ sẽ thấp với 10−10.[50]Nếu nơi phát ra hàm Urani, sẽ xuất hiện cái khác ngân lượng lớn nhỏ thổ chất đồng vị, bao gồm từ235U suy biến liên ( 錒 hệ liệt ) trung tới231Th cùng227Th, cùng với từ238U suy biến liên ( Urani hệ liệt ) trung tới, tồn lượng so nhiều nhưng vẫn là ngân lượng234Th cùng230Th.[50]229Th sẽ từ237Np suy biến liên ( 錼 hệ liệt ) trung sinh ra, sở hữu nguyên sơ237Np toàn đã tuyệt tích, nhưng nó vẫn sẽ từ Urani quặng phản ứng hạt nhân sở sinh ra.[76]229Th phần lớn Là nhân côngNơ-tron hoạt hoá232Th sinh ra233USuy biến sản vật,Tự nhiên sinh ra229Th cực độ hi hữu.[50]
- ^75–100 mol% ThO2Xưng là phương thổ thạch, 25–75 mol% ThO2Xưng là Urani phương thổ thạch, 15–25 mol% ThO2Xưng là thổ nhựa đường Urani quặng, 0–15 mol% ThO2Xưng là nhựa đường Urani quặng.[77]
- ^Ở lúc ấy, bao gồm thổ cập trong giới tự nhiên cùng với chặt chẽ cùng với nguyên tốNguyên tố đất hiếmBị cho rằng là nhị giới, nguyên tố đất hiếmNguyên tử lượngBiến thành thật giá trị hai phần ba, thổ cập Urani tắc vì thật giá trị một nửa.
- ^Tách ra thổ chủ yếu khó khăn không phải nằm ở này điện chính độ, mà là khó có thể cùng trong giới tự nhiên cùng với chặt chẽ cùng với cái khác nguyên tố đất hiếm cập Urani chia lìa. Thuỵ Điển nhà hóa họcKéo ngươi tư · Frederic · Neil tùng,Cũng là kháng phát hiện giả, ở 1882 năm từng ý đồ tách ra thổ kim loại, nhưng vô pháp được đến cao độ tinh khiết thổ.[94]Lely cùng Hamburger lợi dụng Natri kim loại hoàn nguyên Clo hóa thổ, được đến độ tinh khiết 99% thổ kim loại.[95]Ở 1927 năm, nước Mỹ kỹ sư John Marden cùng Harvey Rentschler phát hiện một cái càng đơn giản biện pháp có thể đạt tới càng cao độ tinh khiết, ở Clo hóa Canxi tồn tại hạ lợi dụng Canxi hoàn nguyên oxy hoá thổ.[95]
- ^Thổ cũng xuất hiện ở 1864 năm Anh quốc nhà hóa họcJohan · nữu lan tưBảng chu kỳ trung, là này cuối cùng thả nặng nhất nguyên tố, bởi vì lúc đầu cho rằng Urani là tam giới thả nguyên tử lượng ước chừng là 120, bởi vì Urani tuyệt đại đa số là sáu giới, đây là thật giá trị một nửa. Thổ cũng ở 1864 năm Anh quốc nhà hóa họcWilliam · áo đức lâmBảng chu kỳ trung đảm nhiệm nặng nhất nguyên tố, cũng bị vây thái, 鋯 cập鉭Dưới. Thổ vẫn chưa xuất hiện ở 1862 năm nước Pháp địa chất học gia Alexandre-Émile Béguyer de Chancourtois, 1867 năm đức duệ nước Mỹ âm nhạc gia Gustav Hinrichs, cùng với 1870 năm nước Đức nhà hóa họcJulius · Lạc tháp ngươi · mại gia ngươiChờ bảng chu kỳ trung, này đó bảng chu kỳ đều chưa nạp vào nguyên tố đất hiếm cập thổ.[96]
- ^Xác định 5f tử xác tầng là từ 錒 hệ trước đoạn bắt đầu bị điền nhập, là ở 1964 niên hạ một cái nguyên tốLôLần đầu tiên bị hợp thành ra tới sau; lúc ấy phát hiện lô biểu hiện như là 鉿, tựa như 5f quỹ vực bị lấp đầy sau đoán kỳ giống nhau. [108]Hiện nay thổ vẫn như cũ nhân này cùng 鉿 tương tự tính, mà có khi được xưng là “Chuẩn đệ tứ tộc nguyên tố”.[109]
- ^Mười ba loại nửa đời kỳ vượt qua một năm 錒 hệ nguyên tố dễ phân liệt chất đồng vị có229Th,233U,235U,236Np,239Pu,241Pu,242mAm,243Cm,245Cm,247Cm,249Cf,251Cf cập252Es.Này bên trong chỉ có235U là tự nhiên tồn tại, hơn nữa chỉ có233U cùng239Pu nhưng từ tự nhiên hạch loại bổ hoạch đơn nơ-tron mà đến.[140]
- ^232Th cũng sẽ suy biến thành208Tl, nhưng bởi vì232Thời kỳ bán phân rã rất dài, cho nên này suy biến sinh ra208Tl lượng có thể xem nhẹ.
Tham khảo văn hiến
[Biên tập]- ^Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J.Standard atomic weights of the elements 2021 (IUPAC Technical Report).Pure and Applied Chemistry. 2022-05-04.ISSN 1365-3075.doi:10.1515/pac-2019-0603( tiếng Anh ).
- ^Chaoxian, Chi; Sudip, Pan; Jiaye, Jin; Luyan, Meng; Mingbiao, Luo; Lili, Zhao; Mingfei, Zhou; Gernot, Frenking.Octacarbonyl Ion Complexes of Actinides [An(CO)8]+/−(An=Th, U) and the Role of f Orbitals in Metal–Ligand Bonding.Chemistry (Weinheim an der Bergstrasse, Germany). 25 (50): 11772–11784. 2019,25(50): 11772–11784.ISSN 0947-6539.PMC 6772027
 .PMID 31276242.doi:10.1002/chem.201902625.
.PMID 31276242.doi:10.1002/chem.201902625.
- ^Magnetic susceptibility of the elements and inorganic compoundsInternet hồ sơ quánLưu trữ,Lưu trữ ngày 2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^4.004.014.024.034.044.054.064.074.084.094.104.114.124.13Wickleder, Fourest & Dorhout 2006,Đệ 61–63 trang.
- ^Gale, W. F.; Totemeier, T. C. Smithells Metals Reference Book.Butterworth-Heinemann.2003: 15–2–15–3.ISBN978-0-08-048096-1( tiếng Anh ).
- ^6.06.16.26.36.4Tretyakov, Yu. D. ( biên ). Non-organic chemistry in three volumes. Chemistry of transition elements3.Academy. 2007.ISBN978-5-7695-2533-9.
- ^7.07.1Johansson, B.; Abuja, R.; Eriksson, O.; et al. Anomalous fcc crystal structure of thorium metal.. Physical Review Letters. 1995,75(2): 280–283.Bibcode:1995PhRvL..75..280J.PMID 10059654.doi:10.1103/PhysRevLett.75.280.
- ^Fricke, Burkhard.Superheavy elements: a prediction of their chemical and physical properties.Structure and Bonding21.1975: 89–144[2013-10-04].ISBN978-3-540-07109-9.doi:10.1007/BFb0116498.
|journal=Bị xem nhẹ (Trợ giúp) - ^Wickleder, Fourest & Dorhout 2006,Đệ 59–60 trang.
- ^10.010.110.210.3Cotton, S. Lanthanide and Actinide Chemistry.John Wiley & Sons.2006.
- ^Martin, W. C.; Hagan, L.; Reader, J.; et al.Ground Levels and Ionization Potentials for Lanthanide and Actinide Atoms and Ions(PDF).J. Phys. Chem. Ref. Data. 1974,3(3): 771–779[2013-10-19].Bibcode:1974JPCRD...3..771M.doi:10.1063/1.3253147.(Nguyên thủy nội dung(PDF)Lưu trữ với 2016-03-04 ).
- ^Cotton, S.Lanthanide and Actinide Chemistry.John Wiley & Sons.2006:150.
- ^13.013.1King, R. Bruce.Inorganic Chemistry of Main Group Elements.Wiley-VCH.1995.ISBN978-0-471-18602-1.
- ^Greenwood & Earnshaw 1997,Trang 1262.
- ^15.015.1Stoll 2005,Trang 6.
- ^16.016.1Hammond, C. R.The Elements, in Handbook of Chemistry and Physics81st.CRC Press.2004.ISBN978-0-8493-0485-9.
- ^17.017.1Hyde, E. K.The radiochemistry of thorium(PDF).National Academy of Sciences.1960[2017-09-29].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-03-05 ).
- ^Greenwood & Earnshaw 1997,Trang 1264.
- ^Moore, Robert Lee; Goodall, C. A.; Hepworth, J. L.; Watts, R. A. Nitric Acid Dissolution of Thorium. Kinetics of Fluoride-Catalyzed Reaction. Industrial & Engineering Chemistry. May 1957,49(5): 885–887.doi:10.1021/ie50569a035.
- ^20.020.1Greenwood & Earnshaw 1997,Trang 1267.
- ^Yamashita, Toshiyuki; Nitani, Noriko; Tsuji, Toshihide; Inagaki, Hironitsu.Thermal expansions of NpO2and some other actinide dioxides.J. Nucl. Mater. 1997,245(1): 72–78.Bibcode:1997JNuM..245...72Y.doi:10.1016/S0022-3115(96)00750-7.
- ^22.022.122.222.322.422.5Emsley, J.emsley blocks: an A–Z guide to the elements.Oxford University Press.2011:544–548.ISBN978-0-19-960563-7.
- ^23.023.1Wickleder, Fourest & Dorhout 2006,Đệ 70–77 trang.
- ^Greenwood & Earnshaw 1997,Trang 1269.
- ^25.025.125.2Ivey, H. F. Candoluminescence and radical-excited luminescence. Journal of Luminescence. 1974,8(4): 271–307.Bibcode:1974JLum....8..271I.doi:10.1016/0022-2313(74)90001-5.
- ^Wickleder, Fourest & Dorhout 2006,Đệ 95–97 trang.
- ^27.027.127.227.327.4Wickleder, Fourest & Dorhout 2006,Đệ 78–94 trang.
- ^28.028.1Greenwood & Earnshaw 1997,Trang 1271.
- ^Wickleder, Fourest & Dorhout 2006,Đệ 97–101 trang.
- ^Wickleder, Fourest & Dorhout 2006,Đệ 64–66 trang.
- ^Greenwood & Earnshaw 1997,Trang 127.
- ^Wickleder, Fourest & Dorhout 2006,Đệ 66–70 trang.
- ^33.033.133.233.3Wickleder, Fourest & Dorhout 2006,Đệ 117–134 trang.
- ^Persson, I. Hydrated metal ions in aqueous solution: How regular are their structures?. Pure and Applied Chemistry. 2010,82(10): 1901–1917.doi:10.1351/PAC-CON-09-10-22.
- ^35.035.1Greenwood & Earnshaw 1997,Đệ 1275–1277 trang.
- ^36.036.136.2Wickleder, Fourest & Dorhout 2006,Đệ 101–115 trang.
- ^37.037.137.237.3Wickleder, Fourest & Dorhout 2006,Đệ 116–117 trang.
- ^38.038.1Greenwood & Earnshaw 1997,Đệ 1278–1280 trang.
- ^Langeslay, Ryan R.; Fieser, Megan E.; Ziller, Joseph W.; Furche, Philip; Evans, William J.Synthesis, structure, and reactivity of crystalline molecular complexes of the {[C5H3(SiMe3)2]3Th}1−anion containing thorium in the formal +2 oxidation state.Chemical Science.2015,6(6): 517–521.PMC 5811171
 .PMID 29560172.doi:10.1039/C4SC03033H.
.PMID 29560172.doi:10.1039/C4SC03033H.
- ^40.040.140.240.340.440.5Audi, G.; Bersillon, O.; Blachot, J.; et al.The NUBASE evaluation of nuclear and decay properties(PDF).Nuclear Physics A.2003,729(1): 3–128.Bibcode:2003NuPhA.729....3A.CiteSeerX 10.1.1.692.8504
 .doi:10.1016/j.nuclphysa.2003.11.001.(Nguyên thủy nội dung(PDF)Lưu trữ với 2013-07-24 ).
.doi:10.1016/j.nuclphysa.2003.11.001.(Nguyên thủy nội dung(PDF)Lưu trữ với 2013-07-24 ).
- ^ de Laeter, John Robert;Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. Atomic weights of the elements. Review 2000 (IUPAC Technical Report).Pure and Applied Chemistry.2003,75(6): 683–800.doi:10.1351/pac200375060683.
- ^International Union of Pure and Applied Chemistry.Atomic weights of the elements 2005 (IUPAC Technical Report)(PDF).Pure and Applied Chemistry. 2006,78(11): 2051–2066[2017-07-27].doi:10.1351/pac200678112051.(Nguyên thủy nội dung(PDF)Lưu trữ với 2018-07-12 ).
- ^Nagy, S. Radiochemistry and Nuclear Chemistry2.EOLSS Publications. 2009: 374.ISBN978-1-84826-127-3.
- ^Griffin, H. C. Natural Radioactive Decay Chains. Vértes, A.; Nagy, S.; Klencsár, Z.; et al ( biên ). Handbook of Nuclear Chemistry.Springer Science+Business Media.2010: 668.ISBN978-1-4419-0719-6.
- ^45.045.145.2Trích dẫn sai lầm: Không có vì danh vì
CIAAW2013Tham khảo văn hiến cung cấp nội dung - ^Beiser, A.Nuclear Transformations(PDF).Concepts of Modern Physics 6.McGraw-Hill Education.2003: 432–434[2019-07-13].ISBN978-0-07-244848-1.(Nguyên thủy nội dung(PDF)Lưu trữ với 2016-10-04 ).
- ^Ramdahl, Thomas; Bonge-Hansen, Hanne T.; Ryan, Olav B.; Larsen, Åsmund; Herstad, Gunnar; Sandberg, Marcel; Bjerke, Roger M.; Grant, Derek; Brevik, Ellen M. An efficient chelator for complexation of thorium-227. Bioorganic & Medicinal Chemistry Letters. 2016-09-01,26(17): 4318–4321.ISSN 0960-894X.PMID 27476138.doi:10.1016/j.bmcl.2016.07.034.
- ^Deblonde, Gauthier J.-P.; Lohrey, Trevor D.; Booth, Corwin H.; Carter, Korey P.; Parker, Bernard F.; Larsen, Åsmund; Smeets, Roger; Ryan, Olav B.; Cuthbertson, Alan S.Solution Thermodynamics and Kinetics of Metal Complexation with a Hydroxypyridinone Chelator Designed for Thorium-227 Targeted Alpha Therapy.Inorganic Chemistry. 2018-11-19,57(22): 14337–14346[2019-07-13].ISSN 0020-1669.PMID 30372069.doi:10.1021/acs.inorgchem.8b02430.(Nguyên thủy nội dungLưu trữ với 2021-05-11 ).
- ^Captain, Ilya; Deblonde, Gauthier J.-P.; Rupert, Peter B.; An, Dahlia D.; Illy, Marie-Claire; Rostan, Emeline; Ralston, Corie Y.; Strong, Roland K.; Abergel, Rebecca J.Engineered Recognition of Tetravalent Zirconium and Thorium by Chelator–Protein Systems: Toward Flexible Radiotherapy and Imaging Platforms.Inorganic Chemistry. 2016-11-21,55(22): 11930–11936[2019-07-13].ISSN 0020-1669.PMID 27802058.doi:10.1021/acs.inorgchem.6b02041.(Nguyên thủy nội dungLưu trữ với 2021-04-29 ).
- ^50.050.150.250.350.450.550.650.7Wickleder, Fourest & Dorhout 2006,Đệ 53–55 trang.
- ^Bonetti, R.; Chiesa, C.; Guglielmetti, A.; et al. First observation of spontaneous fission and search for cluster decay of232Th. Physical Review C. 1995,51(5): 2530.Bibcode:1995PhRvC..51.2530B.doi:10.1103/PhysRevC.51.2530.
- ^Yang, H. B.; et al. New isotope207Th and odd-even staggering in α-decay energies for nuclei withZ> 82 andN< 126. Physical Review C. 2022,105(L051302).Bibcode:2022PhRvC.105e1302Y.S2CID 248935764.doi:10.1103/PhysRevC.105.L051302.
- ^Ruchowska, E.; Płóciennik, W. A.; Żylicz, J.; et al.Nuclear structure of229Th.Physical Review C. 2006,73(4): 044326[2019-07-13].Bibcode:2006PhRvC..73d4326R.doi:10.1103/PhysRevC.73.044326.hdl:10261/12130.(Nguyên thủy nội dungLưu trữ với 2021-04-28 ).
- ^Beck, B. R.; Becker, J. A.; Beiersdorfer, P.; et al. Energy splitting in the ground state doublet in the nucleus229Th.Physical Review Letters.2007,98(14): 142501.Bibcode:2007PhRvL..98n2501B.PMID 17501268.doi:10.1103/PhysRevLett.98.142501.
- ^von der Wense, L.; Seiferle, B.; Laatiaoui, M.; et al. Direct detection of the229Th nuclear clock transition.Nature.2016,533(7601): 47–51.Bibcode:2016Natur.533...47V.PMID 27147026.arXiv:1710.11398
 .doi:10.1038/nature17669.
.doi:10.1038/nature17669.
- ^Feynman, R.;Leighton, R.; Sands, M.The Feynman Lectures on Physics1.Addison-Wesley.1963: 2–5[2018-01-13].ISBN978-0-201-02116-5.
- ^57.057.157.2Evaluation of nuclear criticality safety data and limits for actinides in transport(PDF).Institut de radioprotection et de sûreté nucléaire:15.[2010-12-20].(Nguyên thủy nội dung(PDF)Lưu trữ với 2007-07-10 ).
- ^58.0058.0158.0258.0358.0458.0558.0658.0758.0858.0958.1058.1158.1258.13Wickleder, Fourest & Dorhout 2006,Đệ 52–53 trang.
- ^59.059.13–6: Uranium Thorium Dating(PDF).Institute for Structure and Nuclear Astrophysics,University of Notre Dame.[2017-10-07].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-04-21 ).
- ^Davis, O.Uranium-Thorium Dating.Department of Geosciences,University of Arizona.[2017-10-07].(Nguyên thủy nội dungLưu trữ với 2017-03-28 ).
- ^61.061.1Rafferty, J. P., Geochronology, Dating, and Precambrian Time: The Beginning of the World As We Know It, The Geologic History of Earth,Rosen Publishing:150, 2010,ISBN978-1-61530-125-6
- ^62.062.1Vértes, A., Nagy, S.; Klencsár, Z.; Lovas, R. G.; et al, biên, Handbook of Nuclear Chemistry52nd, Springer Science+Business Media: 800, 2010,ISBN978-1-4419-0719-6
- ^63.063.163.2Cameron, A. G. W.Abundance of the Elements in the Solar System(PDF).Space Science Reviews. 1973,15(1): 121–146.Bibcode:1973SSRv...15..121C.doi:10.1007/BF00172440.(Nguyên thủy nội dung(PDF)Lưu trữ với 2011-10-21 ).
- ^Frebel, Anna; Beers, Timothy C. The formation of the heaviest elements.Physics Today.2018,71(1): 30–37.Bibcode:2018PhT....71a..30F.ISSN 0031-9228.arXiv:1801.01190
 .doi:10.1063/pt.3.3815.
.doi:10.1063/pt.3.3815.
- ^65.065.1Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. The End of Nucleosynthesis: Production of Lead and Thorium in the Early Galaxy. The Astrophysical Journal. 2009,698(2): 1963–1980.Bibcode:2009ApJ...698.1963R.arXiv:0904.3105
 .doi:10.1088/0004-637X/698/2/1963.
.doi:10.1088/0004-637X/698/2/1963.
- ^Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al.Synthesis of the Elements in Stars(PDF).Reviews of Modern Physics.1957,29(4): 547[2019-07-20].Bibcode:1957RvMP...29..547B.doi:10.1103/RevModPhys.29.547.(Nguyên thủy nội dung(PDF)Lưu trữ với 2016-06-24 ).
- ^Clayton, D. D.Principles of Stellar Evolution and Nucleosynthesis.McGraw-Hill Education. 1968:577–591.ISBN978-0-226-10953-4.
- ^Stoll 2005,Trang 2.
- ^Greenwood & Earnshaw 1997,Trang 1294.
- ^Albarède, F. Geochemistry: an introduction.Cambridge University Press.2003: 17.ISBN978-0-521-89148-6.
- ^Trenn, T. J. Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory. Annals of Science. 1978,35(6): 581–597.doi:10.1080/00033797800200441.
- ^Diamond, H.; Friedman, A. M.; Gindler, J. E.; et al. Possible Existence of Cm247or Its Daughters in Nature. Physical Review. 1956,105(2): 679–680.Bibcode:1957PhRv..105..679D.doi:10.1103/PhysRev.105.679.
- ^Rao, M. N.; Gopalan, K. Curium-248 in the Early Solar System. Nature. 1973,245(5424): 304–307.Bibcode:1973Natur.245..304R.doi:10.1038/245304a0.
- ^Rosenblatt, D. B. Effects of a Primeval Endowment of U236.Physical Review. 1953,91(6): 1474–1475.Bibcode:1953PhRv...91.1474R.doi:10.1103/PhysRev.91.1474.
- ^Gando, A.; Gando, Y.; Ichimura, K.; et al.Partial radiogenic heat model for Earth revealed by geoneutrino measurements(PDF).Nature Geoscience. 2011,4(9): 647–651[2019-07-28].Bibcode:2011NatGe...4..647K.doi:10.1038/ngeo1205.(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-03-07 ).
- ^Peppard, D. F.; Mason, G. W.; Gray, P. R.; et al.Occurrence of the (4n+ 1) Series in Nature.Journal of the American Chemical Society. 1952,74(23): 6081–6084.doi:10.1021/ja01143a074.
- ^77.077.177.277.377.477.577.677.777.8Wickleder, Fourest & Dorhout 2006,Đệ 55–56 trang.
- ^Agency for Toxic Substances and Disease Registry.Thorium(PDF)( báo cáo ). 2016[2017-09-30].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-04-12 ).
- ^Woodhead, J. A.The metamictization of zircon: Radiation dose-dependent structural characteristics(PDF).American Mineralogist. 1991,76:74–82[2019-07-28].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-05-05 ).
- ^Szymański, J. T.A mineralogical study and crystal-structure determination of nonmetamict ekanite, ThCa2Si8O20(PDF).Canadian Mineralogist. 1982,20:65–75[2019-07-28].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-02-25 ).
- ^Greenwood & Earnshaw 1997,Trang 1255.
- ^Tor's Fight with the Giants.Google Arts & Culture.[2016-06-26].(Nguyên thủy nội dungLưu trữ với 2016-10-09 )( tiếng Anh ).
- ^83.083.1Fontani, M.; Costa, M.; Orna, V. The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. 2014: 73.ISBN978-0-19-938334-4.
- ^Ryabchikov, D. I.; Gol'braikh, E. K. The Analytical Chemistry of Thorium: International Series of Monographs on Analytical Chemistry.Elsevier.2013: 1.ISBN978-1-4831-5659-0.
- ^Thomson, T. A System of Chemistry of Inorganic Bodies1.Baldwin & Cradock andWilliam Blackwood.1831: 475.
- ^Berzelius, J. J.Undersökning af några Mineralier. 1. Phosphorsyrad Ytterjord. [Examining some minerals. 1st phosphoric yttria.]. Kungliga Svenska Vetenskapsakademiens Handlingar. 1824,2:334–338( Thuỵ Điển ngữ ).
- ^Xenotime-(Y).Mindat database.[2017-10-07].(Nguyên thủy nội dungLưu trữ với 2017-03-16 ).
- ^Selbekk, R. S.Morten Thrane Esmark.Store norske leksikon.Kunnskapsforlaget.2007[2009-05-16].(Nguyên thủy nội dungLưu trữ với 2021-04-28 )( Na Uy ngữ ).
- ^89.089.1Weeks, M. E.The discovery of the elements. XI. Some elements isolated with the aid of potassium and sodium: Zirconium, titanium, cerium, and thorium. Journal of Chemical Education. 1932,9(7): 1231.Bibcode:1932JChEd...9.1231W.doi:10.1021/ed009p1231.
- ^Berzelius, J. J.Untersuchung eines neues Minerals und einer darin erhalten zuvor unbekannten Erde [Investigation of a new mineral and of a previously unknown earth contained therein].Annalen der Physik und Chemie. 1829,16(7): 385–415[2019-07-28].Bibcode:1829AnP....92..385B.doi:10.1002/andp.18290920702.(Nguyên thủy nội dungLưu trữ với 2021-04-27 )( tiếng Đức ).(modern citation:Annalen der Physik,vol. 92, no. 7, pp. 385–415).
- ^Berzelius, J. J. Undersökning af ett nytt mineral (Thorit), som innehåller en förut obekant jord [Investigation of a new mineral (thorite), as contained in a previously unknown earth]. Kungliga Svenska Vetenskaps Akademiens Handlingar. 1829: 1–30( Thuỵ Điển ngữ ).
- ^Schilling, J. Die eigentlichen Thorit-Mineralien (Thorit und Orangit) [The actual thoritic minerals (thorite and orangite)]. Zeitschrift für Angewandte Chemie. 1902,15(37): 921–929.doi:10.1002/ange.19020153703( tiếng Đức ).
- ^Leach, M. R.The Internet Database of Periodic Tables: Berzelius' Electronegativity Table.[2016-07-16].(Nguyên thủy nội dungLưu trữ với 2021-04-28 ).
- ^Nilson, L. F. Über metallisches Thorium [About metallic thorium]. Berichte der Deutschen Chemischen Gesellschaft. 1882,15(2): 2537–2547.doi:10.1002/cber.188201502213( tiếng Đức ).
- ^95.095.1Meister, G.Production of Rarer Metals(PDF)( báo cáo ).United States Atomic Energy Commission.1948[2017-09-22].
- ^96.096.196.296.3Leach, M. R.The INTERNET Database of Periodic Tables.[2012-05-14].(Nguyên thủy nội dungLưu trữ với 2012-08-28 ).
- ^Jensen, William B.The Place of Zinc, Cadmium, and Mercury in the Periodic Table(PDF).Journal of Chemical Education. 2003,80(8): 952–961.Bibcode:2003JChEd..80..952J.doi:10.1021/ed080p952.(Nguyên thủy nội dung(PDF)Lưu trữ với 2010-06-11 ).
- ^98.098.1Masterton, W. L.; Hurley, C. N.; Neth, E. J. Chemistry: Principles and reactions 7th.Cengage Learning.2011-01-31: 173.ISBN978-1-111-42710-8.
- ^Curie, M.Rayons émis par les composés de l'uranium et du thorium [Rays emitted by compounds of uranium and thorium]. Comptes Rendus. 1898,126:1101–1103.OL 24166254M( tiếng Pháp ).
- ^Schmidt, G. C.Über die vom Thorium und den Thoriumverbindungen ausgehende Strahlung [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin (Proceedings of the Physical Society in Berlin). 1898,17:14–16( tiếng Đức ).
- ^Schmidt, G. C.Über die von den Thorverbindungen und einigen anderen Substanzen ausgehende Strahlung [On the radiation emitted by thorium compounds and some other substances].Annalen der Physik und Chemie. 1898,65(5): 141–151[2019-08-10].Bibcode:1898AnP...301..141S.doi:10.1002/andp.18983010512.(Nguyên thủy nội dungLưu trữ với 2021-04-28 )( tiếng Đức ).(modern citation:Annalen der Physik,vol. 301, pp. 141–151 (1898)).
- ^Rutherford, E.;Owens, R. B.Thorium and uranium radiation. Trans. R. Soc. Can. 1899,2:9–12.:"The radiation from thorium oxide was not constant, but varied in a most capricious manner", whereas "All the compounds of Uranium give out a radiation which is remarkably constant." ( “Oxy hoá thổ phóng xạ đều không phải là hằng số, biến hóa tương đương kịch liệt”, phản chi “Sở hữu Urani hoá chất phóng xạ đều phi thường vững vàng” )
- ^Simmons, J. G.The Scientific 100: A Ranking of the Most Influential Scientists, Past and Present.Carol. 1996:19.ISBN978-0-8065-2139-8.
- ^Fröman, N.Marie and Pierre Curie and the Discovery of Polonium and Radium.nobelprize.org.Nobel Media AB.1996[2017-05-11].(Nguyên thủy nội dungLưu trữ với 2018-08-07 ).
- ^105.0105.1Burns, M. Low-Level Radioactive Waste Regulation-Science, Politics and Fear. CRC Press. 1987: 24–25.ISBN978-0-87371-026-8.
- ^van Spronsen, J. W.The periodic system of chemical elements.Elsevier. 1969:315–316.ISBN978-0-444-40776-4..
- ^Rhodes, R.The Making of the Atomic Bomb25th Anniversary.Simon & Schuster.2012:221–222, 349.ISBN978-1-4516-7761-4.
- ^Türler, A.; Buklanov, G. V.; Eichler, B.; et al. Evidence for relativistic effects in the chemistry of element 104. Journal of Alloys and Compounds. 1998,. 271–273: 287.doi:10.1016/S0925-8388(98)00072-3.
- ^Kratz, J. V.; Nagame, Y.Liquid-Phase Chemistry of Superheavy Elements.Schädel, M.; Shaughnessy, D. ( biên ). The Chemistry of Superheavy Elements 2nd. Springer-Verlag. 2014: 335.ISBN978-3-642-37465-4.doi:10.1007/978-3-642-37466-1.
- ^110.0110.1110.2110.3Furuta, E.; Yoshizawa, Y.; Aburai, T. Comparisons between radioactive and non-radioactive gas lantern mantles. J. Radiol. Prot. 2000,20(4): 423–431.Bibcode:2000JRP....20..423F.PMID 11140713.doi:10.1088/0952-4746/20/4/305.
- ^New Jersey Department of Health.Health and hazardous waste(PDF).A Practitioner's Guide to Patients' Environmental Exposures. 1996,1(3): 1–8. (Nguyên thủy nội dung(PDF)Lưu trữ với 2016-04-15 ).
- ^Toepker, Terrence P. Thorium and yttrium in gas lantern mantles. American Journal of Physics. 1996,64(2): 109.Bibcode:1996AmJPh..64..109T.doi:10.1119/1.18463.
- ^113.0113.1Poljanc, K.; Steinhauser, G.; Sterba, J. H.; et al. Beyond low-level activity: on a "non-radioactive" gas mantle.Science of the Total Environment.2007,374(1): 36–42.Bibcode:2007ScTEn.374...36P.PMID 17270253.doi:10.1016/j.scitotenv.2006.11.024.
- ^Kazimi, M.Thorium Fuel for Nuclear Energy.American Scientist.2003[2017-09-29].(Nguyên thủy nội dungLưu trữ với 2017-01-01 ).
- ^Majumdar, S.; Purushotham, D. S. C.Thorium fuel utilization: Options and trends(PDF)( báo cáo ).International Atomic Energy Agency.1999[2017-10-07].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-04-12 ).
|entry=Bị xem nhẹ (Trợ giúp) - ^Nuclear Power in India.World Nuclear Association. 2017[2017-09-29].(Nguyên thủy nội dungLưu trữ với 2016-09-06 ).
- ^IAEA-TECDOC-1450 Thorium Fuel Cycle – Potential Benefits and Challenges(PDF).International Atomic Energy Agency. 2005[2009-03-23].(Nguyên thủy nội dung(PDF)Lưu trữ với 2016-08-04 ).
- ^Educational Foundation for Nuclear Science, Inc. Bulletin of the Atomic Scientists.: 19–20.ISSN 0096-3402.
- ^IAEA-TECDOC-1349 Potential of thorium-based fuel cycles to constrain plutonium and to reduce the long-lived waste toxicity(PDF).International Atomic Energy Agency. 2002[2009-03-24].(Nguyên thủy nội dung(PDF)Lưu trữ với 2021-04-28 ).
- ^Evans, B.Scientist urges switch to thorium.ABC News.2006[2011-09-17].(Nguyên thủy nội dungLưu trữ với 2010-03-28 ).
- ^Martin, R.Uranium is So Last Century – Enter Thorium, the New Green Nuke.Wired.2009[2010-06-19].(Nguyên thủy nội dungLưu trữ với 2010-06-26 ).
- ^122.0122.1122.2Thorium.World Nuclear Association.2017[2017-06-21].(Nguyên thủy nội dungLưu trữ với 2017-05-08 ).
- ^Woods, W. K. LRL Interest in U-233.Battelle Memorial Institute.1966.OSTI 79078.doi:10.2172/79078( tiếng Anh ).
- ^Stoll 2005,Trang 7.
- ^United States Geological Survey.Thorium(PDF).2012[2017-05-12].(Nguyên thủy nội dung(PDF)Lưu trữ với 2017-04-29 ).
- ^K.M.V. Jayaram.An Overview of World Thorium Resources, Incentives for Further Exploration and Forecast for Thorium Requirements in the Near Future(PDF).(Nguyên thủy nội dung(PDF)Lưu trữ với 2007-11-28 ).
- ^Thorium. Statistics and Information( báo cáo ).United States Geological Survey.2017[2018-01-06].(Nguyên thủy nội dungLưu trữ với 2019-01-10 )( tiếng Anh ).
- ^128.0128.1128.2128.3128.4128.5128.6128.7Stoll 2005,Trang 8.
- ^129.0129.1129.2129.3129.4Stoll 2005,Trang 32.
- ^130.0130.1Stoll 2005,Trang 31.
- ^Matson, Tim. The Book of Non-electric Lighting: The Classic Guide to the Safe Use of Candles, Fuel Lamps, Lanterns, Gaslights & Fire-View Stoves.Countryman Press.2011: 60.ISBN978-1-58157-829-4.
- ^Shaw, J.; Dunderdale, J.; Paynter, R. A.A Review of Consumer Products Containing Radioactive Substances in the European Union(PDF).NRPB Occupational Services Department. (Nguyên thủy nội dung(PDF)Lưu trữ với 2021-03-10 ).
- ^Pridham, G. J. Electronic Devices and Circuits: The Commonwealth and International Library: Electrical Engineering Division. Elsevier. 2016: 105.ISBN978-1-4831-3979-1( tiếng Anh ).
- ^Uttrachi, J. Weld Like a Pro: Beginning to Advanced Techniques. CarTech Inc. 2015: 42.ISBN978-1-61325-221-5.
- ^Jeffus, L.Welding: Principles and Applications.Cengage Learning. 2016:393.ISBN978-1-305-49469-5.
- ^Oak Ridge Associated Universities.Thoriated Camera Lens (ca. 1970s).1999[2017-09-29].(Nguyên thủy nội dungLưu trữ với 2021-04-12 ).
- ^Rancourt, J. D. Optical thin films: user handbook.SPIE Press.1996: 196.ISBN978-0-8194-2285-9.
- ^Kaiser, N.; Pulker, H. K. Optical Interference Coatings. Springer. 2013: 111.ISBN978-3-540-36386-6( tiếng Anh ).
- ^Ronen, Y. A rule for determining fissile isotopes. Nuclear Science and Engineering. 2006,152(3): 334–335.ISSN 0029-5639.doi:10.13182/nse06-a2588.
- ^140.0140.1Ronen, Y. Some remarks on the fissile isotopes. Annals of Nuclear Energy. 2010,37(12): 1783–1784.doi:10.1016/j.anucene.2010.07.006.
- ^Plutonium.World Nuclear Association. 2017[2017-09-29].(Nguyên thủy nội dungLưu trữ với 2017-10-05 ).
- ^142.0142.1142.2Greenwood & Earnshaw 1997,Trang 1259.
- ^Interactive Chart of Nuclides.Brookhaven National Laboratory.[2013-08-12].(Nguyên thủy nội dungLưu trữ với 2017-01-24 ).
- ^Thorium test begins.World Nuclear News. 2013[2013-07-21].( nguyên thủy nội dungLưu trữVới 2013-07-19 ).
- ^IAEA-TECDOC-1450 Thorium Fuel Cycle – Potential Benefits and Challenges(PDF).International Atomic Energy Agency. 2005[2009-03-23].( nguyên thủy nội dungLưu trữ(PDF)Với 2016-08-04 ).
- ^146.0146.1Langford, R. E.Introduction to Weapons of Mass Destruction: Radiological, Chemical, and Biological.John Wiley & Sons. 2004:85.ISBN978-0-471-46560-7.
- ^Stoll 2005,Trang 30.
- ^148.0148.1Nakajima, Ts.; Groult, H. Fluorinated Materials for Energy Conversion. Elsevier. 2005: 562–565.ISBN978-0-08-044472-7.
- ^Rees, E.Don't believe the spin on thorium being a greener nuclear option.The Guardian.2011[2017-09-29].( nguyên thủy nội dungLưu trữVới 2017-09-27 ).
- ^Sovacool, B. K.; Valentine, S. V. The National Politics of Nuclear Power: Economics, Security, and Governance.Routledge.2012: 226.ISBN978-1-136-29437-2.
- ^Nuclear Energy FAQs(PDF).Argonne National Laboratory.2014[2018-01-13].( nguyên thủy nội dungLưu trữ(PDF)Với 2014-10-07 ).
- ^Findlay, T.Nuclear Energy and Global Governance: Ensuring Safety, Security and Non-proliferation. Routledge. 2011: 9.ISBN978-1-136-84993-0.
- ^153.0153.1153.2Thorium: Radiation Protection.United States Environmental Protection Agency.[2016-02-27].(Nguyên thủy nội dungLưu trữ với 2006-10-01 ).
- ^154.0154.1Radioactivity in Lantern Mantles.Australian Radiation Protection and Nuclear Safety Agency.[2017-09-29].(Nguyên thủy nội dungLưu trữ với 2007-10-14 ).
- ^155.0155.1155.2155.3Stoll 2005,Trang 35.
- ^Natural Decay Series: Uranium, Radium, and Thorium(PDF).Argonne National Laboratory. 2005[2017-09-30].(Nguyên thủy nội dung(PDF)Lưu trữ với 2016-08-17 ).
- ^Luetzelschwab, J. W.; Googins, S. W.Radioactivity released from burning gas lantern mantles.Health Phys. 1984,46(4): 873–881.PMID 6706595.doi:10.1097/00004032-198404000-00013.
- ^Huyskens, C. J.; Hemelaar, J. T.; Kicken, P. J.Dose estimates for exposure to radioactivity in gas mantles.Sci. Total Environ. 1985,45:157–164.Bibcode:1985ScTEn..45..157H.PMID 4081711.S2CID 39901914.doi:10.1016/0048-9697(85)90216-5.
- ^Toxicological Profile for Thorium(PDF).Agency for Toxic Substances and Disease Registry U.S. Public Health Service: 4. 1990[2024-03-26].( nguyên thủy nội dungLưu trữ(PDF)Với 2004-10-21 ).
- ^Merkel, B.; Dudel, G.; et al.Untersuchungen zur radiologischen Emission des Uran-Tailings Schneckenstein(PDF)( báo cáo ). Sächsisches Staatsministerium für Umwelt und Landesentwicklung. 1988. (Nguyên thủy nội dung(PDF)Lưu trữ với 2013-01-08 )( tiếng Đức ).
- ^Stoll 2005,Trang 34.
- ^Thorium ToxFAQs(PDF).Agency for Toxic Substances and Disease Registry.[2017-09-29].( nguyên thủy nội dungLưu trữ(PDF)Với 2012-06-05 ).
- ^Compendium of Policy And Statutory Provisions Relating To Exploitation of Beach Sand Minerals.Department of Atomic Energy.[2008-12-19].(Nguyên thủy nội dungLưu trữ với 2008-12-04 ).
- ^Pfeiffer, W. C.; Penna-Franca, E.; Ribeiro, C. C.; Nogueira, A. R.; Londres, H.; Oliveira, A. E. Measurements of environmental radiation exposure dose rates at selected sites in Brazil. An. Acad. Bras. Ciênc. 1981,53(4): 683–691.PMID 7345962.
- ^Alberici, Emma.Italian military officials' trial ignites suspicions of links between weapon testing and birth defects in Sardinia.ABC News (Australian Broadcasting Corporation). 2019-01-29[2019-01-29].( nguyên thủy nội dungLưu trữVới 2019-01-29 ).
Sách tham khảo mục
[Biên tập]- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Butterworth-Heinemann. 1997.ISBN978-0-08-037941-8.
- Stoll, W. Thorium and Thorium Compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005.ISBN978-3-527-31097-5.doi:10.1002/14356007.a27_001.
- Wickleder, M. S.; Fourest, B.; Dorhout, P. K. Thorium. Morss, L. R.; Edelstein, N. M.; Fuger, J. ( biên ).The Chemistry of the Actinide and Transactinide Elements(PDF)33rd. Springer-Verlag. 2006: 52–160.ISBN978-1-4020-3598-2.doi:10.1007/1-4020-3598-5_3.(Nguyên thủy nội dung(PDF)Lưu trữ với 2017-12-14 ).
Kéo dài đọc
[Biên tập]- Martin, Richard.Super Fuel: Thorium, the Green Energy Source for the Future1st. Palgrave Macmillan. 2012:240.ISBN978-0-230-11647-4.
- Hargraves, Robert. Thorium: Energy Cheaper than Coal.CreateSpace Independent Publishing Platform.2012-07-25: 482.ISBN978-1478161295.
Phần ngoài liên kết
[Biên tập]- Nguyên tố thổ ởLạc tư a kéo mạc tư quốc gia phòng thí nghiệmGiới thiệu( tiếng Anh )
- EnvironmentalChemistry—— thổ( tiếng Anh )
- Nguyên tốThổỞThe Periodic Table of Videos( Nottingham đại học ) giới thiệu( tiếng Anh )
- Nguyên tố thổ ởPeter van der Krogt elements siteGiới thiệu( tiếng Anh )
- WebElements – thổ( tiếng Anh )
- International Thorium Energy Organisation – IThEO.org
- European Nuclear Society – Natural Decay Chains
- ATSDR CDC ToxFAQs: health questions about thorium
- FactSheet on Thorium(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), World Nuclear Association
- Thorium TV – A review of the element
- EnergyFromThorium – Content-rich site on Thorium as a future energy source, and its extraction technology(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- TED talk by former NASA engineer Kirk Sorensen about Thorium energy production (video)(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- India's experimental Thorium Fuel Cycle Nuclear Reactor (NDTV Report)(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- Thorium Remix 2011 – 120 minute Creative Commons Share-Alike documentary on Thorium as an energy source(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- Newspaper article about thorium power in India(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- China Blazes Trail for Clean Nuclear Power from Thorium(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- Thorium(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) atThe Periodic Table of Videos(University of Nottingham)
- Thorium Deposits of the United States—Energy Resources for the Future?(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) (USGS,2009)
- Thổ
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||




