Clo
Này điều mụcYêu cầuBiên tu,Lấy bảo đảm ngữ pháp,Dùng từ, ngữ khí,Cách thức,Dấu ngắt câuChờ sử dụng thỏa đáng.(2021 năm ngày 1 tháng 12) |
Clo( tiếng Anh:Chlorine), là một loạiNguyên tố hoá học,Hóa học ký hiệuVìCl,Nguyên tử sốVì 17, thuộc về kho tộc ( tức chu kỳ hệ ⅦA tộc ). Clo là đệ nhị nhẹHalogen,Ở vàoFloCùngXúChi gian, bởi vậy Clo phi kim loại tính xen vào chúng nó chi gian. Clo ở nhiệt độ phòng hạ là một loại có mãnh liệt kích thích tính khí vị hoàng lục sắc có độc khí thể, hoá lỏng sau biến thành màu vàng du trạng chất lỏng. Nó là phản ứng tính cực cường nguyên tố cùng cườngOxy hoá tề.CloĐiện tử lực tương tácỞ sở hữu nguyên tố trung tối cao, thả là bào lâmĐiện phụ độTrung đệ tam caoĐiện phụ tínhNguyên tố, chỉ thứ vớiOxyCùng Flo.
Từ viễn cổ thời kỳ, mọi người liền biết một loại hàm CloHoá chất——Natri clorua( dùng ăn muối chủ yếu thành phần ). 1630 năm,Khí CloỞ một lần ngẫu nhiên thực nghiệm trung lần đầu bị hợp thành ra tới, nhưng cũng không bị ngay lúc đó mọi người cho rằng là một loại quan trọng vật chất. 1774 năm,Carl · William · xá lặcViết một thiên về khí Clo miêu tả, phỏng đoán nó là tân nguyên tốOxy hoá vật.1809 năm,Joseph · Louis · cái - Lữ SaxCùngLouis · Jacques · thái nạp ngươiCho rằng loại này khí thể là một loại tân nguyên tố hoá học, mà cái này giả thiết từ Anh quốc nhà hóa họcHán phất · mang duyỞ 1810 năm chứng thực. Hắn lấy nên loại khí thể nhan sắc “Đạm lục sắc” ( cổ Hy Lạp văn: χλωρός, La Mã văn: khlôros ) vì này mệnh danh.
Bởi vì Clo thực hoạt bát, cho nên vỏ quả đất trung sở hữu Clo toàn lấyClo ly tửHoá chất hình thức tồn tại, tỷ nhưMuối ăn.Clo là hàm lượng đệ nhị nhiều halogen ( chỉ ở sauFloNguyên tố ), cũng là vỏ quả đất trung hàm lượng xếp hạng thứ hai mươi nhiều nguyên tố ( 0.031% ). Nhưng này đó vỏ quả đất trung Clo trầm tích vật cùngNước biểnTrung Clo hóa vật hàm lượng so sánh với tắc thua chị kém em.
Thương nghiệp sinh sản Clo là thông quaĐiện giảiMuối ăn thủyMà đến. Gia dụngThuốc tẩy trắng,Thuốc sát trùngCùng với công nghiệp dùng một ítHóa học thuốc thửKhai phá chính là đến vụ lợi Clo cao oxy hoá điện vị tính chất. Clo rộng khắp vận dụng với chế tạo người tiêu thụ sản phẩm, bao gồm hai phần ba hoá học hữu cơ phẩm như làPolyvinyl chloride,Rất nhiềuPlastic chế phẩmTrung gian sản vật cùng mặt khác không có bao hàm Clo nguyên tố đầu cuối sản phẩm.Bể bơiThường xuyên sử dụng hàm Clo hoá chất lấy duy trì hồ nước sạch sẽ cùng vệ sinh. Cao độ dày Clo nguyên tố đối sinh vật thể tới nói là cực độ nguy hiểm cùngCó độc,Thế chiến thứ nhấtTừng sử dụng khí Clo làm cái thứ nhấtChiến tranh hóa họcTề.
Các loại sinh vật đều yêu cầu lấy Clo ly tử hình thức tồn tại Clo. Mặt khác hình thức hàm Clo hoá chất ở sinh vật thể trung tắc rất ít tồn tại, nhân tạo hàm Clo hoá chất có chút có độc tính, có chút tắc vô.Cao tầng đại khíTrung lấyClo Flo hydrocarbonVì đại biểu hàm Clo hữu cơ phần tử là tạo thànhTầng ozoneHao tổn thủ phạm.Thích trung tính cầuĐem Clo ly tử oxy hoá thànhThứ Clo toan muốiLúc ấy sinh ra chút ít Clo nguyên tố, này nhưng làm sinh vật thể miễn dịch đối khángVi khuẩnMột bộ phận.
Lịch sử
[Biên tập]Nhất thường thấy Clo hoá chất —— natri clorua ở cổ đại đã biết. Nhà khảo cổ học phát hiện chứng cứ cho thấy, sớm tại công nguyên trước 3000 năm, nhân loại cũng đã bắt đầu sử dụngMuối mỏ,Sớm tại công nguyên trước 6000 năm đã bắt đầu sử dụngNước chát.[4]Nó ở đồ ăn trung tầm quan trọng ởCổ điển thời đạiLà mọi người đều biết, có khi dùng làm chi trả La Mã tướng quân cùng quân sự trại tạm giam phục vụ phí dụng.
Lúc đầu phát hiện
[Biên tập]Ước 900 thâm niên,Giả BillCùng Ba Tư y sư kiêm luyện kim thuật sĩKéo tềĐang ở nghiên cứusal ammoniac(Clo hóa Amoni), đương nó cùngVitriol( các loại kim loạiAxít muốiVật thuỷ hoá ) hỗn hợp khi, sẽ sinh raHCl.[5]Nhưng mà, ở này đó lúc đầu Clo hóa vật thực nghiệm trung, trạng thái khí sản vật tựa hồ bị vứt bỏ, ở phát hiện nó có thể dùng cho hóa học sử dụng phía trước, HCl khả năng đã bị hợp thành rất nhiều lần.[6]Clo một cái quan trọng phát triển làNghĩ giả BillPhát hiện. Hắn đem Clo hóa Amoni cùngAxit nitricHỗn hợp, được đến một loại có thể hòa tan kim dung môi, cũng chính làCường toan.[7]Tuy rằng cường toan là không ổn định chất hỗn hợp, sẽ liên tục phát ra đựng khí Clo sương khói, nhưng chúng nó ở phía trước vẫn luôn bị bỏ qua. Thẳng đến 1630 năm,Dương · ba phổ đế tư tháp · phạm · hải ngươi mông đặcMới phát hiện đến nó là một loại trạng thái khí vật chất.[8][note 1]
Chia lìa
[Biên tập]
Clo với 1774 năm lần đầu từCarl · William · xá lặcNghiên cứu. Cái này phát hiện quy công với hắn.[9][10]Hắn thông quaMnO2( lấyQuặng ôxít măng ganHình thức ) cùng HCl phản ứng sinh thành khí Clo:[8]
Xá lặc quan sát tới rồi khí Clo một ít tính chất: Tẩy trắngĐịa y cành,Giết chết côn trùng, hoàng lục sắc, khí vị giốngCường toan.[11]Hắn đem khí Clo xưng là “Thoát châm tố axit clohidric khí”, bởi vì nó là nguyên vớiAxit clohidricKhí thể.[10]Hắn không thể đem Clo xác nhận vì một loại nguyên tố.[10]
Lúc ấy cho rằng toan trung nhất định có oxy, cho nên rất nhiều nhà hóa học, bao gồmClaude · bối thác laiĐều cho rằng xá lặc “Thoát châm tố axit clohidric khí” khẳng định là oxy cùng không biết nguyên tốmuriaticumHoá chất.[12][13]
1809 năm,Joseph · Louis · cái - Lữ SaxCùngLouis · Jacques · thái nạp ngươiNếm thử phân giải “Thoát châm tố axit clohidric khí”. Bọn họ đem than cùng “Thoát châm tố axit clohidric khí” phản ứng, ý đồ được đếnmuriaticum( cùng CO2 ).[10]Bọn họ không có thành công đồng phát biểu một phần báo cáo, trong đó bọn họ suy xét “Thoát châm tố axit clohidric khí” là một loại nguyên tố khả năng tính, nhưng không có bị thuyết phục.[14]
1810 năm,Hán phất · mang duyTrọng thử cái này thực nghiệm, cũng xác nhận loại này vật chất là một loại nguyên tố, không phải hoá chất.[10]Cùng năm ngày 15 tháng 11, hắn hướng hoàng gia học được tuyên bố hắn kết quả.[8]Lúc ấy, hắn đem loại này nguyên tố xưng làchlorine.Cái này từ nơi phát ra với Hy Lạp vănχλωρος(chlōros), ý vì “Hoàng lục sắc”, tức khí Clo nhan sắc.[15]1823 năm,Michael · FaradayLần đầu lấy được dịch Clo.[16][17][18]
Lúc sau tác dụng
[Biên tập]1785 năm,Claude · bối thác laiPhát hiện khí Clo có thể tẩy trắng vải dệt.[19][20]Hiện tại thuốc tẩy trắng đều là bối thác lai tiến thêm một bước công tác. 1789 năm, hắn ở chính mình ở vàoNhã phất ngươi( hiện tại làParisMột bộ phận ) phòng thí nghiệm, thông qua khí Clo thông qua soda dung dịch lần đầu hợp thànhThứ Clo toan Natri.Phản ứng được đến chất lỏng được xưng là “Eau de Javel”(Nhã phất ngươi thủy), vìThứ Clo toan NatriDung dịch. Cái này quá trình không phải rất có hiệu, hơn nữa mọi người đều đang tìm cầu thay thế sinh sản phương pháp.Charles TennantĐầu tiên sinh sảnThứ Clo toan Canxi( Clo hoá thạch hôi ) dung dịch, sau đó là thể rắn thứ Clo toan Canxi ( bột tẩy trắng ).[19]Này đó hoá chất sinh ra Clo hàm lượng thấp, hơn nữa có thể so thứ Clo toan Natri càng có hiệu mà vận chuyển. Chúng nó vẫn vì hi dung dịch, bởi vì đương trải qua tinh luyện lấy tiêu trừ thủy khi, nó sẽ trở thành một loại nguy hiểm, cường đại thả không ổn định oxy hoá tề. Ở 19 cuối thế kỷ, E. S. Smith đạt được một loại thứ Clo toan Natri sinh sản phương pháp độc quyền. Phương pháp này đề cập điện giảiNước chátLấy sinh sảnSodium hydroxideCùng khí Clo, sau đó hỗn hợp hình thành thứ Clo toan Natri.[21]Này được xưng làClo kiềm pháp,Với 1892 năm lần đầu lấy công nghiệp quy mô dẫn vào, hiện tại là đại bộ phận khí Clo cùng sodium hydroxide nơi phát ra.[22]1884 năm, nước Đức Chemischen Fabrik Griesheim khai phá một loại khácClo kiềm pháp,Cũng với 1888 năm tiến vào thương nghiệp sinh sản.[23]
1820 niên đại, sớm tạiBệnh tật vi trùng học nóiThành lập trước, nước Pháp lúc ban đầu dùng hòa tanKiềmClo dung dịch ( thứ Clo toan Natri cùngThứ Clo toan Canxi) tới làm khángThi thể hủ bạiTề cùngThuốc sát trùng.Loại này cách làm là từAntoine-Germain LabarraqueKhai sáng, hắn cải biên bối thác lai “Nhã phất ngươi thủy” thuốc tẩy trắng cùng mặt khác Clo chế bị phương pháp.[24]Tự kia về sau, Clo nguyên tố ở bộ phậnTiêu độc( miệng vết thương súc rửa dịch chờ ) cùng vệ sinh công cộng, đặc biệt là bơi lội cùng dùng để uống thủy phương diện liên tục phát huy tác dụng.[11]
ỞY Pearl,Khí Clo với 1915 năm ngày 22 tháng 4 lần đầu bịÐức đế quốc lục quânDùng làm vũ khí.[25][26]Clo cái này vũ khí đối minh hữu ảnh hưởng là có tính chất huỷ diệt, bởi vì ngay lúc đóMặt nạ phòng độcKhó có thể bố trí, thả không có rộng khắp sử dụng.[27][28]
Tên ngọn nguồn
[Biên tập]Tiếng AnhTên chlorine đến từ vớiHy Lạp vănkhlôros(χλωρóς',ĐạmLụcSắc ). 19 thế kỷ 70 niên đại, Trung Quốc nhà hóa họcTừ thọĐem này dịch vì lục khí. 1933 năm, nhà hóa họcTrịnh trinh vănỞ 《 hóa học mệnh danh nguyên tắc 》 trung đem cái này tự sửa vì “Clo”.[29]ỞNgày vănCùngHàn VănTrung, bởi vì Clo làMuốiChủ yếu thành phần chi nhất mà xưng là “Muối tố” (Nhật Bản chữ HánHiện tại viết làm “Diêm tố”).
Tự nhiên phân bố
[Biên tập]Khí Clo hoạt tính quá cao, sẽ không ở thiên nhiên trung tồn tại. Bất quá Clo hóa vật ở thiên nhiên rộng khắp tồn tại. Nó là vỏ quả đất đệ 21 nhiều nguyên tố, chiếm 126ppm,Đại bộ phận lấy Clo hóa vật khoáng vật tồn tại, đặc biệt là từ thủy thể bốc hơi tớiNatri clorua.Cùng trong nước biển Clo ly tử số lượng dự trữ so sánh với, sở hữu này đó đều thua chị kém em: Cao độ dày Clo ly tử ở một ít nội hải cùng ngầmNước chátTrong giếng, như bang UtahMuối hồCùng IsraelBiển chếtCó thể tìm được.[30]
Trong giới tự nhiên tự do trạng thái Clo tồn tại vớiTầng khí quyểnTrung, là phá hưTầng ozoneĐơn chất chi nhất. Khí Clo chịu tử ngoại tuyến phân giải thành hai cái Clo nguyên tử ( tự do cơ ).
Sinh sản
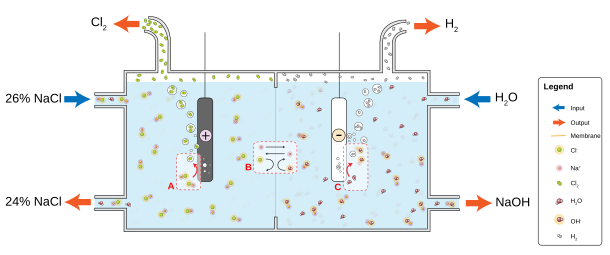
[Biên tập]Phòng thí nghiệm trung có thể thông qua axit clohidric cùngNhị oxy hoá mạnhPhản ứng lấy được chút ít khí Clo, nhưng bởi vì này đó khí Clo tùy thời nhưng dùng, bởi vậy rất ít xuất hiện loại này nhu cầu. Ở công nghiệp thượng, Clo thông thường là thông qua điện giải hòa tan ở trong nước natri clorua tới sinh sản. Phương pháp này được xưng làClo kiềm pháp,Ở 1892 năm công nghiệp hoá, hiện tại là cung cấp đại bộ phận công nghiệp khí Clo phương pháp.[22]Cái này phản ứng cũng sẽ sinh thànhHydroCùngSodium hydroxide.Cái này phản ứng như sau:[31]
Clo hóa vật dung dịch điện giải đều dựa theo dưới phương trình tiến hành:
- Âm cực: 2 H2O + 2 e−→ H2+ 2 OH−
- Dương cực: 2 Cl−→ Cl2+ 2 e−
Ở vách ngăn điện giải tào điện giải trung,A-mi-ăng( hoặc tụ hợp vật sợi ) vách ngăn đem âm cực cùngDương cựcNgăn cách, phòng ngừa ở dương cực sinh thành Clo cùng ở âm cực sinh thành sodium hydroxide cùng hydro một lần nữa hỗn hợp.[32]Nước muối dung dịch bị liên tục đưa vào dương cực thất, cũng thông qua vách ngăn chảy tới âm cực thất, ở nơi đó sinh raĂn mòn tínhKiềmCũng háo rớt bộ phận nước muối. Vách ngăn pháp sinh ra kiềm là hơi không thuần hi kiềm, nhưng không cóThủy ngânXử lý vấn đề, hơn nữa càng tiết kiệm năng lượng.[22]
Vách ngăn điện giải tào điện giải chọn dùngNửa thấu màngLàmLy tử trao đổiTề. Bão hòa natri clorua ( hoặc Clo hóa Kali ) dung dịch thông qua dương cực thất, lấy so thấpĐộ dàyRời đi. Loại này phương pháp cũng có thể sinh sản phi thường thuần sodium hydroxide ( hoặc hydro oxy hoá Kali ), nhưng khuyết điểm là yêu cầu cao độ dày phi thường thuần nước muối.[33]
ỞDeacon phápTrung, HCl bị dưỡng khí oxy hoá, sinh thành khí Clo:
- 4 HCl + O2→ 2 Cl2+ 2 H2O
Nên phản ứng yêu cầu chất xúc tác. Chính như Deacon giới thiệu như vậy, lúc đầu chất xúc tác là căn cứ vào đồng. Hiện tại đã chuyển hướng sử dụng các cơ cùng liễu cơ chất xúc tác.[34]
Tính chất
[Biên tập]

Clo là halogen cái thứ hai nguyên tố, ở nguyên tố bảng chu kỳ trung vì đệ 17 tộc, bởi vậy nó đặc tính cùng Flo, xú cùng iốt thực tương tự, nó đại bộ phận đặc tính giới với Flo cùng xú chi gian. Clo điện tử quỹ vực hình thể vì [Ne]3s23p5,Ở đệ tam cùng với nhất ngoại tầng quỹ vực điện tử có bảy cái, này biểu hiện vì bảy cái giới điện tử, giống như sở hữu halogen, Clo cũng so hoàn chỉnh tám ngung thể thiếu một cái điện tử, bởi vậy vì rất mạnh oxy hoá tề, sẽ cùng rất nhiều nguyên tố phản ứng lấy sử nó ngoại tầng quỹ vực trở nên hoàn chỉnh.[35]Đối ứng với bảng chu kỳ vị trí, Clo điện phụ độ giới với Flo cùng xú chi gian ( Flo: 3.98, Clo: 3.16, xú: 2.96, iốt: 2.66 ), hoạt tính so Flo thấp, nhưng so xú sinh động, Clo cùng Flo so sánh với vì yếu kém oxy hoá tề, cùng xú so sánh với tắc vì so cường oxy hoá tề.[35]Bởi vì Clo nguyên tử bán kính giới với Flo cùng xú chi gian, bởi vậy Clo rất nhiều nguyên tử đặc tính kéo dài iốt đến xú xu thế, tỷ như đệ nhất tự do có thể, điện tử lực tương tác, X2Phần tử phân ly hàm ( X vì Clo, xú, iốt ), ly tử bán kính cùng với X cùng X chi gian kiện chiều dài. ( Flo bởi vì nhỏ lại cho nên tương đối đặc dị ).[35]
Bốn cái so ổn định halogen toàn chịu phần tử gian phàm đến Wahl lực hấp dẫn, thả phàm đến Wahl lực cường độ sẽ theo cùng hạch song nguyên tử phần tử điện tử số lượng mà gia tăng, bởi vậy Clo dung điểm cùng điểm sôi giới với Flo cùng xú chi gian, Clo dung điểm vì −101.0 °C thả điểm sôi vì −34.0 °C, bởi vì halogen càng đi bảng chu kỳ phía dưới phân tử lượng càng cao, Clo nóng chảy nóng hổi hoá khí nhiệt cũng giới với Flo cùng xú chi gian, bởi vì song nguyên tử phần tử kết cấu nguyên nhân, chúng nó hoá khí nhiệt tương đương thấp ( tạo thành so dễ phát huy ).[35]Halogen nhất tộc càng đi hạ nhan sắc càng sâu, Flo là màu vàng nhạt khí thể, Clo là rõ ràng hoàng lục sắc, sẽ có như vậy xu thế là bởi vì halogen càng đi bảng chu kỳ phía dưới hấp thu ánh sáng mắt thường nhìn thấy được bước sóng gia tăng gây ra.[35]Đương điện tử từ tối cao chiếm hữu phản kiện kết πg phần tử quỹ vực quá độ đến thấp nhất phản kiện kết σu phần tử quỹ vực khi liền sẽ hình thành halogen nhan sắc.[36]Này đó nhan sắc sẽ ở so nhiệt độ thấp hạ phai màu, bởi vậy ở −195 °C trạng thái cố định Clo là gần như vô sắc.[35]
Giống trạng thái cố định xú cùng với iốt, trạng thái cố định Clo ở nghiêng phương tinh hệ kết tinh vì Clo phần tử tầng trạng tinh cách, nó liên kết hoá học khoảng cách là 198 pm ( tương đương tiếp cận khí Clo liên kết hoá học khoảng cách 199 pm ) thả ở một tầng trung Clo phần tử cùng phần tử khoảng cách vì 332 pm, mà tầng cùng tầng chi gian khoảng cách là 382 pm ( tương so với Clo phàm đến Wahl bán kính vì 180 pm ), này kết cấu tỏ vẻ Clo là rất kém cỏi dẫn điện thể, trên thực tế Clo dẫn điện độ cũng xác thật cực thấp mà vô pháp đo lường.[35]
Chất đồng vị
[Biên tập]Clo có hai cái ổn địnhChất đồng vị:Clo -35 cùng Clo -37. Này hai cái chất đồng vị là Clo ở thiên nhiên trung duy nhị tồn tại hình thức, trong đó Clo -35 chiếm 76%, mà Clo -37 tắc chiếm dư lại 24%, này hai cái chất đồng vị là từ hằng tinh kinhOxy thiêu đốt quá trìnhCùng vớiTịch thiêu đốt quá trìnhMà hình thành[37].Tuy rằng hạch sự quay tròn biên độ lớn hơn 1/2 sẽ tạo thành phi cầu hình hạch điện tích phân bố, cùng vớiCộng hưởngBiến quảng mà tạo thành phi linh giá trị hạch bốn cực củ cùng bốn tính có cực chậm chạp, nhưng hai cái chất đồng vị đều có hạch sự quay tròn 3/2+, bởi vậy nhưng dùng ở cộng hưởng từ hạt nhân quang phổ. Mặt khác Clo chất đồng vị toàn cụ tính phóng xạ, thảThời kỳ bán phân rãQuá ngắn mà vô pháp tồn tại trong giới tự nhiên, bởi vậy, nhất thường dùng với phòng thí nghiệm chính là Clo -36 ( thời kỳ bán phân rã vì 3×105Năm ) cùng Clo -38 ( thời kỳ bán phân rã vì 37.2 phút ), Clo -36 cùng Clo -38 nhưng tạ từ trong giới tự nhiên Clo nơ-tron hoạt hoá mà chế thành.[35]
Clo nhất ổn định tính phóng xạ chất đồng vị vì Clo -36, so Clo -35 còn nhẹ chất đồng vị chủ yếu suy biến hình thức làĐiện tử bắt đượcMà biến thànhLưuChất đồng vị, so Clo -37 còn trọng chất đồng vị sẽ kinhSuy biến hình thành氬Chất đồng vị, mà Clo -36 sẽ suy biến thành ổn định lưu -36 hoặc 氬-36.[38]Làm vũ trụ nguyên tính phóng xạ chất đồng vị hạch loại, Clo -36 tồn tại với thiên nhiên lượng cùng ổn định Clo chất đồng vị so sánh với, tỉ lệ ước vì 7× 10−13–1×10−12So 1. Nó là từ 氬-36 tiếp xúc tia vũ trụ trung hạt nhân tác dụng sau tán nứt với đại khí trung mà sinh ra. Ở nham thạch vòng đỉnh chóp, Clo -36 chủ yếu là xuyên thấu qua Clo -35 mưu cầu danh lợi tử hoạt hoá cùng vớiKali -39CùngCanxi -40Tán nứt sở sinh ra. Dưới nền đất hạ hoàn cảnh, Canxi -40 sẽ bắt lấyMiểu tửMà sinh ra Clo -36, này loại phương thức đối với sinh ra Clo -36 trở nên càng ngày càng quan trọng.[39][40]
Tính chất hoá học
[Biên tập]| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Clo phản ứng tính ở Flo cùng xú chi gian, cũng là phản ứng tính tối cao nguyên tố chi nhất. Clo oxy hoá tính so Flo nhược, nhưng so xú cùng iốt cường. Này có thể từ halogen X2/X−Tiêu chuẩn điện cực điện thếTrung quan sát đến ( F +2.866 V, Cl +1.395 V, Br +1.087 V, I +0.615 V, At ước vì +0.3 V ). Bất quá, cái này xu thế không tồn tại với halogen đơn chất X-X kiện kiện cường, bởi vì Flo nguyên tử rất nhỏ, thấp sự phân cực tính, cũng không thể hình thànhSiêu giới phần tử.Làm tương đối, Clo chính oxy hoá thái thực thường thấy, mà Flo không phải như thế. Clo hóa có thể được đến so xú hóa cùng iốt hóa càng cao oxy hoá thái, nhưng này so Flo hóa được đến oxy hoá thái thấp. Clo có thể cùng đựng M–M, M–H, M–C kiện vật chất phản ứng, hình thành M–Cl kiện.[36]
Bởi vì 𝐸ᶱ (1/2O2/H2O) = +1.229 V, nhỏ hơn Clo +1.395 V, bởi vậy Clo bị cho rằng có thể oxy hoá thủy, hình thành axit clohidric cùng dưỡng khí. Nhưng là, cái này phản ứng ở động lực học bất lợi, thả yêu cầu suy xét bọt khíBị điện giật vịHiệu ứng. Bởi vậy, Clo hóa vật thủy dung dịch điện giải sẽ sinh ra khí Clo mà không phải dưỡng khí, đối khí Clo công nghiệp sinh sản phi thường hữu dụng.[41]
Hoá chất
[Biên tập]Clo có thể hình thành nhiều loại vô cơ hoá chất, nhưClo hóa vật,Thứ Clo toan muối,Á Clo toan muối,Clo toan muối,Cao Clo toan muốiChờ, cũng có thể hình thành đông đảo hợp chất hữu cơ,Hữu cơ Clo hoá chấtBao gồm các loại Clo đại hydrocarbon ( nhưTam Clo metan,Clo benzenChờ ), Acid carboxylic hợp chất diễn sinhTiên CloChờ.
HCl
[Biên tập]
Đơn giản nhất Clo hoá chất làHCl,Công thức hoá học HCl, là công nghiệp cùng phòng thí nghiệm trung chủ yếu hóa học phẩm, nhiệt độ bình thường hạ vì khí thể, hòa tan thủy hình thànhAxit clohidric.Nó có thể từ hydro ở khí Clo thiêu đốt mà thành, cũng là Clo hóaThan hydro hoá chấtSinh ra phó sản vật. Mặt khác một loại chế bị axit clohidric phương pháp làHClCùng nùngAxítPhản ứng:[42]
- NaCl + H2SO4NaHSO4+ HCl
- NaCl + NaHSO4Na2SO4+ HCl
Ở phòng thí nghiệm, HCl có thể từ axit đậm đặc đối axit clohidric mất nước mà thành. Clo hóa Deuteri, công thức hoá học DCl, có thể từBenzen tiên CloCùngTrọng thủy(D2O) phản ứng mà thành.[42]
Cùng trừ bỏFlo hóa hydroBên ngoài kho hóa hydro giống nhau, nhiệt độ bình thường hạ HCl là một loại vô sắc khí thể. HCl là khí thể nguyên nhân là hydro không thể cùng trọng đại Clo nguyên tử hình thànhHydro kiện.Bất quá, nhiệt độ thấp hạ HCl tinh thể có nhược hydro kiện. Loại này tựa với Flo hóa hydro kết cấu, ở độ ấm lên cao khi bắt đầu xuất hiện vô tự.[42]Axit clohidric là cường toan ( pKa= −7 ), đây là bởi vì hydro kiện quá yếu, phòng ngừa không hiểu biết ly mà thành. HCl/H2O hệ thống có rất nhiều HCl·nH2O vật thuỷ hoá, trong đón= 1, 2, 3, 4 cùng 6. Ở HCl cùng thủy 1:1 chất hỗn hợp lúc sau, nên hệ thống hoàn toàn chia lìa thành hai cái độc lập dịch tướng. Axit clohidric sẽ hình thành một loạiCộng phí vật,Điểm sôi 108.58 °C, ở 100g dung dịch có 20.22 g HCl. So cái này càng đậm axit clohidric không thể thông qua chưng cất chế bị.[43]
Không giống vô thủy Flo hóa hydro, vô thủy HCl khó có thể làm dung môi, bởi vì nó điểm sôi thấp, trạng thái dịch phạm vi tiểu,Tương đối điện dung suấtThấp, sẽ không tự ngẫu nhiên điện ly thành H2Cl+CùngHCl−
2Ly tử. Người sau cùng loại vớiFlo hóa hydro cănLy tử (HF−
2), trong đó hydro cùng Clo chi gian có cực nhược hydro kiện, đối ứngCs+CùngNR+
4( R =Me,Et,Bun) muối nhưng chia lìa. Vô thủy HCl là một loại nhược dung môi, chỉ có thể hòa tan như làÁ tiêu tiên CloCùngPhenolNhư vậy tiểu phần tử, hoặc làTinh cách có thểCực thấp bốn hoàn cơ kho hóa Amoni. Nó có thể hạt nhân hóa đựng cô đối điện tử hoặc π kiệnThân điện thể.Cùng dung môi phản ứng,Xứng thểTrao đổi phản ứng cùng oxy hoá phản ứng ở HCl dung dịch trung rộng khắp tồn tại:[44]
- Ph3SnCl + HCl ⟶ Ph2SnCl2+ PhH ( cùng dung môi phản ứng )
- Ph3COH + 3 HCl ⟶Ph
3C+
HCl−
2+ H3O+Cl−( cùng dung môi phản ứng ) - Me
4N+
HCl−
2+ BCl3⟶Me
4N+
BCl−
4+ HCl ( xứng thể trao đổi ) - PCl3+ Cl2+ HCl ⟶PCl+
4HCl−
2( oxy hoá )
Cái khác hai nguyên tố Clo hóa vật
[Biên tập]
Cơ hồ sở hữu nguyên tố đều có thể hình thành hai nguyên tố Clo hóa vật. Không thể hình thành hai nguyên tố Clo hóa vật nguyên nhân có ba cái: Cực độ tính trơ, khó có thể tham dự phản ứng hoá học ( tỷ nhưKhí trơ,Sẽ hình thành cực không ổn địnhXeCl2CùngXeCl4TiênNgoại trừ ); tính phóng xạ cực cường, sẽ ở phản ứng trước suy biến ( đại bộ phậnBíSau nguyên tố ); cùng với điện phụ tính so Clo đại (OxyCùngFlo), lúc này hình thành hoá chất không gọi Clo hóa vật, mà là oxy hoá vật hoặc Flo hóa vật.[45]
Ở có có thể biến đổi oxy hoá thái kim loại trung, sử dụng Cl2Clo hóa kim loại sẽ so sử dụng Br2Xú hóa kim loại được đến oxy hoá thái cao. Cử cái ví dụ: Mục phân biệt bị Clo cùng xú kho hóa sẽ phân biệt được đếnMoCl5CùngMoBr3.Clo hóa vật cũng có thể từ nguyên tố đơn chất hoặc nó oxy hoá vật, hydro oxy hoá vật cùng than toan muối cùng axit clohidric phản ứng mà thành, sau đó ở trung cực nóng hạ, thông qua áp lực thấp hoặc vô thủy HCl khí thể kết hợp tới mất nước. Chế bị thấpOxy hoá tháiClo hóa vật có thể từ hydro hoặc kim loại hoàn nguyên giá cao Clo hóa vật mà thành. Chúng nó cũng có thể thông qua kỳ hóa phản ứng hoặc phân giải sinh ra:[45]
- EuCl3+1/2H2⟶ EuCl2+ HCl
- ReCl5ReCl3+ Cl2
- AuCl3AuCl + Cl2
Đại bộ phận kim loại kiềm, kim loại kiềm thổ cùng 3 tộc nguyên tố, còn có ở vào +2 cùng +3 oxy hoá tháiLan hệ nguyên tốCùngA hệ nguyên tốHình thành Clo hóa vật là ly tử hình, mà phi kim loại còn có oxy hoá thái lớn hơn +3 kim loại sẽ hình thành cộng giới phần tử hình Clo hóa vật.Clo hóa bạcKhông hòa tan thủy, có thể dùng để kiểm tra đo lường Clo ly tử.[45]
Nhiều Clo hoá chất
[Biên tập]Tuy rằng khí Clo là một loại cường oxy hoá tề, có rất cao điện ly có thể, ở cực đoan điều kiện hạ nó cũng có thể bị điện ly thànhCl+
2Dương ly tử. Nó phi thường không ổn định, chỉ có ở áp lực thấp phóng điện quản trung sinh ra khi tài năng có này điện tử mang phổ đặc thù. Màu vàngCl+
3Dương ly tử tương đối ổn định, có thể thông qua phía dưới phương pháp sinh ra:[46]
- Cl2+ ClF + AsF5Cl+
3AsF−
6
Nên phản ứng ở oxy hoá tính dung môiNăm Flo hóa thânTrung tiến hành. Tam Clo i-on âm, công thức hoá họcCl−
3Cũng là đã biết, kết cấu cùng loạiTam iốt i-on âm.[47]
Clo Flo hóa vật
[Biên tập]Clo có ba loại Flo hóa vật, đều làPhản từ tínhLẫn nhau kho hóa vật.[47]Một ít ly tử hợp chất diễn sinh cũng là đã biết, tỷ nhưClF−
2,ClF−
4,ClF+
2Cùng Cl2F+.[48]
Một Flo hóa Clo( ClF ) ở nhiệt lực học ổn định, có thể lấy 500 khắc can hình thức thương mua. Nó là một loại vô sắc khí thể, điểm nóng chảy −155.6 °C, điểm sôi −100.1 °C. Nó có thể từ Flo cùng Clo ở 225 °C hạ trực tiếp phản ứng mà thành, yêu cầu cùngTam Flo hóa CloCùng phản ứng vật chia lìa. Nó tính chất phần lớn xen vào Flo cùng Clo chi gian. Nó sẽ Flo hóa rất nhiều kim loại cùng phi kim loại, cũng thả ra Clo. Nó cũng là một loại Flo Clo hóa thuốc thử, sẽ đemCarbon monoxitFlo Clo hóa thành than tiên Flo Clo ( công thức hoá học COFCl ), ởFlo hóa KaliThôi hóa hạ cùngSáu Flo aceton( công thức hoá học (CF3)2CO ) phản ứng thành thứ Clo toan bảy Flo dị Bính chỉ, công thức hoá học (CF3)2CFOCl. Một Flo hóa Clo cũng sẽ cùngKinhRCN phản ứng, hình thành RCF2NCl2.Nó cũng cùng lưu oxy hoá vật SO2Cùng SO3Phản ứng, phân biệt hình thành ClSO2F cùng ClOSO2F. Nó sẽ cùng đựng –OH cùng –NH gốc vật chất ( như là thủy cùng Amonia ) kịch liệt phản ứng.[47]
- H2O + 2 ClF ⟶ 2 HF + Cl2O
Tam Flo hóa Clo( ClF3) là tính bốc hơi vô sắc chất lỏng, điểm nóng chảy −76.3 °C, điểm sôi 11.8 °C. Nó có thể từ Flo khí cùng một Flo hóa Clo ở 200–300 °C hạ phản ứng mà thành. Nó là đã biết nhất hoạt bát vật chất chi nhất, sẽ cùng rất nhiều ở trong tình huống bình thường bị cho rằng có hóa học tính trơ vật chất phát sinh phản ứng, như làA-mi-ăng,Bê tông cùng sa. Nó sẽ cùng rất nhiều chất hữu cơ cùng thủy phản ứng, phát sinh nổ mạnh. Nó có thể bậc lửa rất nhiều nguyên tố, bao gồmHydro,Kali,Lân,Thân,Đễ,Lưu,Selen,Đế,Xú,Iốt,Còn có bột phấn trạngMục,Wolfram,Lão,Y,Thiết.Nó cùngNatri,Magie,Nhôm,Kẽm,Tích,BạcPhản ứng sẽ hình thành không ra thủy Flo hóa vật tầng, có thể thông qua đun nóng đi trừ. Đương đun nóng khi,Ba,Bạc,KimChờKháng ăn mòn kim loạiĐều sẽ cùng nó phản ứng, liềnKhí trơTiênCùngĐôngĐều chạy thoát không được Flo hóa.NickelVật chứa thông thường dùng để chứa đựng tam Flo hóa Clo, bởi vì nó sẽ hình thành hoạt tính thấp Flo hóa Nickel ô dù. Nó cùngTỉnhPhản ứng, hình thành Flo hóa hydro, khí Clo cùng khí nitơ, nhưng dùng cho thực nghiệm hỏa tiễn động cơ, nhưng vấn đề chủ yếu nguyên với này cực đoanNhiên liệu tự cháy tính,Dẫn tới đốt lửa không có bất luận cái gì nhưng đo lường lùi lại. Hôm nay, tam Flo hóa Clo chủ yếu dùng cho nhiên liệu hạt nhân, đemUraniFlo hóa thànhSáu Flo hóa UraniTới đến áp súc Urani cùng chia lìaBất.Nó cũng là một loại Flo ly tử cung thể hoặc chịu thể, tuy rằng nó sẽ không điện ly thànhClF+
2CùngClF−
4Ly tử.[49]
Năm Flo hóa Clo( ClF5) có thể từ Clo cùng đại lượngFlo khíỞ 350 °C cùng 250 cái áp suất không khí hạ phản ứng mà thành. Nó điểm nóng chảy vì −103 °C, điểm sôi vì −13.1 °C. Nó là phi thường cường Flo hóa tề, nhưng so tam Flo hóa Clo nhược. Nó cùngNăm Flo hóa thânCùngNăm Flo hóa đễPhản ứng, hình thành ly tử hình thêm hợp vật [ClF4]+[MF6]−( M = As, Sb ). Năm Flo hóa Clo cùng thủy kịch liệt phản ứng:[50]
- 2 H2O + ClF5⟶ 4 HF + FClO2
Sản vậtClo tiên FloLà năm loại đã biết Flo oxy hoá Clo chi nhất, cái khác bốn loại phân biệt là nhiệt lực học không ổn định FClO, hoạt tính không quá caoCao Clo tiên FloFClO3,F3ClO cùng F3ClO2.Chúng nó tính chất cùng loại với Clo Flo hóa vật, cũng là phi thường cường oxy hoá tề cùng Flo hóa tề.[51]
Clo oxy hoá vật
[Biên tập]

Clo oxy hoá vậtCứ việc không ổn định ( chúng nó đều là hút nhiệt hoá hợp vật ), nhưng đã được đến đầy đủ nghiên cứu. Chúng nó rất quan trọng, bởi vì chúng nó là ở Clo Flo hydrocarbon ở cao tầng đại khí trung tiến hành quang hoá phân giải cũng dẫn tới tầng ozone phá hư khi sinh ra. Chúng nó đều không thể từ Clo cùng oxy trực tiếp phản ứng mà thành.[52]
Một oxy hoá nhị Clo(Cl2O) là một loại nâu nhạt sắc khí thể, có thể từ khí Clo cùng màu vàngOxy hoá thủy ngânPhản ứng mà thành. Nó dễ hòa tan thủy, sẽ cùngThứ Clo toan(HOCl) hình thành cân bằng. Nó là một loại hữu hiệu thuốc tẩy trắng, có thể chế bịThứ Clo toan muối.Nó ở đun nóng, hỏa hoa hoặc tồn tại NH₃ khi nổ mạnh.[52]
Nhị oxy hoá Clo(ClO2) là đệ nhất loại bị phát hiện Clo oxy hoá vật, với 1811 năm từHán phất · mang duyPhát hiện. Nó là một loại thuận từ tính màu vàng chất lỏng, có số lẻ viên điện tử. Bởi vì chưa ghép đôi điện tử ly vực, nó sẽ không nhị tụ. Nó ở −40 °C trở lên nổ mạnh, bởi vậy dùng cho mái chèo tẩy trắng cùng thủy xử lý nhị oxy hoá Clo cần thiết là thấp độ dày. Nó thông thường lấy hoàn nguyênClo toan muốiPhương pháp chế bị:[52]
- ClO−
3+ Cl−+ 2 H+⟶ ClO2+1/2Cl2+ H2O
Bởi vậy, này sinh sản cùng Clo hàm oxy toan oxy hoá hoàn nguyên phản ứng chặt chẽ tương quan. Nó là một loại cường oxy hoá tề, sẽ cùngLưu,Lân,Kho hóa lânCùngBoron hydro hóa KaliPhản ứng. Nó ở trong nước phóng nhiệt hòa tan, hình thành thâm màu xanh lục dung dịch, trong bóng đêm phi thường thong thả mà phân giải. Bất quá ở chiếu sáng hạ, cái này dung dịch sẽ nhanh chóng phân giải thành axit clohidric cùng Clo toan. Đơn độc ClO2Phần tử quang hoá phân giải sẽ sinh ra ClO cùng ClOO tự do cơ, ở nhiệt độ phòng hạ sẽ sinh ra Clo, oxy, còn có một ít ClO3Cùng Cl2O6.Cl2O3Có thể thông qua ở −78 °C quang hoá phân giải nhị oxy hoá Clo thể rắn mà thành. Nó là một loại thâm màu nâu thể rắn, ở 0 °C dưới nổ mạnh. ClO tự do cơ nhưng thông qua dưới phản ứng, phá hư đại khí trung ozone:[52]
- Cl• + O3⟶ ClO• + O2
- ClO• + O• ⟶ Cl• + O2
Cao Clo toan Clo(ClOClO3) là một loại màu vàng nhạt chất lỏng, ổn định tính so ClO2Thấp, ở nhiệt độ phòng hạ phân giải thành Clo, oxy cùngSáu oxy hoá nhị Clo(Cl2O6).[52]Cao Clo toan Clo có thể coi như làCao Clo toan(HOClO3) Clo hợp chất diễn sinh, cùng loại với cái khác hàm oxy toan không ổn định Clo hợp chất diễn sinh như:Axit nitric Clo( ClONO2,Cao phản ứng tính cùng nổ mạnh tính ) cùng Flo hoàng toan Clo ( ClOSO2F, tương đối ổn định, bất quá vẫn là cao phản ứng tính ôn hoà thuỷ phân ).[53]Sáu oxy hoá nhị Clo là một loại màu đỏ thẫm chất lỏng, ở −180 °C hạ vì màu vàng thể rắn. Nó có thể từ nhị oxy hoá Clo cùng dưỡng khí phản ứng mà thành. So với là ClO3Nhị tụ thể, nó kết cấu càng như là [ClO2]+[ClO4]−.Nó thuỷ phân thành Clo toan cùng cao Clo toan, mà cùngFlo hóa hydroPhản ứng không hoàn toàn.[52]
Bảy oxy hoá nhị Clo( Cl2O7) làCao Clo toan( HClO4) an-đê-hít, có thể từAxit phosphoricỞ −10 °C hạ đối cao Clo toan tiến hành mất nước, cũng ở −35 °C cùng 1 mmHg hạ chưng cất mà thành. Nó là một loại đối đánh sâu vào mẫn cảm vô sắc du trạng chất lỏng. Nó là Clo oxy hoá vật trung phản ứng tính thấp nhất, cũng là duy nhất một loại sẽ không làm chất hữu cơ ở nhiệt độ phòng rơi xuống hỏa Clo oxy hoá vật. Nó hòa tan được với thủy, hình thành cao Clo toan hoặc hòa tan nước kiềm dung dịch, hình thành cao Clo toan muối. Bất quá, thông qua lộng đoạn trong đó một cái trung tâm Cl–O kiện, bảy oxy hoá nhị Clo sẽ nổ mạnh tính nhiệt phân giải thành ClO3Cùng ClO4Tự do cơ, sau đó nhanh chóng phân giải thành khí Clo cùng dưỡng khí.[52]
Clo hàm oxy toan cùng hàm oxy toan muối
[Biên tập]Clo có bốn loại hàm oxy toan, phân biệt làThứ Clo toan( HOCl ),Á Clo toan( HOClO ),Clo toan( HOClO2),Cao Clo toan( HOClO3)
Đại đa số Clo hàm oxy toan có thể thông qua kỳ hóa phản ứng tới sinh sản. Thứ Clo toan (HOCl) có cao phản ứng tính thả phi thường không ổn định, nó muối —— thứ Clo toan muối chủ yếu dùng cho tẩy trắng cùng sát trùng. Chúng nó đều là rất mạnh oxy hoá tề, sẽ hướng vô cơ phần tử thả ra một cái oxy nguyên tử. Á Clo toan (HOClO) càng không ổn định, không thể ở chẳng phân biệt giải dưới tình huống chia lìa hoặc áp súc, từ nhị oxy hoá Clo thủy dung dịch phân giải trung cũng biết. Bất quá,Á Clo toan NatriLà một loại ổn định muối, nhưng dùng cho tẩy trắng cùng tróc hàng dệt, cũng là một loại oxy hoá tề cùng nhị oxy hoá Clo trước thể. Clo toan (HOClO2) là một loại cường toan, 30% độ dày Clo toan ở nước lạnh ổn định, nhưng đun nóng lúc ấy phân giải thành Clo cùng nhị oxy hoá Clo. Giảm sức ép bốc hơi có thể sử Clo toan tiến thêm một bước áp súc đến ước 40%, nhưng theo sau phân giải vì cao Clo toan, khí Clo, dưỡng khí, thủy cùng nhị oxy hoá Clo. Quan trọng nhất Clo toan muối làClo toan Natri,Đa dụng với chế tạo nhị oxy hoá Clo lấy tẩy trắng bột giấy. Phòng thí nghiệm, từ Clo toan muối phân giải thành Clo hóa vật cùng dưỡng khí phản ứng có thể dùng để được đến chút ít dưỡng khí. Clo hóa vật cùng Clo toan muối có thể về trung sinh ra khí Clo:[54]
- ClO−
3+ 5 Cl−+ 6 H+⟶ 3 Cl2+ 3 H2O
Cao Clo toan muối cùng cao Clo toan (HOClO3) là Clo nhất ổn định hàm oxy hoá hợp vật. Cao Clo toan cùng cao Clo toan muối thủy dung dịch ở đun nóng khi là cường oxy hoá tề, này cùng chúng nó ở nhiệt độ phòng hạ phần lớn không hoạt bát tính chất hình thành tiên minh đối lập, bởi vì này đó phản ứng xuất phát từ động lực học nguyên nhân có cao hoạt hoá có thể. Cao Clo toan muối là thông qua oxy hoá điện giải Clo toan Natri chế thành, mà cao Clo toan có thể từCao Clo toan NatriHoặcCao Clo toan bốiCùng nùng axit clohidric phản ứng, sau đó lự đi lắng đọng lại Clo hóa vật. Vô thủy cao Clo toan là một loại vô sắc nhưng lưu động chất lỏng, đối chấn động mẫn cảm, cùng đại đa số hợp chất hữu cơ tiếp xúc sẽ nổ mạnh, sửIốt hóa hydroCùngÁ lưu tiên CloCháy, thậm chí oxy hoá bạc cùng kim. Tuy rằng cao Clo gốc a-xít là một loại thực nhược xứng thể, so thủy còn yếu, nhưng một ít đựngClO−
4Xứng thể vật chất là đã biết.[54]
Hữu cơ Clo hoá chất
[Biên tập]
Cùng loại cái khác than - kho kiện, C–Cl kiện là một loại thường thấy kiện, hợp thànhHoá học hữu cơTrung tâm một bộ phận. Có nên nhóm chức hoá chất nhưng coi là Clo ly tử hữu cơ hợp chất diễn sinh. Bởi vì Clo (3.16) cùng than (2.55) chi gian điện phụ tính bất đồng, C-Cl kiện trung than là thiếu điện tử, bởi vậy cóThân điện tính.Clo hóaLấy nhiều loại phương thức thay đổi than hydro hoá chất tính chất vật lý: Hữu cơ Clo hoá chất thông thường soThủyTrọng, đây là bởi vì Clo nguyên tử lượng đại dẫn tới. Ngoài ra, mỡ tộcHữu cơ Clo hoá chấtLàHoàn cơ hóaThuốc thử, bởi vì Clo là một loạiRời đi gốc.[55]
Hoàn hydrocarbonCùngPhương hydrocarbonCó thể ởTự do cơHạ ( tử ngoại tuyến chiếu xạ ) bị Clo hóa. Nhưng mà, Clo hóa trình độ khó có thể khống chế: Nên phản ứng không phảiKhu vực lựa chọn tính,Hơn nữa thường xuyên hợp thành có bất đồng Clo hóa trình độ các loại dị cấu thể chất hỗn hợp. Nếu sản vật dễ dàng chia lìa, này có thể là bị cho phép. Clo đại phương hydrocarbon có thể từ cùng khí CloPhó - khắc phản ứngChế bị mà thành, chất xúc tác vìLouis toan.[55]Kho phỏng phản ứngSử dụng Clo cùngSodium hydroxide,Cũng có thể đủ từ nhóm methyl Ketone cùng tương quan hoá chất trung sinh thành kho đại hoàn. Clo có thể thêm thành đến song kiện hoặc tam kiện thượng, hình thành nhị Clo hóa vật cùng bốn Clo hóa vật. Nhưng mà, bởi vì Clo phí dụng cùng phản ứng tính, hữu cơ Clo hoá chất càng thường sử dụng HCl, hoặc là cái khác Clo hóa tề, như làNăm Clo hóa lân(PCl5) cùngClo hóa á phong(SOCl2). Sử dụng Clo hóa á phong ở phòng thí nghiệm trung phi thường phương tiện, bởi vì phản ứng trung sở hữu phó sản vật đều là trạng thái khí, không cần chưng cất ra tới.[55]
Rất nhiều hữu cơ Clo hoá chất đã từ từ vi khuẩn đến nhân loại thiên nhiên nơi phát ra trung tách ra tới.[56][57]Hữu cơ Clo hoá chất cơ hồ tồn tại với mỗi một loại sinh vật phần tử trung, bao gồmKiềm sinh vật,Thiếp hi,Axit amin,Hoàng Ketone loại hoá chất,SteroidCùngA-xít béo.[56][58]Bao gồmNhị ác anhỞ bên trong hữu cơ Clo hoá chất là ở rừng rậm hoả hoạn cực nóng hoàn cảnh trung sinh ra, hơn nữa ở so hợp thành nhị ác anh sớm hơn phát sinh tia chớp thiêu đốt tro tàn trung phát hiện nhị ác anh.[59]Ngoài ra, mọi người đã từ rong biển trung tách ra nhiều loại đơn giản Clo đại hydrocarbon, bao gồm nhị Clo metan, Clo phỏng cùngBốn Clo hóa than.[60]Hoàn cảnh trung đại bộ phậnClo metanLà từ sinh vật phân giải, rừng rậm hoả hoạn cùng núi lửa tự nhiên sinh ra.[61]
Một ít hữu cơ Clo hoá chất đối động thực vật, bao gồm nhân loại đều có độc. Nhị ác anh là chất hữu cơ ở Clo tồn tại hạ thiêu đốt khi sinh ra, mà một ít thuốc sát trùng ( nhưDDT) làKéo dài tính hữu cơ ô nhiễm vật,Đương chúng nó phóng thích đến hoàn cảnh trung lúc ấy tạo thành nguy hiểm. Cử cái ví dụ, ở 20 thế kỷ trung kỳ bị rộng khắp dùng cho khống chế côn trùng DDT cũng ở chuỗi đồ ăn trung tích lũy, cũng dẫn tới nào đó loài chim sinh sôi nẩy nở vấn đề ( tỷ như vỏ trứng biến mỏng ).[62]Bởi vìClo Flo hydrocarbonC-Cl kiện dễ dàng đều nứt, ở cao tầng đại khí trung sẽ sinh ra Clo tự do cơ, phá hư tầng ozone. Bởi vậy, nó đã bị đào thải.[52]
Sử dụng
[Biên tập]Clo có thể làm một loại so tiện nghiThuốc sát trùng,Giống nhauNước máyCậpBể bơiLiền thường chọn dùng nó tớiTiêu độc.Nhưng bởi vì khí Clo thủy dung tính tương đối kém, độc tính trọng đại, sẽ thả ra đặc thù khí vị, thả dễ dàng sinh ra cóGây ung thưNguy hiểmTam kho metanChờHữu cơ Clo hoá chất,Cố Trung Quốc, nước Mỹ chờ quốc thường sửa dùngNhị oxy hoá Clo( ClO2),Clo ánHoặcOzoneChờ thay thế khí Clo làm thủy thuốc sát trùng.
Trừ bỏ dùng với tiêu độc, khí Clo cũng là một loại quan trọng hóa chất nguyên liệu, dùng với chế tạoAxit clohidricCùngBột tẩy trắng,Chế tạoClo đại hydrocarbon.Cũng có thể dùng cho chế tạo nhiều loạiNông dược,Chế tạoClo phỏngChờHữu cơ dung môi.Ngoài ra khí Clo còn rộng khắp dùng cho tạo giấy, dệt, chất tổng hợp hữu cơ, kim loại tinh luyện chờ ngành sản xuất, cũng có làmVũ khí hoá họcKỷ lục:Khí Clo đạnỞ 1915 năm từ nước Đức lục quân lần đầu ở quân sự sử dụng thượng sử dụng, đối lập lợi khi cảnh nội y phổ lôi Anh Pháp liên quân, sử dụng này vũ khí, tạo thành trọng đại thương vong cập chiến quả.
Natri clorua là nhất thường thấy Clo hoá chất, là công nghiệp hoá học sở cần Clo chủ yếu nơi phát ra. Ước chừng có 15000 loại Clo hoá chất nhưng tiến hành thương nghiệp giao dịch, bao gồm Clo đạiMetan,Clo đạiẤt hoàn,Clo Êtilen,Polyvinyl chloride(PVC),Tam Clo hóa nhômChờ nhiều loại hoá chất.Magie,Thái,CáoCùngCápClo hóa vật là lấy được này đó nguyên tố đơn chất trung gian thể.[11]
Ở sinh sản sở hữu Clo đơn chất trung, ước 63% dùng cho chế tạo hợp chất hữu cơ, 18% dùng cho chế tạo vô cơ Clo hoá chất.[63]Thương nghiệp thượng sử dụng ước chừng 15000 loại Clo hoá chất.[64]Dư lại 19% Clo tắc dùng cho thuốc tẩy trắng cùng tiêu độc sản phẩm.[65]Lấy sản lượng kế, quan trọng nhất hữu cơ Clo hoá chất là1,2- nhị Clo Ất hoànCùngClo Êtilen,Chúng nó đều là sinh sảnPVCTrung gian thể. Cái khác quan trọng hữu cơ Clo hoá chất bao gồmClo metan,Nhị Clo metan,Clo phỏng,1,1- nhị Clo Êtilen,Tam Clo Êtilen,Bốn Clo Êtilen,Hi Bính cơ Clo,Hoàn oxy Clo Bính hoàn,Clo benzen,Nhị Clo benzenCùngTam Clo benzen.Chủ yếu vô cơ Clo hoá chất bao gồmHCl,HClO,NaClO3,AlCl3,SiCl4,SnCl4,PCl3,PCl5,POCl3,AsCl3,SbCl3,SbCl5,BiCl3,S2Cl2,SCl2,SOCl2,ClF3,ICl,ICl3,TiCl3,TiCl4,MoCl5,FeCl3CùngZnCl2Từ từ.[65]
Vệ sinh, tiêu độc cùng chống phân huỷ
[Biên tập]Đối kháng hủ bại
[Biên tập]Ở nước Pháp ( cùng địa phương khác giống nhau ),Động vật tràngNhưng bị gia công chế thành nhạc cụ huyền,Goldbeater làn daChờ sản phẩm. Đây là ở “Tràng đạo nhà xưởng” trung hoàn thành, là một cái thực xú cùng không khỏe mạnh quá trình. Ước chừng ở 1820 năm tả hữu,Dân tộc công nghiệp khích lệ hiệp hộiSẽ đối phát hiện một loại hóa học hoặc máy móc phương pháp tới chia lìa động vật tràng đạoMàng bụngMà sẽ không dẫn tớiThi thể hủ bạiNgười cấp ra tưởng thưởng.[66][67]Cái này tưởng thưởng là từAntoine - Germanic · nuôi kéo khắc,Một cái 44 tuổi nước Pháp nhà hóa học cùng dược tề sư được đến. Hắn phát hiện bối thác lai “Nhã phất ngươi thủy”Không chỉ có phá hủy động vật tổ chức phân giải hư thối khí vị, lại còn có trì hoãn phân giải.[67][24]
Nuôi kéo khắc nghiên cứu dẫn tới “Tràng đạo nhà xưởng” sử dụng Clo hóa vật,Thứ Clo toan CanxiCùngThứ Clo toan Natri.Mọi người còn phát hiện này đó hóa học phẩm nhưng dùng choWC,Cống thoát nước,Thị trường,Lò sát sinh,Giải phẫu rạp hátCùng nhà xác thường quyTiêu độcCùng trừ xú.[68]Này đó hoá chất còn ởBệnh viện,Kiểm dịch trạm,Nhà giam,Ti thương,Chuồng ngựa,Chuồng bò chờ phương diện lấy được thành công. Chúng nó cũng ởMai táng,[69]Chống phân huỷ,Bệnh truyền nhiễm bùng nổ, phát sốt cùng ngưuHắc chân bệnhTrung hữu ích.[66]
Vệ sinh công cộng
[Biên tập]
1908 năm, bang New JerseyTrạch chợ phía tâyLần đầu ở nước Mỹ dùng để uống trong nước ứng dụng Clo hóa pháp.[70]Tới rồi 1918 năm,Nước Mỹ tài chính bộKêu gọi đối sở hữu dùng để uống thủy tiến hành Clo tiêu độc. Clo là trước mắt dùng choThủy tinh lọc( tỷ như ở thủy xử lý xưởng ),Thuốc sát trùngCùngThuốc tẩy trắngTrung quan trọng hóa học phẩm. Hiện tại, cho dù là tiểu nguồn nước cũng thường xuyên bị Clo hóa.[71]
Clo thông thường lấyThứ Clo toanHình thức giết chết dùng để uống thủy cung ứng cùng công cộng bể bơi trungVi khuẩnCùng mặt khác vi sinh vật. Ở đại đa số tư nhân bể bơi trung, sẽ không sử dụng Clo bản thân, mà là sử dụngThứ Clo toan Natri,Từ Clo cùngSodium hydroxidePhản ứng mà thành, hoặc là Clo hóa tam tụ xyanogen toan muối thể rắn phiến tề hình thành. Ở bể bơi trung sử dụng Clo khuyết điểm là Clo sẽ cùng nhân loại tóc cùng làn da trung protein phát sinh phản ứng. Cùng phổ biến cái nhìn tương phản, bể bơi độc đáo “Khí Clo vị” không phải nguyên tố Clo bản thân tạo thành, mà làMột Clo án,Một loại từ tự do hòa tan Clo cùng chất hữu cơ chất trung án phản ứng sinh ra hoá chất tạo thành. Làm trong nước thuốc sát trùng, Clo đốiĐại tràng khuẩn queTác dụng làXúGấp ba trở lên,IốtSáu lần trở lên.[72]Càng ngày càng nhiềuMột Clo ánBị trực tiếp tăng thêm đến dùng để uống trong nước lấy tiến hành tiêu độc, này một quá trình được xưng làClo án hóa.[73]
Chứa đựng cùng sử dụng có độc khí Clo tới tiến hành thủy xử lý thông thường là không thực tế, bởi vậy yêu cầu sử dụng tăng thêm Clo thay thế phương pháp. Này đó phương pháp bao gồm sử dụng sẽ ở trong nước thả ra khí CloThứ Clo toan muốiDung dịch,Nhị Clo dị xyanogen niệu toan Natri( nhị thủy hoặc vô thủy ) cùng1,3,5- tam Clo -1,3,5- tam tần -2,4,6- tam Ketone.Này đó hoá chất ở trạng thái cố định khi là ổn định, có thể lấy bột phấn, hạt hoặc phiến tề hình thức sử dụng. Đương chút ít này đó hoá chất bị tăng thêm đến nước ao hoặc công nghiệp dùng thủy hệ thống trung khi, Clo nguyên tử sẽ từ phần tử còn lại bộ phận thuỷ phân, hình thành thứ Clo toan (HClO), nhưng làm giống nhauSát sinh vật tề,Giết chết vi khuẩn, vi sinh vật, tảo loại chờ.[74][75]
Dùng làm vũ khí
[Biên tập]Thế chiến thứ nhất
[Biên tập]Thế chiến thứ nhấtLần thứ hai y Pearl chiến dịchTrong lúc, khí Clo với 1915 năm ngày 22 tháng 4 lần đầu bị Ðức đế quốc lục quân dùng làmVũ khí[76][77]Chính như bọn lính sở miêu tả, nó có một loại hồ tiêu cùng trái thơm hỗn hợp độc đáo khí vị, cũng nếm tới rồi kim loại vị, đau đớn yết hầu cùng bộ ngực phần sau. Clo sẽ cùng phổiNiêm mạcTrung thủy phản ứng, hình thànhAxit clohidric,Đối sống tổ chức có phá hư tính cũng khả năng trí mạng.Mặt nạ phòng độcCùngThan hoạt tínhHoặc mặt khác lọc khí có thể người bảo hộ thể hệ hô hấp khỏi bị khí Clo xâm hại, cảnh này khiến khí Clo trí mạng tính xa thấp hơn mặt khác vũ khí hoá học. Nó là từ nước Đức nhà khoa họcFritz · ha báCùngPháp bổn công tyHợp tác khai phá, người sau khai phá bài phóng khí Clo phương pháp tới đối phóChiến hàoĐịch nhân.[78]Lần đầu sử dụng sau, hai bên đều sử dụng Clo làm vũ khí hoá học, nhưng thực mau đã bị càng trí mạngPhốt-genCùngHơi độcSở thay thế được.[79]
Iraq
[Biên tập]2007 năm, khí Clo cũng bị dùng choAn Baal tỉnh Iraq chiến tranh,Phản loạn phần tử dùngPháo cốiCùng khí Clo vại đóng góiÔ tô bom.Lần này tập kích tạo thành hai người tử vong, vượt qua 350 người bị bệnh. Trong đó, đại đa số tử vong là từ nổ mạnh uy lực tạo thành, mà không phải Clo ảnh hưởng, bởi vì có độc khí thể thực dễ dàng theo nổ mạnh ở đại khí trung phân tán cùng pha loãng. Ở một ít nổ mạnh sự kiện trung, một trăm nhiều danh bình dân nhân hô hấp khó khăn mà nằm viện. Iraq đương cục tăng mạnh Clo nguyên tố bảo vệ, này đối với hướng dân chúng cung cấp an toàn dùng để uống thủy quan trọng nhất.[80][81]
Theo đưa tin, 2014 năm ngày 23 tháng 10,Islam quốcTừng ởIraqDuluiyah trấn sử dụng quá khí Clo.[82]Đối quần áo cùng thổ nhưỡng hàng mẫu phòng thí nghiệm phân tích chứng thực, 2015 năm ngày 23 tháng 1, có người ở ma tô ngươi phụ cận 47 hào quốc lộ Kiske giao lộ, đối Kohl đứcBội cái mai cáchBộ đội sử dụng khí Clo.[83]
Syria
[Biên tập]Syria chính phủ đem Clo dùng làmVũ khí hoá học[84],TừThùng trang bomCùng hỏa tiễn phóng ra.[85][86]2016 năm,Cấm hóa võ tổ chức - Liên Hiệp Quốc liên hợp điều tra cơ chếĐến ra kết luận là Syria chính phủ ở tam khởi đơn độc tập kích trung sử dụng Clo làm vũ khí hoá học.[87]Cấm hóa võ tổ chức điều tra cùng giám định tiểu tổ sau lại điều tra đến ra kết luận,Syria Ả Rập không quânỨng đối 2017 năm cùng 2018 năm khí Clo tập kích phụ trách.[88]
Đối nhân thể ảnh hưởng
[Biên tập]Clo là nhân thể sở thiết yếuĐại lượng không đổi nguyên tốChi nhất. Này tác dụng có điều tiết tế bào ngoại dịch dung lượng cùng áp lực thẩm thấu, duy trì toan kiềm cân bằng, tham dự máu CO2 vận chuyển chờ.[89]Clo ly tử vì thay thế tác dụng rất quan trọng vật chất, dạ dày trung axit clohidric sinh thành cùng tế bào bơm công năng toàn yêu cầu Clo.[90]Ẩm thực trung chủ yếu nơi phát ra là trên bàn cơm muối hoặc natri clorua, trong máu quá thấp hoặc cao độ dày Clo vì chất điện phân mất cân đối ví dụ thực tế, ở không có mặt khác dị thường dưới tình huống rất ít phát sinh thấp Clo huyết chứng, nó có khi cùng để thở không đủ có quan hệ.[91]Nó khả năng cùng trường kỳ hô hấp toan trúng độc có quan hệ.[92]Cao Clo huyết chứng ( quá nhiều Clo ) thông thường không có bệnh trạng, đương có bệnh trạng cũng cùng cao huyết Natri chứng rất giống ( quá nhiều Natri ), huyết trung Clo hàm lượng giảm bớt sẽ dẫn tới não thiếu thủy, bệnh trạng thông thường nguyên nhân gây ra với nhanh chóng phục thủy sau não bệnh phù, cao Clo huyết chứng sẽ ảnh hưởng dưỡng khí vận chuyển.[93]
| Đơn vị: Mg mỗi ngày | Trung Quốc[89] | Nước Mỹ[94] |
|---|---|---|
| Thích hợp hút vào lượng
( adequate intake; AI ) |
2300 | 2300 |
| Nhưng nại chịu tối cao hút vào lượng
( tolerable upper intake level; UL ) |
Bất tường | 3600 |
Tính nguy hiểm
[Biên tập]| Clo | |
|---|---|

| |
| Tính nguy hiểm | |
GHS tính nguy hiểm ký hiệu  
| |
| GHS nhắc nhở từ | Danger |
| H- thuật ngữ | H270,H315,H319,H331,H335,H400 |
| P- thuật ngữ | P220,P244,P261,P304,P340,P312,P403,P233,P410,P403[95] |
| NFPA 704 | |
| Nếu không phải ghi chú rõ, sở hữu số liệu đều xuất từTiêu chuẩn trạng thái ( 25 ℃, 100 kPa )Hạ. | |
Clo là một loại có độc khí thể, sẽ công kích hệ hô hấp, đôi mắt cùng làn da.[96]Nó so không khí mật độ đại, cho nên nó thường thường sẽ tích tụ ở thông gió bất lương không gian cái đáy. Clo là một loại cường oxy hoá tề, khả năng cùng dễ châm tài liệu phát sinh phản ứng.[97][98]
Thông qua dụng cụ đo lường có thể kiểm tra đo lường đến 0.2 ppm khí Clo, ở 3 ppm khi có thể ngửi được. Ở 30 ppm khí Clo hạ sẽ tạo thành ho khan cùng nôn mửa, ở 60 ppm hạ sẽ tổn hại phổi bộ. 1000 ppm ( 0.1% ) khí Clo ở vài lần hô hấp trung liền có thể tạo thành sinh mệnh nguy hiểm.[11]Khí CloLập tức đối sinh mệnh cùng khỏe mạnh tạo thành nguy hiểm giá trịVì 10 ppm.[99]Hô hấp thấp độ dày khí Clo sẽ tăng thêm hệ hô hấp gánh nặng, bại lộ ở khí Clo trung sẽ kích thích đôi mắt.[100]Clo nguy hại đến từ chính này cường oxy hoá tính. Đương khí Clo độ dày ở 30 ppm trở lên khi, nó sẽ cùng thủy hoặc thể dịch phản ứng, hình thànhAxit clohidric(HCl) cùngThứ Clo toan(HClO).
Đương dùng cho thủy tiêu độc khi, Clo cùng thủy phản ứng không phải nhân loại khỏe mạnh chủ yếu vấn đề. Trong nước tồn tại mặt khác vật chất khả năng sẽ sinh raTiêu độc phó sản vật,Này đó phó sản vật sẽ đối nhân loại khỏe mạnh sinh ra mặt trái ảnh hưởng.[101][102]
Ở nước Mỹ,Chức nghiệp an toàn cùng khỏe mạnh quản lý cục(OSHA) đem khí CloCho phép tiếp xúc hạn giá trịĐịnh ở 1 ppm, hoặc là 3 mg/m3.Nước Mỹ quốc gia chức nghiệp an toàn vệ sinh viện nghiên cứuTắc đemĐề cử tiếp xúc hạn giá trịĐịnh ở 0.5 ppm ( bại lộ vượt qua 15 phút ).[99]
Ở trong nhà, đương thứ Clo toan muối tẩy trắng dung dịch cùng nào đó toan tính bài thủy quản thanh khiết tề tiếp xúc sinh ra khí Clo khi, liền sẽ phát sinh sự cố.[103]Thứ Clo toan muối thuốc tẩy trắng ( một loạiGiặt quần áoChất phụ gia ) cùngAmonia( một loại khác giặt quần áo chất phụ gia ) phản ứng sẽ sinh raClo án loại,Một khác loại có đầu độc học phẩm.[104]
Clo dẫn tới tài liệu rạn nứt
[Biên tập]Clo rộng khắp dùng cho tinh lọc thủy, đặc biệt là dùng để uống thủy cùng bể bơi dùng thủy. Bởi vì Clo khiến choInoxCần trụcỨng lực ăn mòn rạn nứt,Bể bơi trần nhà đã xảy ra vài lần tai nạn tính sập.[105]Một ítTụ hợp vậtCũng đối công kích mẫn cảm, bao gồmTụ formaldehydeCùngTụ đinh hi.Này hai loại tài liệu đều dùng cho lãnh nước ấm gia dụng ống dẫn, màỨng lực ăn mòn rạn nứtỞ 1980 niên đại cùng 1990 niên đại ở nước Mỹ khiến cho rộng khắp trục trặc.[106]
Clo - thiết hỏa
[Biên tập]ThiếtSẽ cùng Clo ở cực nóng hạ phản ứng. Đây là một cái cường phóng nhiệt phản ứng, sẽ sinh ra Clo - thiết hỏa.[107][108]Clo - thiết hỏa ở nhà máy hóa chất trung là một loại nguy hiểm, trong đó đại bộ phận chuyển vận khí Clo ống dẫn là từ cương chế thành.[107][108]
Tham kiến
[Biên tập]Chú thích
[Biên tập]- ^van Helmont, Joannis Baptistae.Opera omnia [All Works].Frankfurt-am-Main, (Germany): Johann Just Erythropel. 1682[2021-06-13].( nguyên thủy nội dungLưu trữVới 2021-12-18 )( tiếng Latinh ).From"Complexionum atque mistionum elementalium figmentum."(Formation of combinations and of mixtures of elements), §37,p. 105:(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)"Accipe salis petrae, vitrioli, & alumnis partes aequas: exsiccato singula, & connexis simul, distilla aquam. Quae nil aliud est, quam merum sal volatile. Hujus accipe uncias quatuor, salis armeniaci unciam junge, in forti vitro, alembico, per caementum (ex cera, colophonia, & vitri pulverre) calidissime affusum, firmato; mox, etiam in frigore, Gas excitatur, & vas, utut forte, dissilit cum fragore."(Take equal parts of saltpeter [i.e., sodium nitrate], vitriol [i.e., concentrated sulfuric acid], and alum: dry each and combine simultaneously; distill off the water [i.e., liquid]. That [distillate] is nothing else than pure volatile salt [i.e., spirit of nitre, nitric acid]. Take four ounces of this [viz, nitric acid], add one ounce of Armenian salt [i.e., ammonium chloride], [place it] in a strong glass alembic sealed by cement ([made] from wax, rosin, and powdered glass) [that has been] poured very hot; soon, even in the cold, gas is stimulated, and the vessel, however strong, bursts into fragments.) From"De Flatibus"(On gases),p. 408(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán):"Sal armeniacus enim, & aqua chrysulca, quae singula per se distillari, possunt, & pati calorem: sin autem jungantur, & intepescant, non possunt non, quin statim in Gas sylvestre, sive incoercibilem flatum transmutentur."(Truly Armenian salt [i.e., ammonium chloride] and nitric acid, each of which can be distilled by itself, and submitted to heat; but if, on the other hand, they be combined and become warm, they cannot but be changed immediately into carbon dioxide [note: van Helmont’s identification of the gas is mistaken] or an incondensable gas.)
See also:- Helmont, Johannes (Joan) Baptista Van, Encyclopedia.Com(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán): "Others were chlorine gas from the reaction of nitric acid and sal ammoniac;…"
- Wisniak, Jaime (2009) "Carl Wilhelm Scheele,"Revista CENIC Ciencias Químicas,40(3): 165–173; see p. 168: "Early in the seventeenth century Johannes Baptiste van Helmont (1579-1644) mentioned that when sal marin (sodium chloride) or sal ammoniacus and aqua chrysulca (nitric acid) were mixed together, a flatus incoercible (non-condensable gas) was evolved."
Tham khảo văn hiến
[Biên tập]- ^Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J.Standard atomic weights of the elements 2021 (IUPAC Technical Report).Pure and Applied Chemistry. 2022-05-04.ISSN 1365-3075.doi:10.1515/pac-2019-0603( tiếng Anh ).
- ^Chlorine(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), Gas Encyclopaedia, Air Liquide
- ^Magnetic susceptibility of the elements and inorganic compounds(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), inLide, D. R. ( biên ), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005,ISBN0-8493-0486-5
- ^The earliest salt production in the world: an early Neolithic exploitation in Poiana Slatinei-Lunca, Romania.[2008-07-10].(Nguyên thủy nội dungLưu trữ với April 30, 2011 ).
- ^Kraus, Paul.Jâbir ibn Hayyân: Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque. Cairo:Institut Français d'Archéologie Orientale.1942–1943.ISBN9783487091150.OCLC 468740510.vol. II, pp. 41–42;Multhauf, Robert P.The Origins of Chemistry.London: Oldbourne. 1966.pp. 141-142.
- ^Multhauf 1966,p. 142, note 79.
- ^Karpenko, Vladimír; Norris, John A.Vitriol in the History of Chemistry.Chemické listy. 2002,96(12): 997–1005[2021-06-13].( nguyên thủy nội dungLưu trữVới 2021-12-18 ).p. 1002.
- ^8.08.18.2Greenwood and Earnshaw, p. 789–92
- ^Scheele, Carl Wilhelm.Om Brunsten, eller Magnesia, och dess Egenskaper [On braunstein [i.e., pyrolusite, manganese dioxide], or magnesia, and its properties].Kongliga Vetenskaps Academiens Handlingar [Proceedings of the Royal Scientific Academy]. 1774,35:89–116, 177–194[2021-06-13].( nguyên thủy nội dungLưu trữVới 2020-04-23 )( Thuỵ Điển ngữ ).In section 6 on pp. 93–94 of his paper(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán), Scheele described how chlorine was produced when a mixture of hydrochloric acid and manganese dioxide (Brunsten) was heated:"6) (a) På 1/2 uns fint rifven Brunsten slogs 1 uns ren Spiritus salis.… samt lukten fo̊rsvunnen."( 6) (a) On one half ounce of finely ground Braunstein [pyrolusite] was poured one ounce of purespiritus salis[spirit of salt, hydrogen chloride]. After this mixture had been standing in the cold for one hour, the acid had assumed a dark brown colour. One part of this solution was poured into a glass, which was placed over the fire. The solution gave off an odour like warmaqua regiaand after one quarter’s hour duration, it was as clear and colourless as water, and the smell had disappeared.) For an English translation of the relevant passages of this article, see:The Early History of Chlorine: Papers by Carl Wilhelm Scheele (1774), C. L. Berthollet (1785), Guyton de Morveau (1787), J. L. Gay-Lussac and L. J. Thenard (1809)(Edinburgh, Scotland: Alembic Club, 1912),pp. 5–10.(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- ^10.010.110.210.310.417 Chlorine.Elements.vanderkrogt.net.[2008-09-12].(Nguyên thủy nội dungLưu trữ với 2010-01-23 ).
- ^11.011.111.211.3Greenwood and Earnshaw, pp. 792–93
- ^Ihde, Aaron John.The development of modern chemistry.Courier Dover Publications. 1984: 158[2021-06-13].ISBN978-0-486-64235-2.( nguyên thủy nội dungLưu trữVới 2020-05-30 ).
- ^Weeks, Mary Elvira.The discovery of the elements. XVII. The halogen family. Journal of Chemical Education. 1932,9(11): 1915.Bibcode:1932JChEd...9.1915W.doi:10.1021/ed009p1915.
- ^Gay-Lussac; Thenard.Extrait des mémoires lus à l'Institut national, depuis le 7 mars 1808 jusqu'au 27 février 1809. [Extracts from memoirs read at the national Institute, from 7 March 1808 to 27 February 1809].Mémoires de Physique et de Chimie de la Société d'Arcueil. 1809,2:295–358[2021-06-13].( nguyên thủy nội dungLưu trữVới 2014-02-12 ).See: § De la nature et des propriétés de l'acide muriatique et de l'acide muriatique oxigéné(On the nature and properties of muriatic acid and of oxidized muriatic acid), pp. 339–358. From pp. 357–358:"Le gaz muriatique oxigéné n'est pas, en effect, décomposé… comme un corps composé."( "In fact, oxygenated muriatic acid is not decomposed by charcoal, and it might be supposed, from this fact and those that are communicated in this Memoir, that this gas is a simple body. The phenomena that it presents can be explained well enough on this hypothesis; we shall not seek to defend it, however, as it appears to us that they are still better explained by regarding oxygenated muriatic acid as a compound body." ) For a full English translation of this section, see:Joseph Louis Gay-Lussac and Louis Jacques Thénard, "On the nature and the properties of muriatic acid and of oxygenated muriatic acid" (Lemoyne College, Syracuse, New York, USA)(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- ^Davy, Humphry.The Bakerian Lecture. On some of the combinations of oxymuriatic gas and oxygene, and on the chemical relations of these principles, to inflammable bodies.Philosophical Transactions of the Royal Society of London. 1811,101:1–35[2021-06-13].Bibcode:1811RSPT..101....1D.doi:10.1098/rstl.1811.0001
 .( nguyên thủy nội dungLưu trữVới 2020-04-23 ).Davy named chlorine onp. 32:(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) "After consulting some of the most eminent chemical philosophers in this country, it has been judged most proper to suggest a name founded upon one of its obvious and characteristic properties — its colour, and to call itChlorine,orChloricgas.* *From χλωρος. "
.( nguyên thủy nội dungLưu trữVới 2020-04-23 ).Davy named chlorine onp. 32:(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) "After consulting some of the most eminent chemical philosophers in this country, it has been judged most proper to suggest a name founded upon one of its obvious and characteristic properties — its colour, and to call itChlorine,orChloricgas.* *From χλωρος. "
- ^Faraday, M.On fluid chlorine.Philosophical Transactions of the Royal Society of London. 1823,113:160–164[2021-06-13].Bibcode:1823RSPT..113..160F.doi:10.1098/rstl.1823.0016
 .( nguyên thủy nội dungLưu trữVới 2020-04-23 ).
.( nguyên thủy nội dungLưu trữVới 2020-04-23 ).
- ^Chodos, Alan ( biên ).This Month in Physics History September 4, 1821 and August 29, 1831: Faraday and Electromagnetism.American Physical Society.[2010-05-08].(Nguyên thủy nội dungLưu trữ với June 15, 2010 ).
- ^O'Connor J. J.; Robertson E. F.Michael Faraday.School of Mathematics and Statistics, University of St Andrews, Scotland.[2010-05-08].(Nguyên thủy nội dungLưu trữ với 2010-02-20 ).
- ^19.019.1Bleaching.Encyclopædia Britannica 9th Edition (1875) and 10th Edition (1902).[2012-05-02].(Nguyên thủy nội dungLưu trữ với 2012-05-24 ).
- ^Aspin, Chris.The Cotton Industry.Shire Publications Ltd. 1981:24.ISBN978-0-85263-545-2.
- ^Paul May.Bleach (Sodium Hypochlorite).University of Bristol.[13 December2016].( nguyên thủy nội dungLưu trữVới 13 December 2016 ).
- ^22.022.122.2Greenwood and Earnshaw, p. 798
- ^Almqvist, Ebbe.History of Industrial Gases.Springer Science & Business Media. 2003: 220[2021-06-14].ISBN978-0-306-47277-0.( nguyên thủy nội dungLưu trữVới 2021-12-18 ).
- ^24.024.1Bouvet, Maurice. Les grands pharmaciens: Labarraque (1777–1850) [The great pharmacists: Labarraque (1777–1850)]. Revue d'Histoire de la Pharmacie. 1950,38(128): 97–107.doi:10.3406/pharm.1950.8662( tiếng Pháp ).
- ^Chlorine – History(PDF).[2008-07-10].(Nguyên thủy nội dung(PDF)Lưu trữ với 21 February 2007 ).
- ^Weaponry: Use of Chlorine Gas Cylinders in World War I.historynet. 2006-06-12[2008-07-10].( nguyên thủy nội dungLưu trữVới 2008-07-02 ).
- ^Staff.On the Western Front, Ypres 1915.Veteran Affairs Canada. 29 July 2004[2008-04-08].(Nguyên thủy nội dungLưu trữ với 6 December 2008 ).
- ^Lefebure, Victor; Wilson, Henry. The Riddle of the Rhine: Chemical Strategy in Peace and War. Kessinger Publishing. 2004.ISBN978-1-4179-3546-8.
- ^Lưu hoài nhạc.Hóa học giám nguyên cùng lược khảo.Hóa học giáo dục. 1994, (04)[2013-02-25].(Nguyên thủy nội dungLưu trữ với 2013-10-04 ).
- ^Greenwood and Earnshaw, p. 795
- ^Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils, biên, Inorganic Chemistry, từ Eagleson, Mary; Brewer, William phiên dịch, San Diego/Berlin: Academic Press/De Gruyter: 408, 2001,ISBN0-12-352651-5
- ^The diaphragm cell process.Euro Chlor.[2007-08-15].(Nguyên thủy nội dungLưu trữ với 2011-11-11 ).
- ^The membrane cell process.Euro Chlor.[2007-08-15].(Nguyên thủy nội dungLưu trữ với 2011-11-11 ).
- ^Schmittinger, Peter; Florkiewicz, Thomas; Curlin, L. Calvert; Lüke, Benno; Scannell, Robert; Navin, Thomas; Zelfel, Erich; Bartsch, Rüdiger, Chlorine, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2006-01-15,ISBN3-527-30673-0,doi:10.1002/14356007.a06_399.pub2
- ^35.035.135.235.335.435.535.635.7Greenwood and Earnshaw, pp. 800–4
- ^36.036.136.2Greenwood and Earnshaw, pp. 804–09
- ^Cameron, A. G. W.Abundance of the Elements in the Solar System(PDF).Space Science Reviews. 1973,15(1): 121–46.Bibcode:1973SSRv...15..121C.S2CID 120201972.doi:10.1007/BF00172440.(Nguyên thủy nội dung(PDF)Lưu trữ với 2011-10-21 ).
- ^Audi, Georges; Bersillon, Olivier; Blachot, Jean;Wapstra, Aaldert Hendrik.The NUBASEevaluation of nuclear and decay properties.Nuclear Physics A. 2003,729:3–128.Bibcode:2003NuPhA.729....3A.ISSN 0375-9474.doi:10.1016/j.nuclphysa.2003.11.001.
- ^M. Zreda; et al. Cosmogenic chlorine-36 production rates in terrestrial rocks. Earth and Planetary Science Letters. 1991,105(1–3): 94–109.Bibcode:1991E&PSL.105...94Z.doi:10.1016/0012-821X(91)90123-Y.
- ^M. Sheppard and M. Herod. Variation in background concentrations and specific activities of 36Cl, 129I and U/Th-series radionuclides in surface waters. Journal of Environmental Radioactivity. 2012,106:27–34.PMID 22304997.doi:10.1016/j.jenvrad.2011.10.015.
- ^Greenwood and Earnshaw, pp. 853–56
- ^42.042.142.2Greenwood and Earnshaw, pp. 809–12
- ^Greenwood and Earnshaw, pp. 812–16
- ^Greenwood and Earnshaw, pp. 818–19
- ^45.045.145.2Greenwood and Earnshaw, pp. 821–44
- ^Greenwood and Earnshaw, pp. 842–44
- ^47.047.147.2Greenwood and Earnshaw, pp. 824–8
- ^Greenwood and Earnshaw, pp. 835–42
- ^Greenwood and Earnshaw, pp. 828–31
- ^Greenwood and Earnshaw, pp. 832–35
- ^Greenwood and Earnshaw, pp. 875–80
- ^52.052.152.252.352.452.552.652.7Greenwood and Earnshaw, pp. 844–50
- ^Greenwood and Earnshaw, pp. 883–5
- ^54.054.1Greenwood and Earnshaw, pp. 856–70
- ^55.055.155.2M. Rossberg et al. "Chlorinated Hydrocarbons" inUllmann's Encyclopedia of Industrial Chemistry2006, Wiley-VCH, Weinheim.doi:10.1002/14356007.a06_233.pub2
- ^56.056.1Gordon W. Gribble. Naturally Occurring Organohalogen Compounds.Acc. Chem. Res.1998,31(3): 141–52.doi:10.1021/ar9701777.
- ^Gordon W. Gribble.The diversity of naturally occurring organobromine compounds.Chemical Society Reviews.1999,28(5): 335–46.doi:10.1039/a900201d.
- ^Kjeld C. Engvild. Chlorine-Containing Natural Compounds in Higher Plants.Phytochemistry.1986,25(4): 7891–791.doi:10.1016/0031-9422(86)80002-4.
- ^Gribble, G. W. The Natural production of chlorinated compounds. Environmental Science and Technology. 1994,28(7): 310A–319A.Bibcode:1994EnST...28..310G.PMID 22662801.doi:10.1021/es00056a712.
- ^Gribble, G. W. Naturally occurring organohalogen compounds - A comprehensive survey. Progress in the Chemistry of Organic Natural Products. 1996,68(10): 1–423.PMID 8795309.doi:10.1021/np50088a001.
- ^Public Health Statement – ChloromethaneInternet hồ sơ quánLưu trữ,Lưu trữ ngày 2007-09-27.,Centers for Disease Control,Agency for Toxic Substances and Disease Registry
- ^Connell, D.; et al.Introduction to Ecotoxicology.Blackwell Science. 1999:68.ISBN978-0-632-03852-7.
- ^Greenwood 1997,Trang 798.
- ^Greenwood 1997,Trang 793.
- ^65.065.1Greenwood and Earnshaw, pp. 796–800
- ^66.066.1Hoefer, Jean Chrétien Ferdinand ( biên ). Labarraque, Antoine-Germain. Nouvelle biographie universelle28.:323–24.OL 24229911M.
- ^67.067.1Knight, Charles. Arts and sciences1.Bradbury, Evans & Co. 1867: 427.
- ^Gédéon, Andras.Science and technology in medicine.Springer. 2006: 181–82.ISBN978-0-387-27874-2.( nguyên thủy nội dungLưu trữVới 2015-12-31 ).
- ^Labarraque, Antoine Germain.On the disinfecting properties of Labarraque's preparations of chlorine.Translated by James Scott. 1828: 8. ( nguyên thủy nội dungLưu trữVới 2015-12-31 ).
- ^Joseph Cotruvo, Victor Kimm, Arden Calvert.“Drinking Water: A Half Century of Progress.”(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) EPA Alumni Association. March 1, 2016.
- ^Hammond, C. R.The Elements, in Handbook of Chemistry and Physics81st. CRC press. 2000.ISBN978-0-8493-0481-1.
- ^Koski T. A.; Stuart L. S.; Ortenzio L. F.Comparison of chlorine, bromine, iodine as disinfectants for swimming pool water.Applied Microbiology. 1966,14(2): 276–79.PMC 546668
 .PMID 4959984.doi:10.1128/AEM.14.2.276-279.1966.
.PMID 4959984.doi:10.1128/AEM.14.2.276-279.1966.
- ^ Disinfection with chloramine.Centers for Disease Control and Prevention (CDC). Atlanta, Georgia, USA.[2019-01-20].( nguyên thủy nội dungLưu trữVới 2019-01-20 ).
- ^Greenwood 1997,Trang 860.
- ^Wiberg 2001,Trang 411.
- ^"Battle of Ypres"The Canadian Encyclopedia
- ^Everts, Sarah.When Chemicals Became Weapons of War.Chemical & Engineering News. February 23, 2015,93(8). ( nguyên thủy nội dungLưu trữVới March 30, 2016 ).
- ^Smil, Vaclav.Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production.2004-04-01: 226.ISBN978-0-262-69313-4.( nguyên thủy nội dungLưu trữVới 2015-12-31 ).
- ^Weapons of War: Poison Gas.First World War.[2007-08-12].( nguyên thủy nội dungLưu trữVới 2007-08-21 ).
- ^Mahdi, Basim.Iraq gas attack makes hundreds ill.CNN. 2007-03-17[2007-03-17].( nguyên thủy nội dungLưu trữVới 2007-03-17 ).
- ^'Chlorine bomb' hits Iraq village.BBC News. 2007-05-17[2007-05-17].(Nguyên thủy nội dungLưu trữ với 2007-05-26 ).
- ^Morris, Loveday.Islamic State militants allegedly used chlorine gas against Iraqi security forces.The Washington Post.2014-10-23[2021-06-08].( nguyên thủy nội dungLưu trữVới 2021-12-19 ).
- ^Lab report on chlorine gas usage(PDF).Kurdistan Region Security Council. March 14, 2015[2021-06-15].( nguyên thủy nội dungLưu trữ(PDF)Với 2023-12-30 ).
- ^Gladstone, Rick.Syria Used Chlorine Bombs Systematically in Aleppo, Report Says.The New York Times. 2017-02-13[2017-05-10].( nguyên thủy nội dungLưu trữVới 2017-05-15 ).
- ^Syrian forces 'drop chlorine' on Aleppo.BBC News. 2016-09-07[2017-05-10].( nguyên thủy nội dungLưu trữVới 2017-05-13 ).
- ^Ignoring UN, Russia and Assad continue Syrian chemical weapons and bombing attacks labeled war crimes.2017-03-06[2017-05-11].( nguyên thủy nội dungLưu trữVới 2017-04-25 ).
- ^"Timeline of investigations into Syria's chemical weapons"(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán). Reuters. April 9, 2018.
- ^"Syrian air force behind 2018 chlorine attack on Saraqeb, OPCW finds"(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) BBC News. April 12, 2021.
- ^89.089.1Trung Hoa nhân dân nước cộng hoà quốc gia vệ sinh khỏe mạnh ủy ban.Trung Quốc cư dân đồ ăn chất dinh dưỡng tham khảo hút vào lượng đệ 2 bộ phận: Đại lượng không đổi nguyên tố(PDF).[2021-12-01].( nguyên thủy nội dungLưu trữ(PDF)Với 2020-10-25 ).
- ^Blood (Serum) Chloride Level Test.[30 April2010].(Nguyên thủy nội dungLưu trữ với 31 March 2009 ).
- ^Lavie, CJ; Crocker, EF; Key, KJ; Ferguson, TG.Marked hypochloremic metabolic alkalosis with severe compensatory hypoventilation.South. Med. J. October 1986,79(10): 1296–99.PMID 3764530.doi:10.1097/00007611-198610000-00025.
- ^Levitin, H; Branscome, W; Epstein, FH.The pathogenesis of hypochloremia in respiratory acidosis.J. Clin. Invest. December 1958,37(12): 1667–75.PMC 1062852
 .PMID 13611033.doi:10.1172/JCI103758.
.PMID 13611033.doi:10.1172/JCI103758.
- ^Cambier, C; Detry, B; Beerens, D; et al.Effects of hyperchloremia on blood oxygen binding in healthy calves.J. Appl. Physiol. October 1998,85(4): 1267–72.PMID 9760315.doi:10.1152/jappl.1998.85.4.1267.
- ^Food and Nutrition Board, Institute of Medicine, National Academies of Sciences.Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes(PDF).[2021-12-01].( nguyên thủy nội dungLưu trữ(PDF)Với 2021-12-18 ).
- ^Chlorine 295132.[2021-06-13].( nguyên thủy nội dungLưu trữVới 2020-05-10 ).
- ^Facts About Chlorine.bt.cdc.gov.[2016-04-12].(Nguyên thủy nội dungLưu trữ với 2016-04-23 ).
- ^Chlorine MSDS(PDF).1997-10-23. (Nguyên thủy nội dung(PDF)Lưu trữ với 2007-09-26 ).
- ^NOAA Office of Response and Restoration, US GOV.Chlorine.noaa.gov.[25 August2015].( nguyên thủy nội dungLưu trữVới 15 October 2015 ).
- ^99.099.1NIOSH Pocket Guide to Chemical Hazards.#0115.NIOSH.
- ^Winder, Chris. The Toxicology of Chlorine. Environmental Research. 2001,85(2): 105–14.Bibcode:2001ER.....85..105W.PMID 11161660.doi:10.1006/enrs.2000.4110.
- ^What's in your Water?: Disinfectants Create Toxic By-products.ACES News. College of Agricultural, Consumer and Environmental Sciences – University of Illinois at Urbana-Champaign. 2009-03-31[2009-03-31].( nguyên thủy nội dungLưu trữVới 2014-09-03 ).
- ^Richardson, Susan D.; Plewa, Michael J.; Wagner, Elizabeth D.; Schoeny, Rita; DeMarini, David M. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research. Mutation Research/Reviews in Mutation Research. 2007,636(1–3): 178–242.PMID 17980649.doi:10.1016/j.mrrev.2007.09.001.
- ^Berezow, Alex.Why You Should Never Mix Different Drain Cleaners.Forbes.[2016-04-12].( nguyên thủy nội dungLưu trữVới 2016-04-25 ).
- ^Bleach Mi xing Dangers: Washington State Dept. of Health.doh.wa.gov.[2016-04-12].( nguyên thủy nội dungLưu trữVới 2016-04-14 ).
- ^Bertolini, Luca; Elsener, Bernhard; Pedeferri, Pietro; Polder, Rob B.Corrosion of steel in concrete: prevention, diagnosis, repair.Wiley-VCH. 2004: 148[2021-06-13].ISBN978-3-527-30800-2.( nguyên thủy nội dungLưu trữVới 2020-06-14 ).
- ^Lewis, P.R.Polymer Product Failure.iSmithers Rapra Publishing. 1 January 2000: 19–[2011-04-30].ISBN978-1-85957-192-7.( nguyên thủy nội dungLưu trữVới 10 May 2013 ).
- ^107.0107.1Chlorine: Product Datasheet(PDF).Bayer MaterialScience AG. 2008-04-21[2013-12-17].(Nguyên thủy nội dung(PDF)Lưu trữ với September 15, 2012 ).
- ^108.0108.1Sanders, Roy E. Chemical Process Safety: Learning from Case Histories, 3rd Revised edition. Oxford: Elsevier Science & Technology. 2004: 92.ISBN978-0-7506-7749-3.
- Greenwood, Norman N; Earnshaw, Alan. Chemistry of the Elements 2. Oxford: Butterworth-Heinemann. 1997.ISBN0-08-037941-9.
- Wiberg, Egon; Wiberg, Nils; Holleman; Arnold Frederick. Inorganic Chemistry. Academic Press. 2001.ISBN0-12-352651-5.
Phần ngoài liên kết
[Biên tập]- Nguyên tố Clo ởLạc tư a kéo mạc tư quốc gia phòng thí nghiệmGiới thiệu( tiếng Anh )
- EnvironmentalChemistry—— Clo( tiếng Anh )
- Nguyên tốCloỞThe Periodic Table of Videos( Nottingham đại học ) giới thiệu( tiếng Anh )
- Nguyên tố Clo ởPeter van der Krogt elements siteGiới thiệu( tiếng Anh )
- WebElements – Clo( tiếng Anh )
- Agency for Toxic Substances and Disease Registry:Chlorine
- Electrolytic production
- Production and liquefaction of chlorine
- Chlorine Production Using Mercury, Environmental Considerations and Alternatives
- National Pollutant Inventory – Chlorine
- National Institute for Occupational Safety and Health – Chlorine Page(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán)
- Chlorine Institute(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) – Trade association representing the chlorine industry
- Chlorine Online(Giao diện lưu trữ sao lưu,Tồn vớiInternet hồ sơ quán) – the web portal of Eurochlor – the business association of the European chlor-alkali industry







