我国首款猴痘疫苗获批临床


独家抢先看
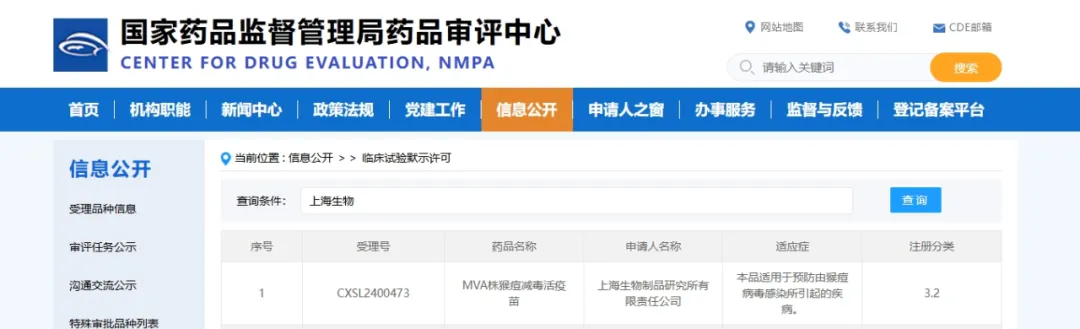
9月9日,国药集团中国生物上海生物制品研究所宣布,其自主研发的MVA株猴痘减毒活疫苗正式获得国家药品监督管理局签发的临床试验通知书,这标志着我国首款针对猴痘病毒的疫苗成功进入临床试验阶段。
据悉,此次获批临床的猴痘减毒疫苗是基于复制缺陷型痘苗病毒MVA株开发,该疫苗株的安全性、有效性已得到充分的临床数据论证。疫苗采用成熟的细胞工厂生产工艺,工艺稳定,质量可靠。经临床前研究证明安全性良好,可在非人灵长类模型中产生针对猴痘病毒攻击的良好免疫保护。
猴痘疫情形势严峻
猴痘是一种病毒性人畜共患病。人感染猴痘的初期症状包括发烧、头痛、肌肉酸痛、背痛、淋巴结肿大,之后可发展为面部和身体大范围皮疹。多数感染者会在几周内康复,但也有感染者病情严重甚至死亡。
自2022年猴痘疫情爆发至今,全球已有超过10万例确诊病例和226例死亡。我国(包括港、澳、台地区)也报告了2567例确诊病例。近期,非洲地区出现了更具致病性和致死性的猴痘新变异株,疫情已扩散至欧洲和东南亚。
当地时间8月14号,世界卫生组织总干事谭德塞宣布,猴痘疫情构成“国际关注的突发公共卫生事件”。这是自2022年7月以来世卫组织第二次就猴痘疫情发布《国际卫生条例》规定的最高级别警告。这一轮猴痘疫情,由“猴痘1b病毒变异株”引发,并迅速传播到布隆迪、肯尼亚、卢旺达和乌干达等十六个国家。
目前,多个国家和地区出入境部门已升级检疫措施防范输入病例,欧洲疾病预防控制中心、新加坡卫生部均采取相应措施应对可能的猴痘流行风险。
8月16日,海关总署网站发布防止猴痘疫情传入我国的公告。公告要求,来自猴痘疫情发生国家(地区)的人员,如接触过猴痘病例或出现发热、头痛、背痛、肌痛、淋巴结肿大、皮疹和黏膜疹等症状,入境时应主动向海关申报,海关人员将按规定程序采取医学措施并开展采样检测;来自猴痘疫情发生国家(地区)且被污染或有被污染可能的交通运输工具、集装箱、货物、物品,应按规定程序实施卫生处理。
疫苗、检测产品研发工作取得显著成果
疫苗是预防传染性疾病最有效的手段,对于控制疫情扩散至关重要。目前,多国已启动疫苗采购与接种计划。例如,刚果(金)已接收首批猴痘疫苗,并计划于2024年10月初启动接种;瑞典亦授权卫生部门订购猴痘疫苗以应对疫情。
我国在猴痘疫苗研发方面也取得显著成果。除了国药集团中国生物北京生物制品研究所与中疾控合作研发的复制缺陷型天坛株猴痘疫苗,国药集团杨晓明团队研发的 mRNA 疫苗、中山大学附属第七医院查高峰副研究员和詹晓勇副研究员团队开发的多价猴痘 mRNA 疫苗、中国科学院微生物研究所高福团队研发的重组蛋白疫苗均显示出显著效果。
在检测方面,国家药品监督管理局于2024年8月18日批准了达安基因的“猴痘病毒核酸检测试剂盒(荧光PCR法)”,这是国内首个获批上市的猴痘病毒检测产品,目前其猴痘试剂盒已面向国内市场销售。
随着研发工作的不断深入,相信未来会有更多安全、有效的猴痘疫苗问世,猴痘疫情的有效控制指日可待。
撰文 | Anna.An
编辑 | Swagpp
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”